Содержание
- 2. 1.Знаходження в періодичній системі та основні характеристики. Ферум належить до VІІІ групи 4 періоду періодичної системи
- 3. Відкриття. Використання заліза почалося набагато раніше, ніж його виробництво. Перші залізні вироби мали космічне (метеоритне) походження
- 4. Поширення в природі. За розповсюдженям у складі земної кори Ферум посідає серед металічних елементів друге місце
- 5. 2. Фізичні властивості. Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м³; температура плавлення 1538
- 6. 3.Хімічні властивості. Залізо належить до металів середньої активності. Хімічно чисте залізо стійке до корозії. Однак незначні
- 7. 4.Добування. Залізо високої чистоти одержують прямим відновленням Fe2O3: Fe2O3 + 3H2 = Fe + 3H2O, або
- 8. 5.Застосування. Залізо — найважливіший метал сучасної техніки. У чистому вигляді залізо майже не використовується, але приблизно
- 9. 6. Найбільш поширені сполуки з Ферумом Ферум зустрічається виключно у сполуках, а найчастіше: червоний залізняк (гематит)
- 11. Скачать презентацию
Слайд 2
1.Знаходження в періодичній системі та основні характеристики.
Ферум належить до VІІІ групи
1.Знаходження в періодичній системі та основні характеристики.
Ферум належить до VІІІ групи
4 періоду періодичної системи хімічних елементів Менделєєва. Ферум - це металічний хімічний елемент з 26 порядковим номером (протонне число) та з відносною атомною масою 56. Він є представником d-елементів. На зовнішньому енергетичному рівні атома Феруму знаходиться два s-електрони, а на передзовнішньому енергетичному рівні відбувається заповнення d-підрівня. У своїх сполуках Ферум здатен проявляти ступені окиснення +2 та +3.
Слайд 3
Відкриття.
Використання заліза почалося набагато раніше, ніж його виробництво. Перші залізні вироби
Відкриття.
Використання заліза почалося набагато раніше, ніж його виробництво. Перші залізні вироби
мали космічне (метеоритне) походження і були виготовлені з уламків метеоритів ще в III–II тис. до н. е. Час від часу знаходили шматки сірувато-чорного металу, який перековували на кинджал або наконечник списа, що був зброєю міцнішою і пластичнішою, ніж бронза, і довше тримав гостре лезо.
За ймовірною версією слово «залізо» українською та споріднені терміни у слов'янських мовах. У грецькій мові похідні від *ghelghos мають значення «мідь» (χαλκος) та «черепаха» (χελυς). З того ж давнього кореня українські «жовно», «жолудь», «залоза», старослов’янське желы, жьлы («черепаха»). Інша версія — від санскритського «джальжа», що означало «метал», «руда». Висловлювалася також думка про запозичення цього слова балто-слов’янами з якоїсь мови доіндоєвропейського населення Європи
За ймовірною версією слово «залізо» українською та споріднені терміни у слов'янських мовах. У грецькій мові похідні від *ghelghos мають значення «мідь» (χαλκος) та «черепаха» (χελυς). З того ж давнього кореня українські «жовно», «жолудь», «залоза», старослов’янське желы, жьлы («черепаха»). Інша версія — від санскритського «джальжа», що означало «метал», «руда». Висловлювалася також думка про запозичення цього слова балто-слов’янами з якоїсь мови доіндоєвропейського населення Європи
Слайд 4
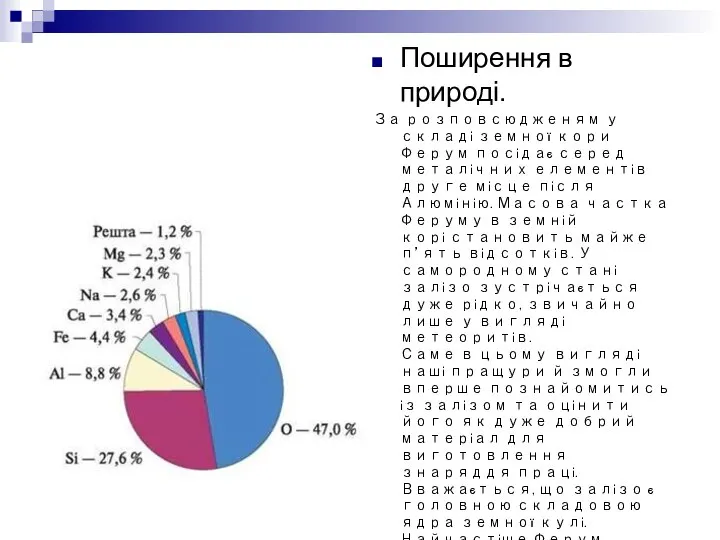
Поширення в природі.
За розповсюдженям у складі земної кори Ферум посідає серед
Поширення в природі.
За розповсюдженям у складі земної кори Ферум посідає серед
металічних елементів друге місце після Алюмінію. Масова частка Феруму в земній корі становить майже п’ять відсотків. У самородному стані залізо зустрічається дуже рідко, звичайно лише у вигляді метеоритів. Саме в цьому вигляді наші пращури й змогли вперше познайомитись із залізом та оцінити його як дуже добрий матеріал для виготовлення знаряддя праці. Вважається, що залізо є головною складовою ядра земної кулі. Найчастіше Ферум зустрічається в природі у складі руд. Найважливішими з них є: магнітний залізняк (магнетит) Fe3O4, червоний залізняк (гематит) Fe2O3, бурий залізняк (лимоніт) Fe2O3·nH2O, залізний колчедан (пірит) FeS2, шпатовий залізняк (сидерит) FeСO3, гетит FeO(OH). У водах багатьох мінеральних джерел міститься Fe(НСO3)2 і деякі інші солі Феруму.
Слайд 5
2. Фізичні властивості.
Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м³; температура
2. Фізичні властивості.
Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м³; температура
плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і вальцюється в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачає феромагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Слайд 6
3.Хімічні властивості.
Залізо належить до металів середньої активності. Хімічно чисте залізо стійке
3.Хімічні властивості.
Залізо належить до металів середньої активності. Хімічно чисте залізо стійке
до корозії. Однак незначні частки домішок позбавляють його цієї властивості.
Залізо згоряє в кисні. Продукт цієї реакції – залізна ожарина:
3Fe + 2O2 = Fe3O4.
Залізо реагує і з іншими неметалами — галогенами, сіркою, вуглецем. При взаємодії з сильними окисниками, наприклад, хлором утворюються сполуки Феруму з ступенем окиснення +3:
2Fe + 3Сl2 = 2FeCl3,
а при взаємодії з менш активними окисниками утворюються сполуки зі ступенем окиснення Феруму +2:
Fe + S = FeS.
За високої температури залізо реагує з водяною парою. У результаті реакції утворюються залізна ожарина і водень:
3Fe + 4H2O Fe3O4 + 4H2↑.
Залізо реагує з розчинами кислот з утворенням солей і виділенням газуватого водню:
Fe + H2SO4 = FeSO4 +H2↑.
Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється щільна оксидна плівка; тому ці концентровані кислоти можна зберігати і транспортувати у сталевих цистернах.
Залізо заміщує менш активні метали при взаємодії з розчинами їх солей:
Fe + CuSO4 = FeSO4 +Cu.
На вологому повітрі залізо зазнає корозії. Її продуктом є іржа. Унаслідок своєї пористості іржа не перешкоджає доступу кисню й вологи до металу, що призводить до подальшого руйнування металу.
Залізо згоряє в кисні. Продукт цієї реакції – залізна ожарина:
3Fe + 2O2 = Fe3O4.
Залізо реагує і з іншими неметалами — галогенами, сіркою, вуглецем. При взаємодії з сильними окисниками, наприклад, хлором утворюються сполуки Феруму з ступенем окиснення +3:
2Fe + 3Сl2 = 2FeCl3,
а при взаємодії з менш активними окисниками утворюються сполуки зі ступенем окиснення Феруму +2:
Fe + S = FeS.
За високої температури залізо реагує з водяною парою. У результаті реакції утворюються залізна ожарина і водень:
3Fe + 4H2O Fe3O4 + 4H2↑.
Залізо реагує з розчинами кислот з утворенням солей і виділенням газуватого водню:
Fe + H2SO4 = FeSO4 +H2↑.
Під дією концентрованих сульфатної та нітратної кислот на поверхні заліза утворюється щільна оксидна плівка; тому ці концентровані кислоти можна зберігати і транспортувати у сталевих цистернах.
Залізо заміщує менш активні метали при взаємодії з розчинами їх солей:
Fe + CuSO4 = FeSO4 +Cu.
На вологому повітрі залізо зазнає корозії. Її продуктом є іржа. Унаслідок своєї пористості іржа не перешкоджає доступу кисню й вологи до металу, що призводить до подальшого руйнування металу.
Слайд 7
4.Добування.
Залізо високої чистоти одержують прямим відновленням Fe2O3:
Fe2O3 + 3H2 = Fe + 3H2O,
або
4.Добування.
Залізо високої чистоти одержують прямим відновленням Fe2O3:
Fe2O3 + 3H2 = Fe + 3H2O,
або
термічним розкладом (150 – 200 0С, 10МПа) ферум пентакарбонілу:
[Fe(CO)5] = Fe + 5CO.
[Fe(CO)5] = Fe + 5CO.
Слайд 8
5.Застосування.
Залізо — найважливіший метал сучасної техніки. У чистому вигляді залізо майже
5.Застосування.
Залізо — найважливіший метал сучасної техніки. У чистому вигляді залізо майже
не використовується, але приблизно 90 % металів, що використовуються людством — це сплави на основі заліза. Заліза виплавляється у світі дуже багато, приблизно в 50 разів більше, ніж алюмінію, не говорячи вже про інші метали. На основі заліза створюють сплави, які здатні витримувати вплив високих і низьких температур, вакууму і високих тисків, агресивних середовищ тощо. Сплави заліза широко застосовують як конструкційні та художні матеріали.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що застосовується в усіх галузях промисловості.
Розрізняють сірий чавун — він не дуже твердий, добре відливається у форми, крихкий і при ударі легко розколюється.
Сталь, на відміну від чавуну, легко піддається куванню і вальцюванню. При швидкому охолодженні вона виходить дуже твердою.
Залізовуглецеві сплави чавун і сталь — основний конструкційний матеріал, що застосовується в усіх галузях промисловості.
Розрізняють сірий чавун — він не дуже твердий, добре відливається у форми, крихкий і при ударі легко розколюється.
Сталь, на відміну від чавуну, легко піддається куванню і вальцюванню. При швидкому охолодженні вона виходить дуже твердою.
Слайд 9
6. Найбільш поширені сполуки з Ферумом
Ферум зустрічається виключно у сполуках, а
6. Найбільш поширені сполуки з Ферумом
Ферум зустрічається виключно у сполуках, а
найчастіше:
червоний залізняк (гематит) – Fe2O3;
магнітний залізняк (магнетит) – Fe3O4;
шпатовий залізняк (сидерит) – FeCO3;
бурий залізняк (лимоніт) – Fe2O3 ∙ H2O;
пірит – FeS2.
а — самородне залізо; б — магнетит; в — гематит; г — лимоніт; ґ — пірит; д — сидерит.
червоний залізняк (гематит) – Fe2O3;
магнітний залізняк (магнетит) – Fe3O4;
шпатовий залізняк (сидерит) – FeCO3;
бурий залізняк (лимоніт) – Fe2O3 ∙ H2O;
пірит – FeS2.
а — самородне залізо; б — магнетит; в — гематит; г — лимоніт; ґ — пірит; д — сидерит.
- Предыдущая
Обмен нуклеотидовСледующая -
Конституция РФ. 9 класс






 Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Использование нефтепродуктов
Использование нефтепродуктов Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний
Определение содержания агрессивных ионов в атмосфере при проведении коррозионных испытаний Гетероциклические соединения
Гетероциклические соединения Обмен жиров
Обмен жиров Химическое сопротивление алюминий и его сплавов
Химическое сопротивление алюминий и его сплавов Кремний и его соединения
Кремний и его соединения Классификация и номенклатура органических соединений. (Лекция 1)
Классификация и номенклатура органических соединений. (Лекция 1) Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Гигиенические нормативы. Химические факторы окружающей среды
Гигиенические нормативы. Химические факторы окружающей среды Обмен липидов
Обмен липидов Радиогеохимия экзогенных процессов
Радиогеохимия экзогенных процессов Капилярлық конденсация. Дәріс 14
Капилярлық конденсация. Дәріс 14 Алкадієни (дiєнові вуглеводні або дiєни)
Алкадієни (дiєнові вуглеводні або дiєни) В мире кристаллов
В мире кристаллов Взаимодействие кислоты с основанием
Взаимодействие кислоты с основанием Витамины. Классификация витаминов
Витамины. Классификация витаминов Термодинамика и термохимия процессов горения и взрыва
Термодинамика и термохимия процессов горения и взрыва Презентация по физике Закон постоянства состава 8 класс
Презентация по физике Закон постоянства состава 8 класс Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Масла и функциональные жидкости
Масла и функциональные жидкости Буровые технологические жидкости для бурения и крепления горизонтальных скважин
Буровые технологические жидкости для бурения и крепления горизонтальных скважин Соли
Соли Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Девиз урока: «Зажечь, увлечь и подвести»
Девиз урока: «Зажечь, увлечь и подвести»