Содержание
- 2. За взаємним розмiщенням подвiйних зв’язкiв алкадiєни подiляються на дієни з кумульованими, спряженими та iзольованими подвійними зв’язками.
- 3. 3. Дiєни з iзольованими подвiйними зв’язками - вуглеводнi, подвiйнi зв’язки яких роздiленi бiльше нiж одним ординарним
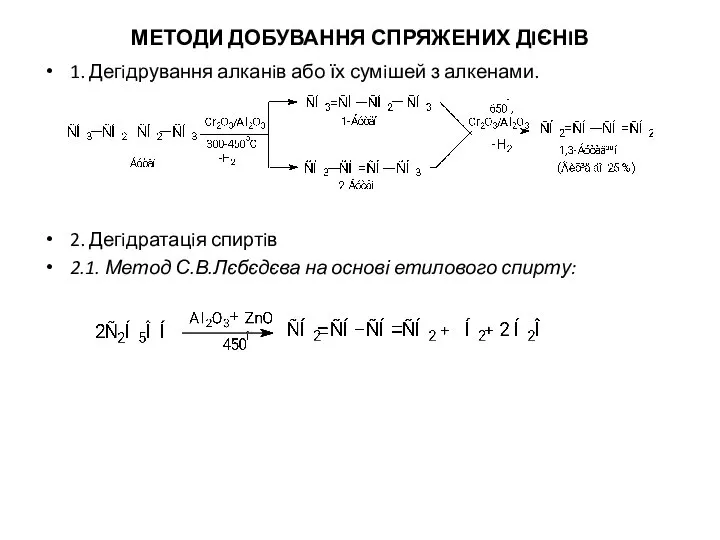
- 4. МЕТОДИ ДОБУВАННЯ СПРЯЖЕНИХ ДIЄНIВ 1. Дегiдрування алканiв або їх сумiшей з алкенами. 2. Дегiдратацiя спиртiв 2.1.
- 5. 2.2. Дегідратація діолів. Дотепер у промисловості застосовують дегiдратацiю двоатомних спиртiв (діолiв). Наприклад, 1,4-бутандiол, який добувають реакцiєю
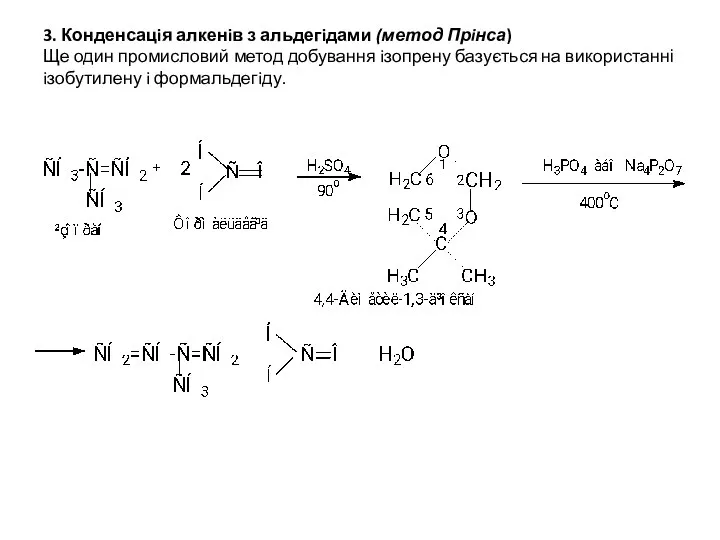
- 6. 3. Конденсацiя алкенiв з альдегiдами (метод Прiнса) Ще один промисловий метод добування iзопрену базується на використанні
- 7. 4. Добування хлоропрену 4.1. З ацетилену (Ю.Ньюленд) 4.2. 3 1,3- бутадiєну Це сучасніший і безпечніший метод
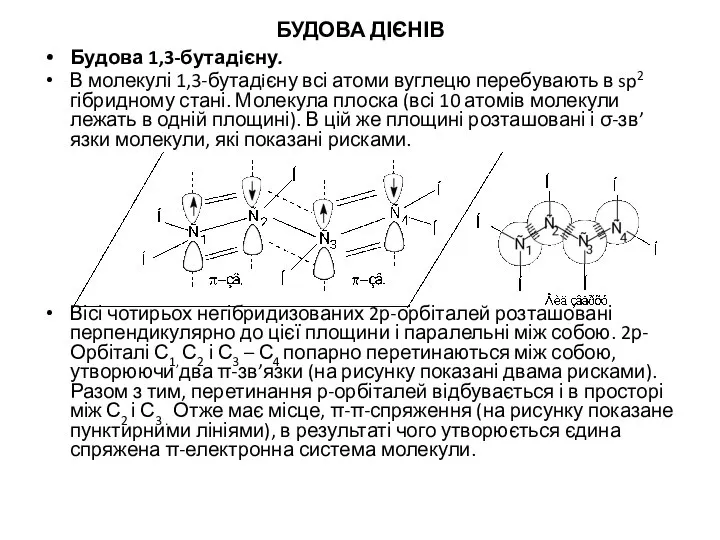
- 8. БУДОВА ДІЄНІВ Будова 1,3-бутадiєну. В молекулі 1,3-бутадiєну всі атоми вуглецю перебувають в sp2 гібридному стані. Молекула
- 9. Така система характеризується підвищеною термодинамічною стабільністю. Так, реальна ентальпія 1,3-бутадiєну на 13,6 кДж/моль менша, ніж розрахована.
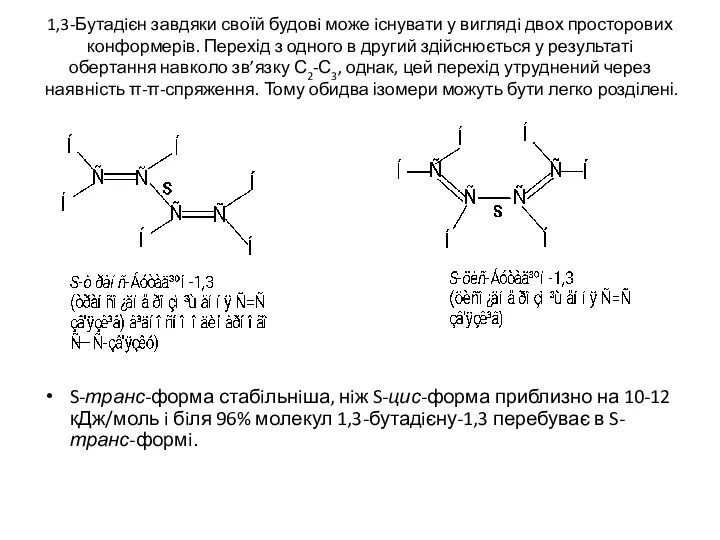
- 10. 1,3-Бутадiєн завдяки своїй будовi може iснувати у виглядi двох просторових конформерiв. Перехід з одного в другий
- 11. ХIМIЧНI ВЛАСТИВОСТI Дiєновi вуглеводнi зi спряженими зв’язками реакцiї приєднання, аналогiчно алкенам. Але алкадiєни, в порiвняннi з
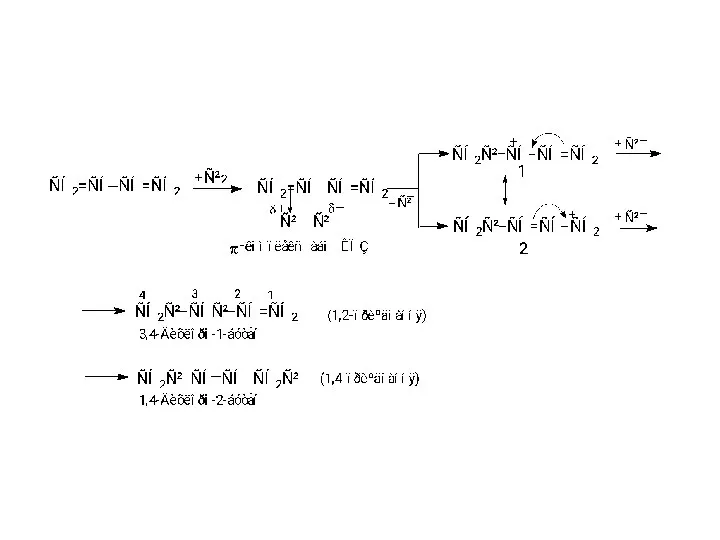
- 13. Приєднання галогенiв за радикальним механiзмом протiкає через стадiю утворення промiжного спряженого радикалу (алiльного типу) з подвiйною
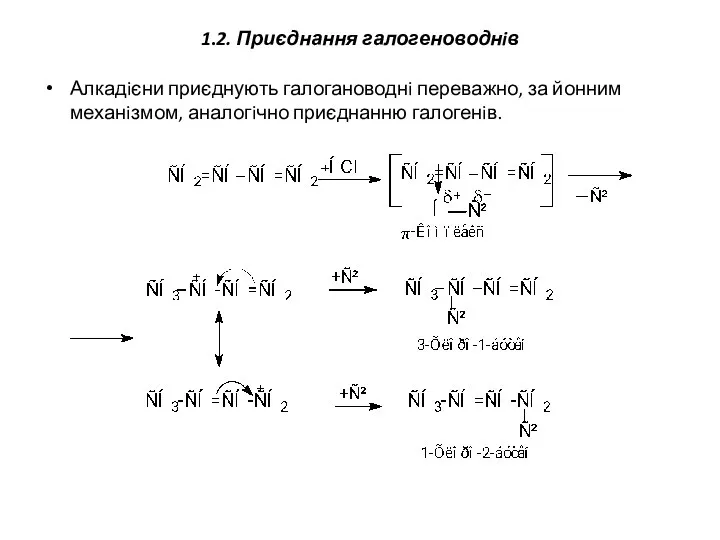
- 14. 1.2. Приєднання галогеноводнiв Алкадiєни приєднують галогановоднi переважно, за йонним механiзмом, аналогiчно приєднанню галогенiв.
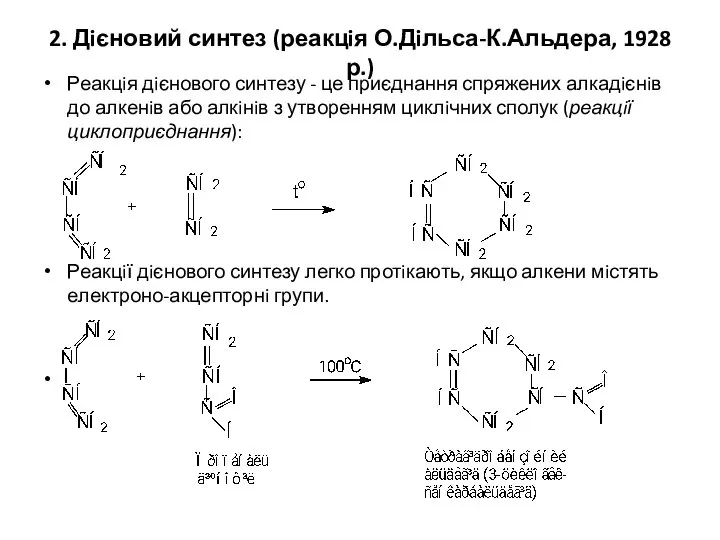
- 15. 2. Дiєновий синтез (реакцiя О.Дiльса-К.Альдера, 1928 р.) Реакцiя дiєнового синтезу - це приєднання спряжених алкадiєнiв до
- 16. 3. Полiмеризацiя алкадiєнiв 1,3-Алкадiєни можуть легко полiмеризуватися за участю положень 1,4- або 1,2-. У реальних системах
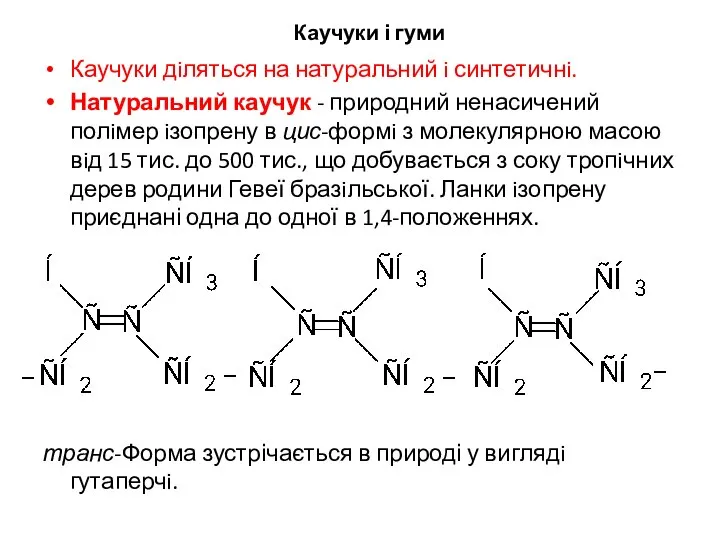
- 17. Каучуки і гуми Каучуки дiляться на натуральний i синтетичнi. Натуральний каучук - природний ненасичений полiмер iзопрену
- 18. Синтетичнi каучуки - аналоги натурального каучуку, що одержують синтетичним шляхом, переважно полімеризацією 1,3-алкадiєнiв. Бутадiєновi каучуки (СКБ)
- 19. Бутадiєн-нiтрильний каучук (СКН) - одержують спiльною полiмеризацiєю 1,3- бутадiєну та акрилонiтрилу (до 40% зв’язаного акрилонiтрилу СН2=СН-CN)
- 21. Скачать презентацию










 Нафтопереробна промисловість України
Нафтопереробна промисловість України  Галогены в организме человека
Галогены в организме человека Нітроген
Нітроген  Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Реакции горения и материальный баланс котла
Реакции горения и материальный баланс котла Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии
Отчет по производственной практике. Место производственной практики ФГБОУ ВО «Пермской ГСХА», кафедра агрохимии Окисно-відновні процеси
Окисно-відновні процеси Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии
Тепловая обработка металлов. Особенности роста кристаллов при фазовых превращениях в твердом состоянии Коррозия металлов
Коррозия металлов II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Динамическая вулканизация термоэластопластов
Динамическая вулканизация термоэластопластов Презентация по Химии "«Нитраты и организм человека»" - скачать смотреть
Презентация по Химии "«Нитраты и организм человека»" - скачать смотреть  Периодический закон и периодическая система Д.И.Менделеева. Лекция 4
Периодический закон и периодическая система Д.И.Менделеева. Лекция 4 Минералдарды зерттеу әдістері
Минералдарды зерттеу әдістері «АТОМНАЯ ЭНЕРГЕТИКА»
«АТОМНАЯ ЭНЕРГЕТИКА»  Пластмасса в жизни людей. Изготовление пластмассы в домашних условиях
Пластмасса в жизни людей. Изготовление пластмассы в домашних условиях Физические и химические свойства воды
Физические и химические свойства воды Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко
Виконали учениці 33-ї групи Виконали учениці 33-ї групи Українського гуманітарного ліцею КНУ імені Тараса Шевченка Клименко Видатні вітчизняні хіміки
Видатні вітчизняні хіміки Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул
Полифункциональные соединения. Гетерофункциональные соединения. Структура и функции биолекул Углеводы (моносахариды, олигосахариды, полисахариды)
Углеводы (моносахариды, олигосахариды, полисахариды) Галогенопроизводные углеводородов. (Лекция 8)
Галогенопроизводные углеводородов. (Лекция 8) Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) (
Периодическая система химических элементов Д.И.Менделеева и строение атомов. (8 класс) ( Структура ЕГЭ по химии. Электролиз
Структура ЕГЭ по химии. Электролиз Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс)