Содержание
- 2. Химическая связь – совокупность сил, удерживающих два и более атома в многоатомной системе. Ковалентная связь –
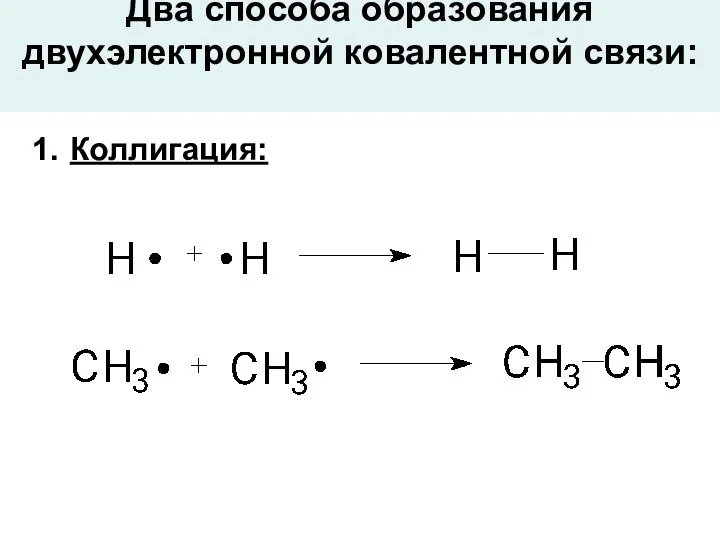
- 3. Два способа образования двухэлектронной ковалентной связи: Коллигация:
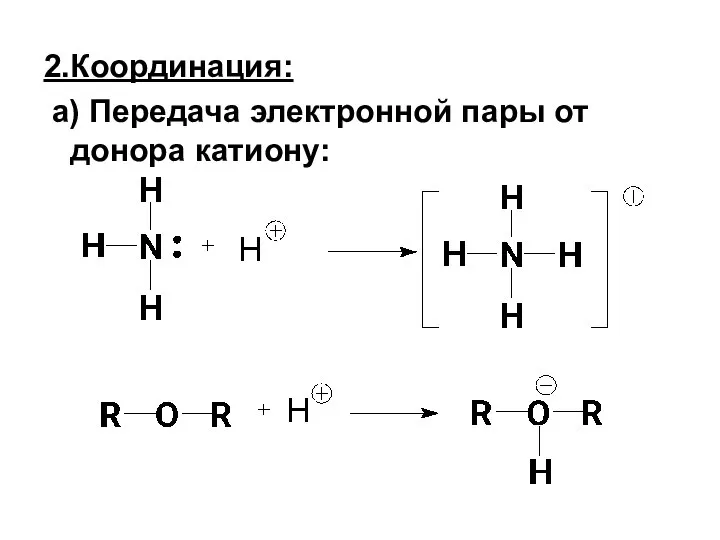
- 4. 2.Координация: а) Передача электронной пары от донора катиону:
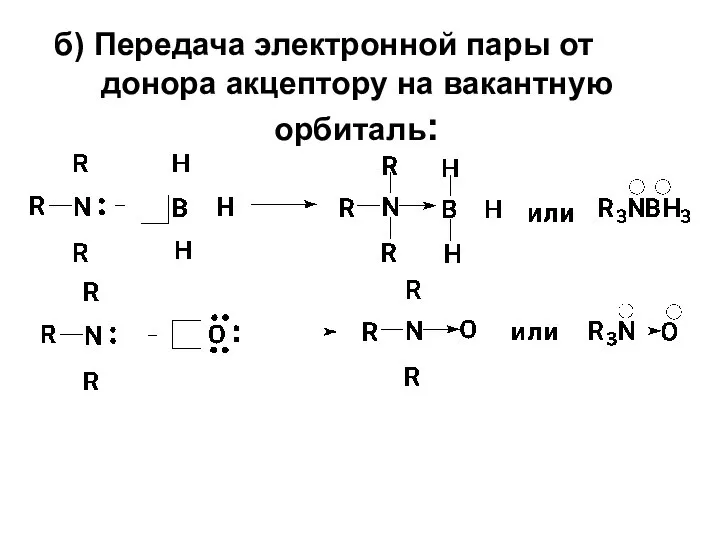
- 5. б) Передача электронной пары от донора акцептору на вакантную орбиталь:
- 6. В основе теории хим. связи лежит волновая теория – квантовая механика. Движение электрона описывается волновой функцией
- 7. оператор Гамильтона. h-постоянная планка. m-масса электрона. r-расстояние между электроном и ядром. E-собственная энергия системы.
- 8. Решение уравнения Шредингера возможно только для простейших систем: для H и H2+. для решения более сложных
- 9. - каждый электрон принадлежит молекуле в целом и движется в поле всех атомных ядер; - каждому
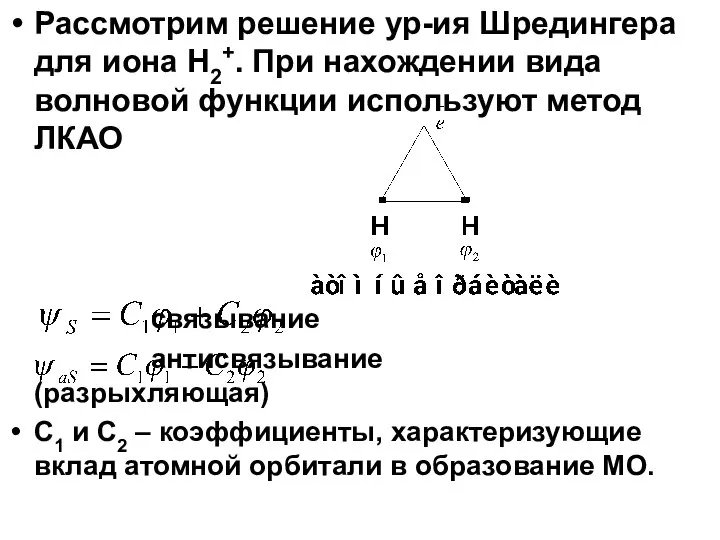
- 10. Рассмотрим решение ур-ия Шредингера для иона H2+. При нахождении вида волновой функции используют метод ЛКАО связывание
- 11. Таким образом, метод МО показывает следующее: Природа сил, обеспечивающих хим. связь носит электрический характер. Движущей силой
- 12. Условия образования МО: Комбинируемые МО близки по энергии. АО, участвующие в образовании МО, должны перекрываться max.
- 13. Классификация МО В зависимости от критерия существует несколько способов классификации: по способу комбинирования АО различают связывающие
- 14. Энергия связывания будет равна: S-интеграл перекрывания S
- 15. Энергия антисвязывания будет равна:
- 16. -кулоновский интеграл, который характеризует кулоновское взаимодействие частиц и включает Е электрона в атоме в основном состоянии,
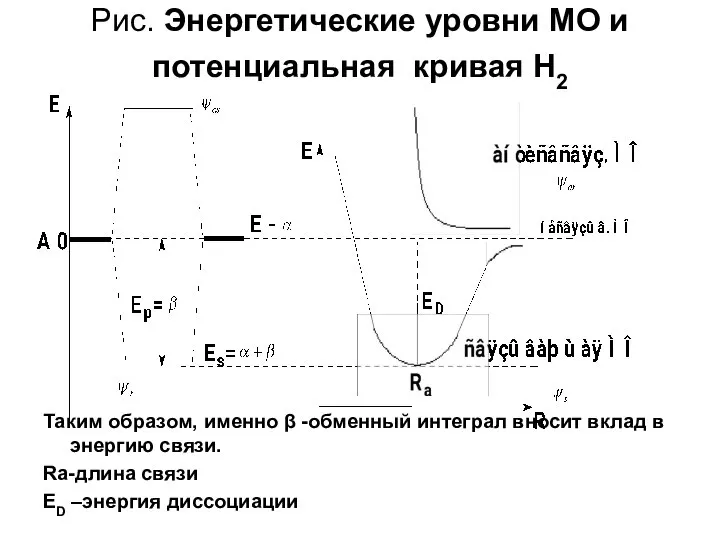
- 17. Рис. Энергетические уровни МО и потенциальная кривая H2 Таким образом, именно β -обменный интеграл вносит вклад
- 18. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА СВЯЗЫВАЮЩИХ И РАЗРЫХЛЯЮЩИХ МО
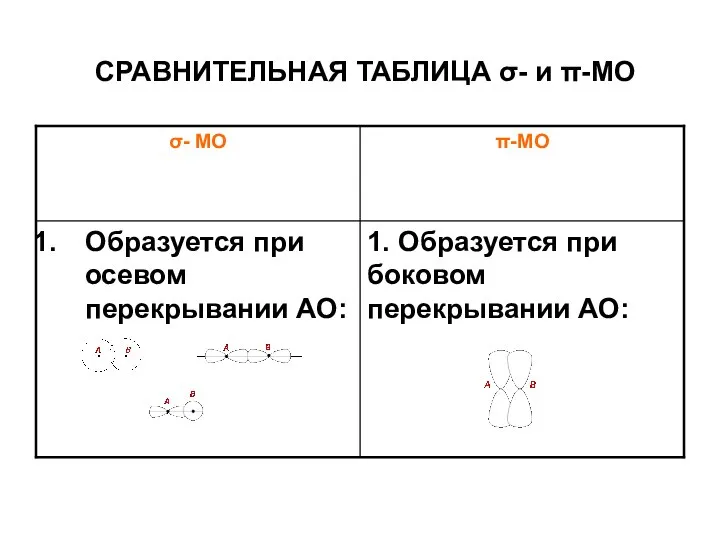
- 19. СРАВНИТЕЛЬНАЯ ТАБЛИЦА σ- и π-МО
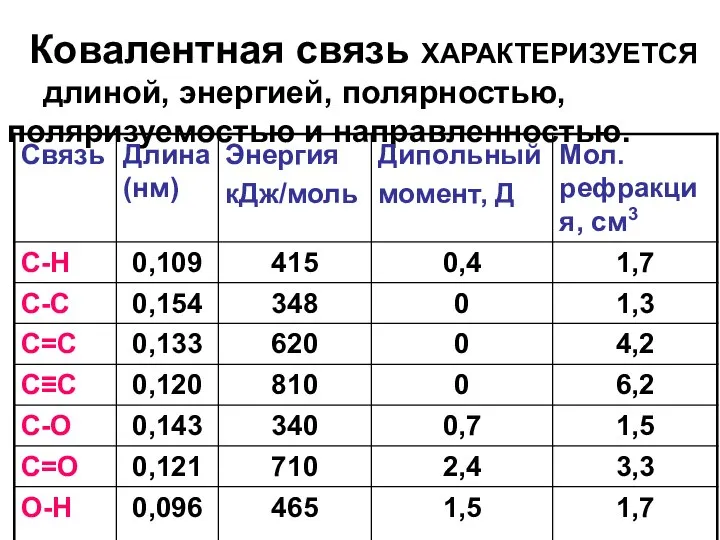
- 21. Ковалентная связь характеризуется: длиной, энергией, полярностью, поляризуемостью и направленностью ДЛИНА СВЯЗИ – равновесное расстояние между центрами
- 22. ЭНЕРГИЯ СВЯЗИ – энергия, которую необходимо затратить, чтобы разорвать химическую связь ( или выделяется при образовании
- 23. Средняя энергия связи Ес – приближенная усредненная величина, получаемая расчетным путем на основе допущения, что все
- 24. Для оценки стабильности молекулы исп. также: ∆На – теплота образования соединений из атомов. Это сумма энергий
- 25. ∆Нс – теплота сгорания соединения. Чем меньше ∆Нс, тем устойчивее молекула, т.е. меньше тепла выделяется при
- 26. ПОЛЯРНОСТЬ СВЯЗИ – асимметрия распределения электронной плотности между атомами вследствие различия их в электроотрицательности. Шкала электроотрицательности
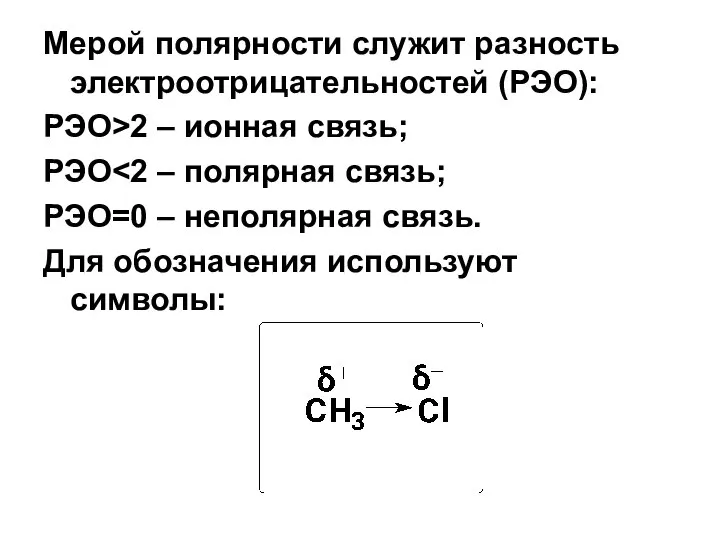
- 27. Мерой полярности служит разность электроотрицательностей (РЭО): РЭО>2 – ионная связь; РЭО РЭО=0 – неполярная связь. Для
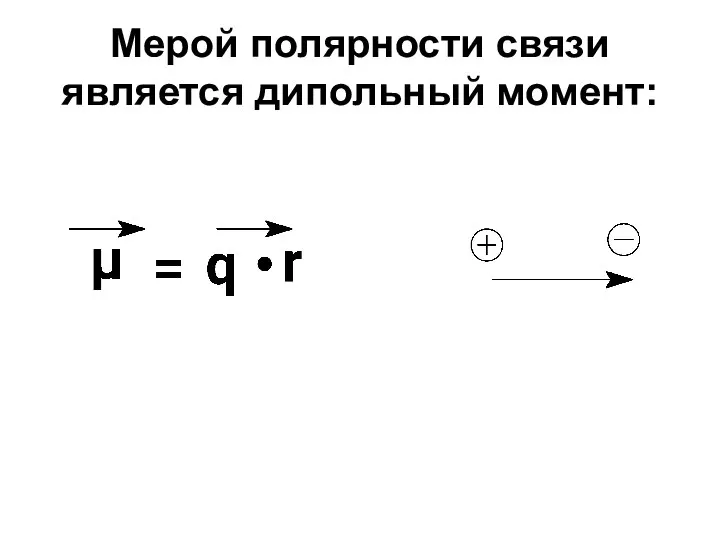
- 28. Мерой полярности связи является дипольный момент:
- 29. ПОЛЯРИЗУЕМОСТЬ – способность изменять свою полярность под действием внешнего поля ( как правило, реагента). Порляризуемость растет
- 30. НАПРАВЛЕННОСТЬ СВЯЗИ определяется гибридным состоянием атома С.
- 31. Ковалентная связь ХАРАКТЕРИЗУЕТСЯ длиной, энергией, полярностью, поляризуемостью и направленностью.
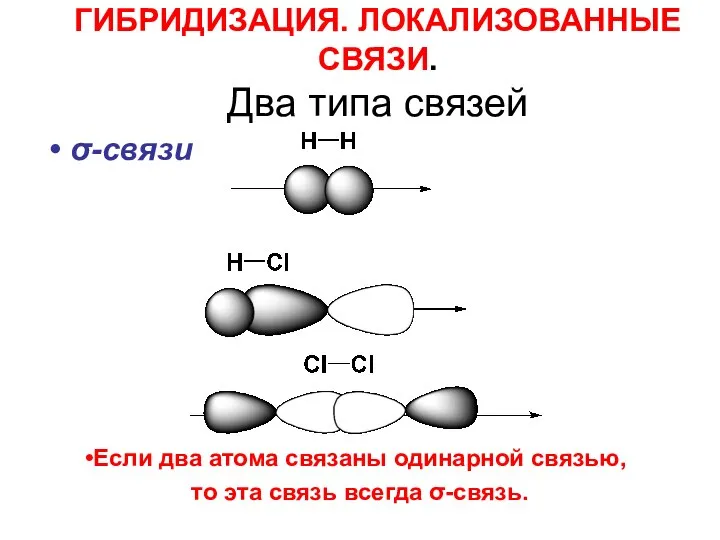
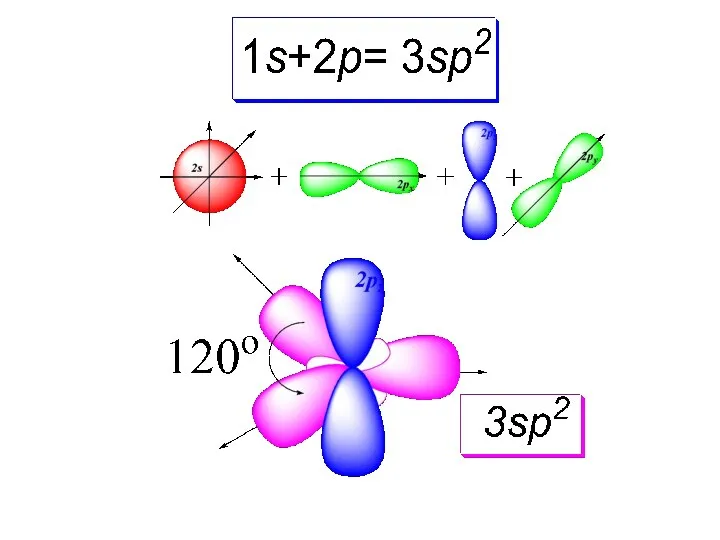
- 32. ГИБРИДИЗАЦИЯ. ЛОКАЛИЗОВАННЫЕ СВЯЗИ. Два типа связей σ-связи Если два атома связаны одинарной связью, то эта связь
- 33. σ - связь это связь, при образовании которой мах. электронная плотность лежит на линии, соединяющей центры
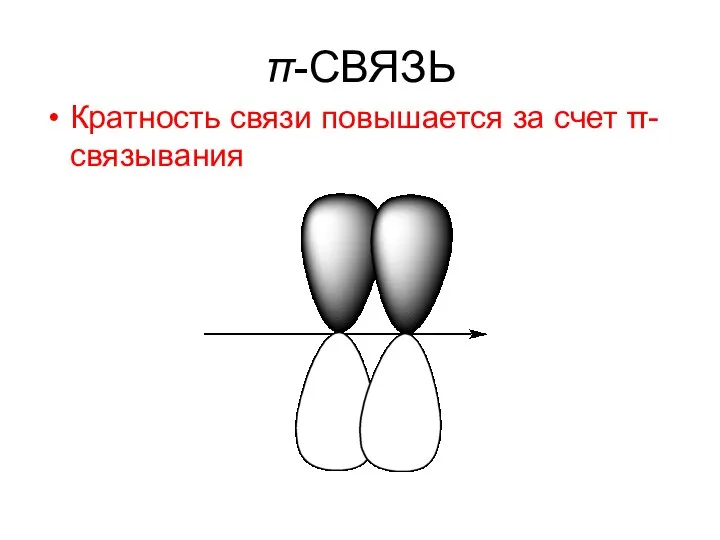
- 34. При образовании кратной связи ( двойной, тройной ) кратность связи повышается за счет π-связывания, то есть
- 35. π-СВЯЗЬ Кратность связи повышается за счет π-связывания
- 36. π - связь - это связь, при образовании которой мах. электронная плотность лежит над и под
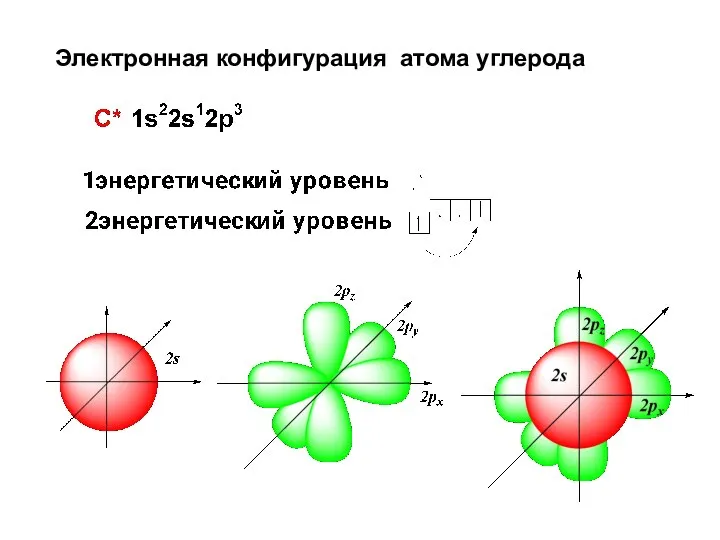
- 37. Электронная конфигурация атома углерода
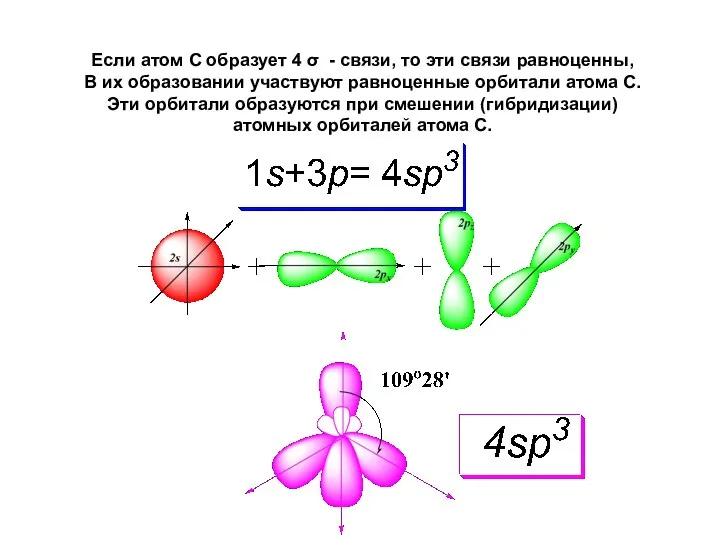
- 38. Если атом С образует 4 σ - связи, то эти связи равноценны, В их образовании участвуют
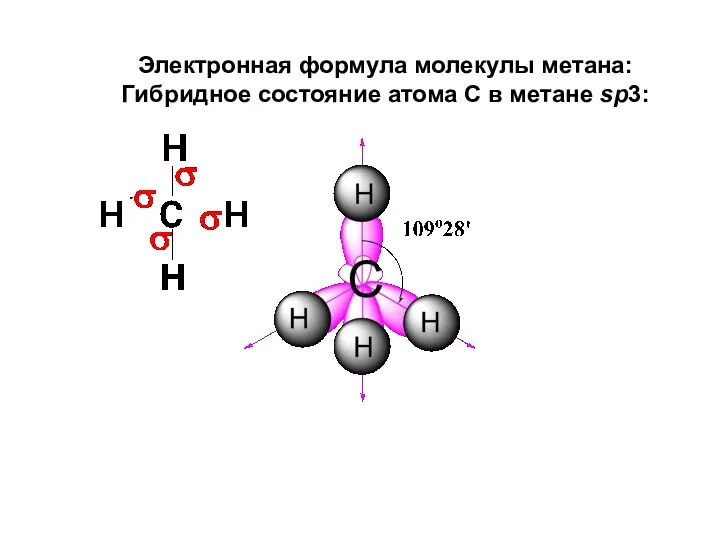
- 39. Электронная формула молекулы метана: Гибридное состояние атома С в метане sp3:
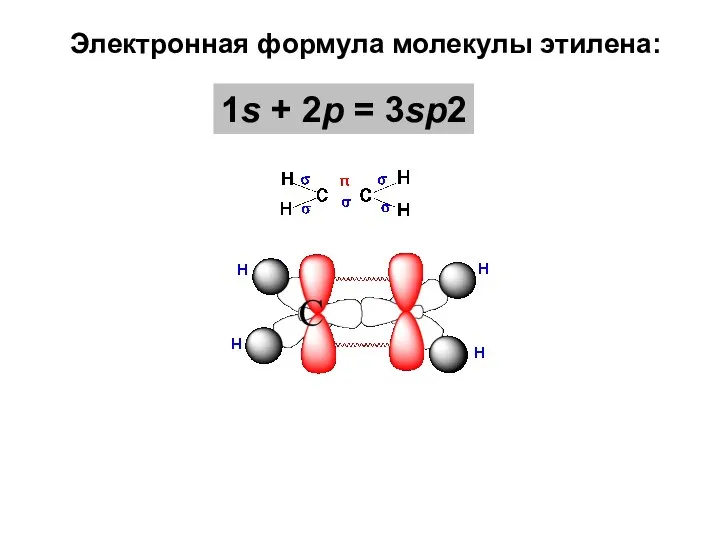
- 41. Электронная формула молекулы этилена: 1s + 2p = 3sp2
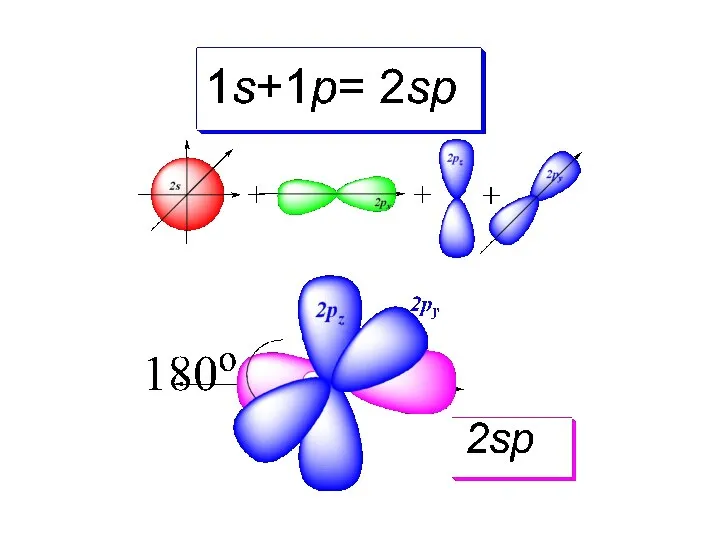
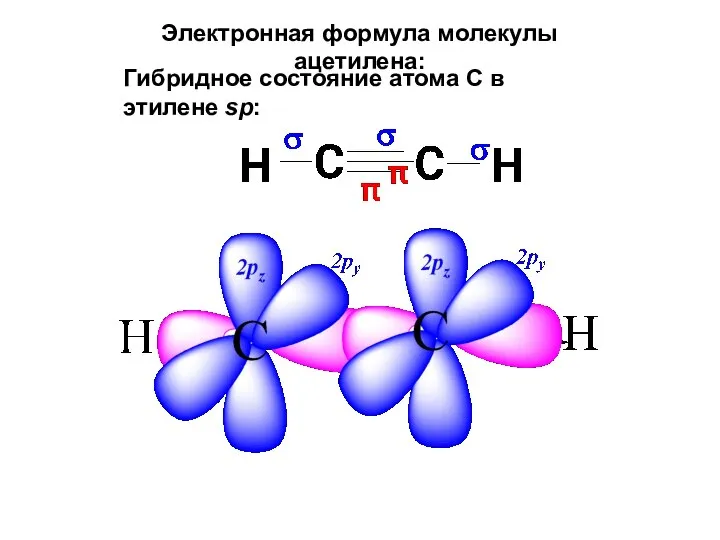
- 43. Электронная формула молекулы ацетилена: Гибридное состояние атома С в этилене sp:
- 44. Электроотрицательность С зависит от его гибридного состояния: sp3 – 2,51 sp2 – 2,59 sp– 2,75
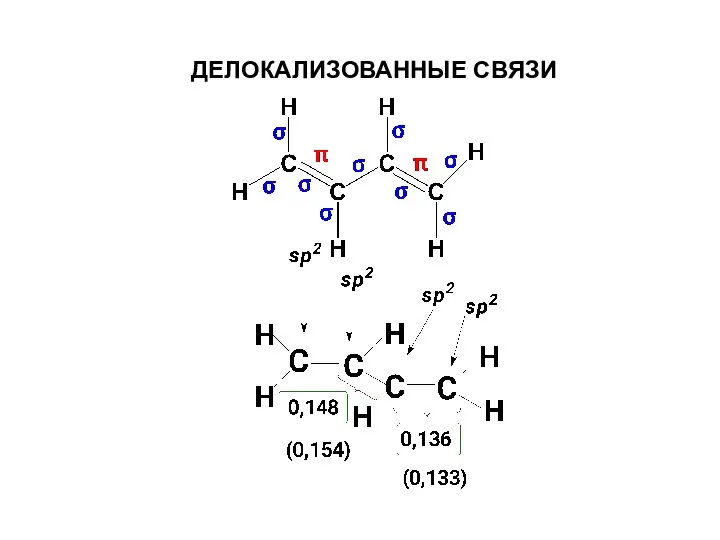
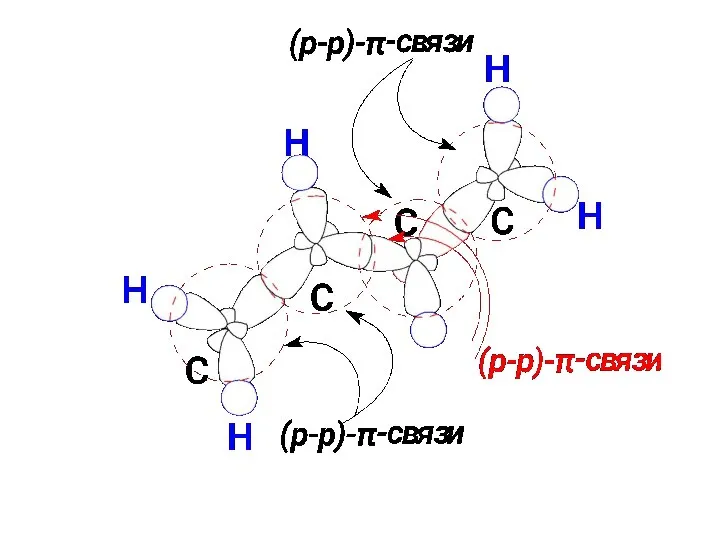
- 45. ДЕЛОКАЛИЗОВАННЫЕ СВЯЗИ
- 46. Отклонение от принципов аддитивности длин и энергий связи ( теплота гидрирования меньше на 3,1 ккал/моль, чем
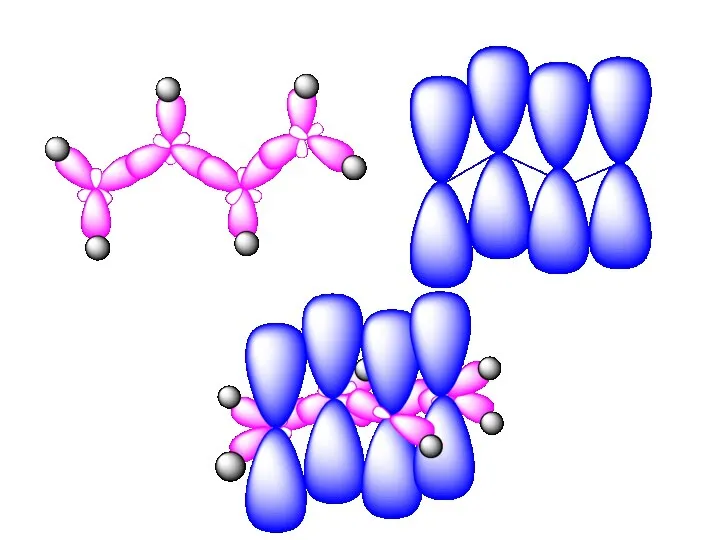
- 49. Под сопряжением (мезомерией) понимают двустороннее перекрывание электронных облаков π-связей с образованием как бы единого электронного облака,
- 50. Классическая формула не полностью отражает строение бутадиена. Предлагается изображать ее набором валентных схем (мезомерных структур):
- 51. Отклонение от принципов аддитивности у сопряженных систем Зная структурную формулу молекулы можно рассчитать согласно принципу аддитивности
- 52. R C=C расч. R C-C расч. > R C-C эксп. – говорит о перераспределении электронной плотности
- 53. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ (СМЕЩЕНИЯ) В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ Индуктивный (или индукционный) эффект I-эффект – обусловлен асимметрией распределения электронного
- 54. I-эффект быстро затухает по цепи σ - связей. I-эффект может быть +I-эффект и -I-эффект. -I-эффект: а)
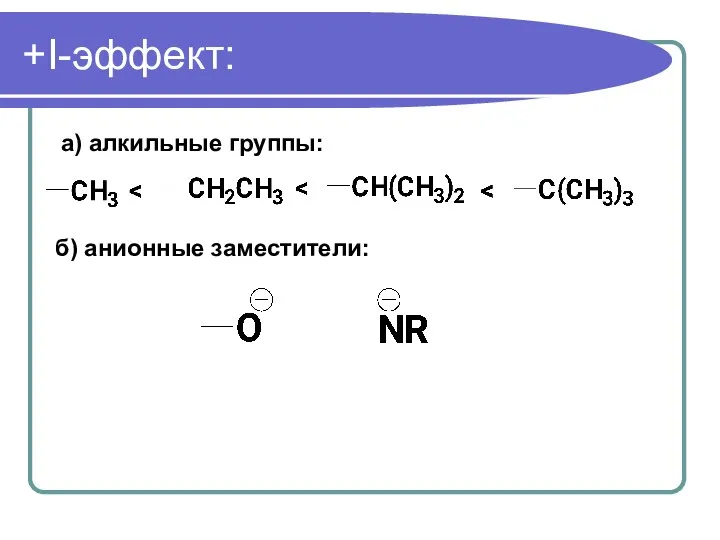
- 55. +I-эффект: а) алкильные группы: б) анионные заместители:
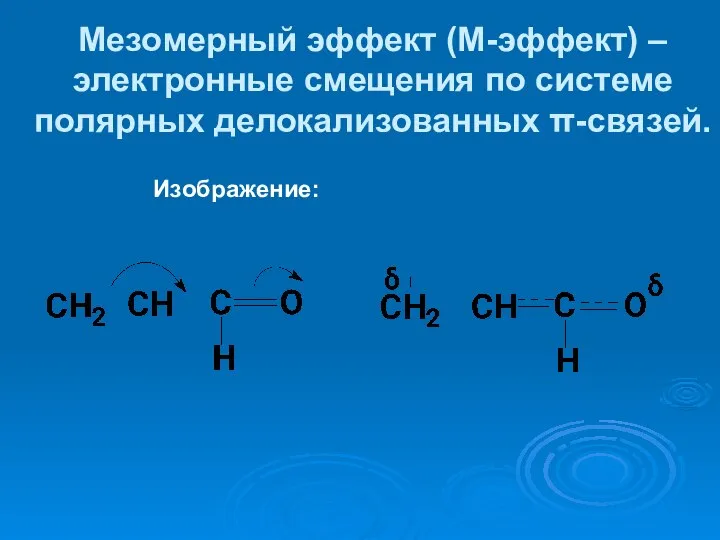
- 56. Мезомерный эффект (М-эффект) –электронные смещения по системе полярных делокализованных π-связей. Изображение:
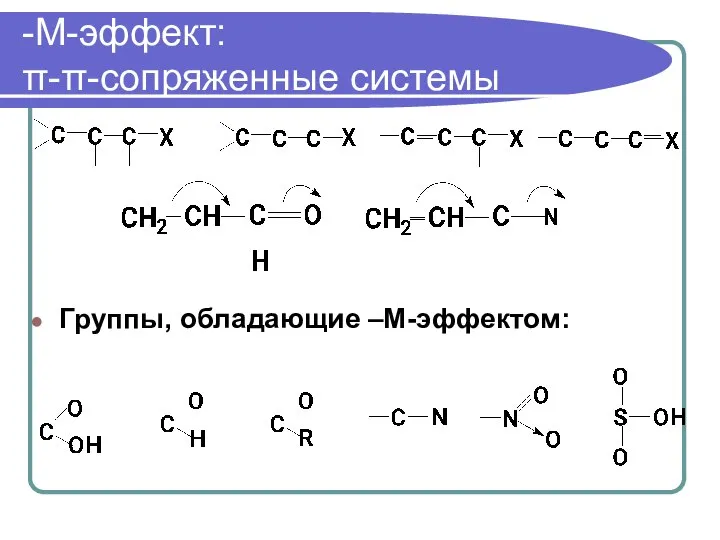
- 57. -М-эффект: π-π-сопряженные системы Группы, обладающие –М-эффектом:
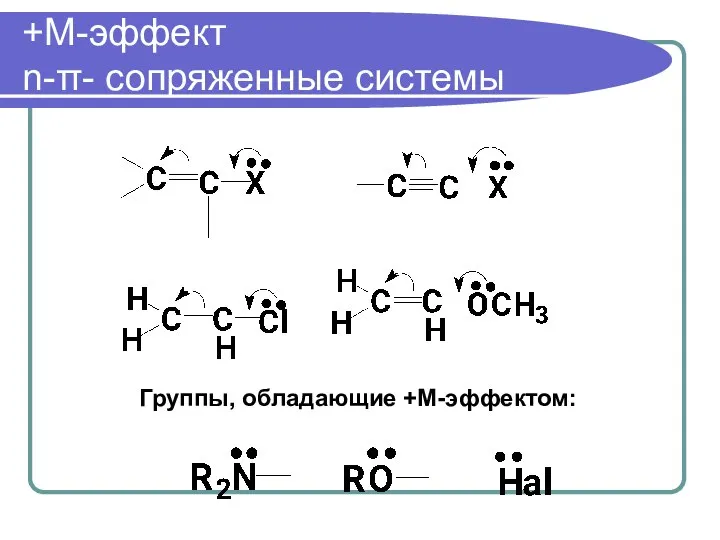
- 58. +М-эффект n-π- сопряженные системы Группы, обладающие +М-эффектом:
- 60. Скачать презентацию
































 Periodic Table of the Elements
Periodic Table of the Elements Аэробное окисление углеводов. (Часть 1)
Аэробное окисление углеводов. (Часть 1) Химический элемент кремний
Химический элемент кремний Виды состояния вещества
Виды состояния вещества Алкины. Гомологический ряд, получение, свойства и применение
Алкины. Гомологический ряд, получение, свойства и применение Массовая доля вещества в растворе Задачи урока Выяснить: 1. Что такое «раствор». 2. Что такое «массовая доля» 3. Как использовать у
Массовая доля вещества в растворе Задачи урока Выяснить: 1. Что такое «раствор». 2. Что такое «массовая доля» 3. Как использовать у Су мен электролиттер алмасуы
Су мен электролиттер алмасуы Н2, NaCl, Ca, HCl
Н2, NaCl, Ca, HCl Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Медь
Медь Химия и производство. Химическая промышленность и химические технологии
Химия и производство. Химическая промышленность и химические технологии Основные классы неорганических соединений
Основные классы неорганических соединений Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Тест: полимеры
Тест: полимеры Ионы. Определение кислотности раствора
Ионы. Определение кислотности раствора Виды химической связи. Кристаллические решетки
Виды химической связи. Кристаллические решетки Жиры. Классификация жиров
Жиры. Классификация жиров Витамин В2 (рибофлавин)
Витамин В2 (рибофлавин) Stereochemistry.Isomers are different compounds
Stereochemistry.Isomers are different compounds Химия и сельское хозяйство
Химия и сельское хозяйство Вермикулитовый концентрат
Вермикулитовый концентрат Презентация по Химии "Многоатомные спирты" - скачать смотреть бесплатно_
Презентация по Химии "Многоатомные спирты" - скачать смотреть бесплатно_ Презентация по Химии "Органическая химия" - скачать смотреть бесплатно
Презентация по Химии "Органическая химия" - скачать смотреть бесплатно Углеводы содержатся в клетках растительных и животных организмов
Углеводы содержатся в клетках растительных и животных организмов Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Презентация по Химии "Взаимосвязь химии и русского языка" - скачать смотреть
Презентация по Химии "Взаимосвязь химии и русского языка" - скачать смотреть  Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Презентация по Химии "окислительно- восстановительные реакции" - скачать смотреть
Презентация по Химии "окислительно- восстановительные реакции" - скачать смотреть