Содержание
- 2. Виды химической связи. Кристаллические решетки
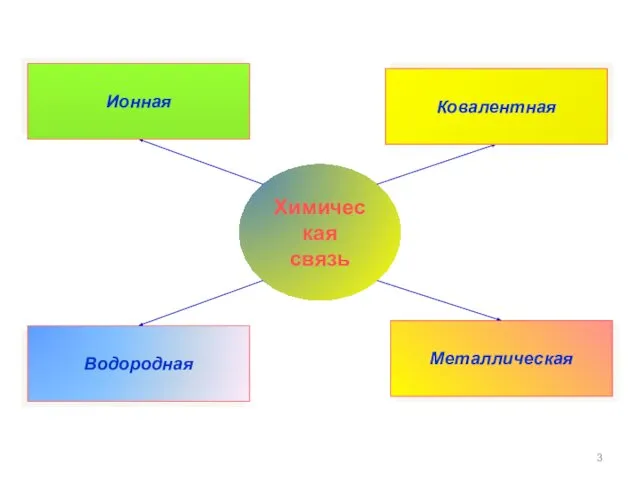
- 3. Химическая связь Водородная Металлическая Ковалентная Ионная
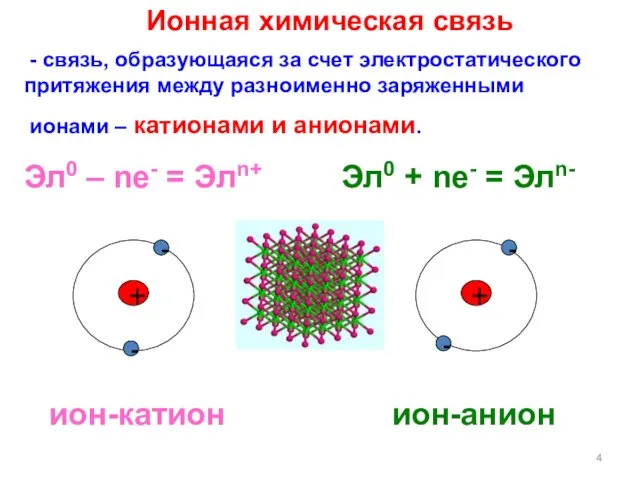
- 4. Ионная химическая связь - связь, образующаяся за счет электростатического притяжения между разноименно заряженными ионами – катионами
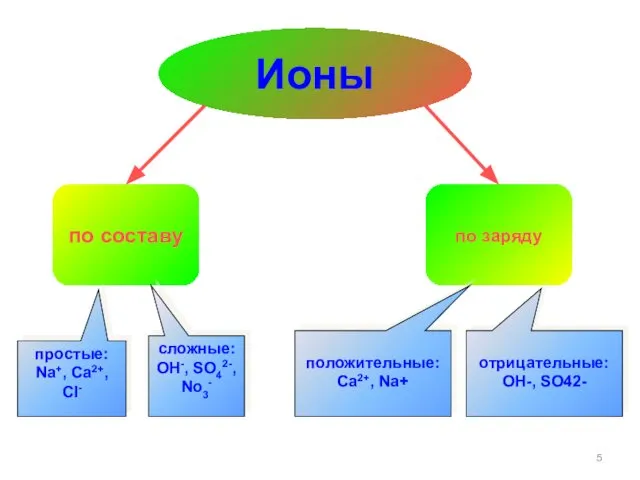
- 5. по составу по заряду простые: Na+, Ca2+, Cl- сложные: OH-, SO42-, No3- положительные: Ca2+, Na+ Ионы
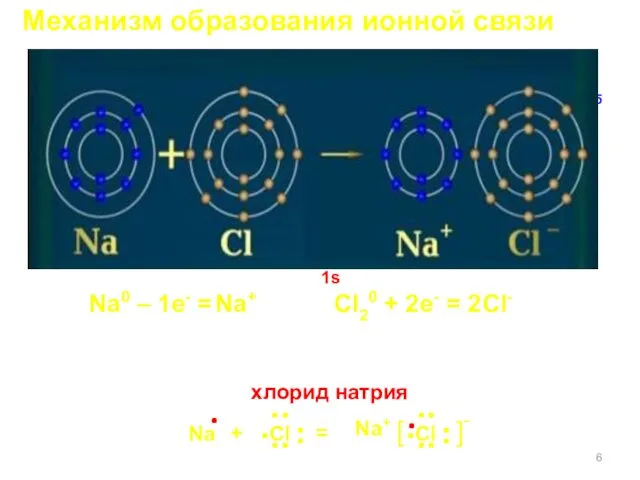
- 6. Механизм образования ионной связи 1s22s22p63s1 1s 2s 3s 2p 1s 2s 3s 2p 3p 1s22s22p63s23p5 Na0
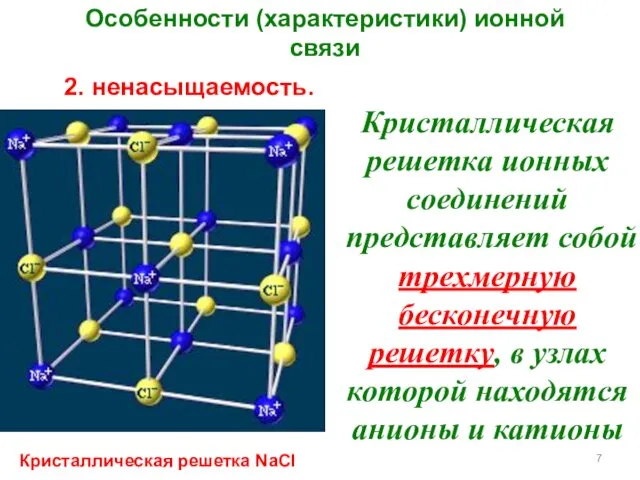
- 7. Особенности (характеристики) ионной связи 2. ненасыщаемость. Кристаллическая решетка ионных соединений представляет собой трехмерную бесконечную решетку, в
- 8. Домашнее задание Флюорит СаF2 Периклаз MgO
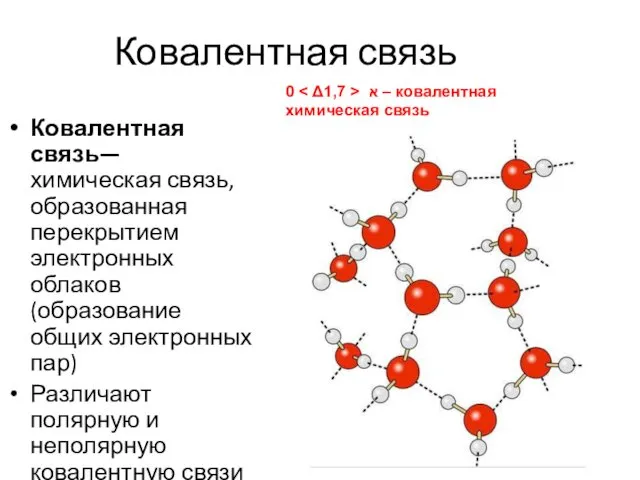
- 9. Ковалентная связь Ковалентная связь— химическая связь, образованная перекрытием электронных облаков (образование общих электронных пар) Различают полярную
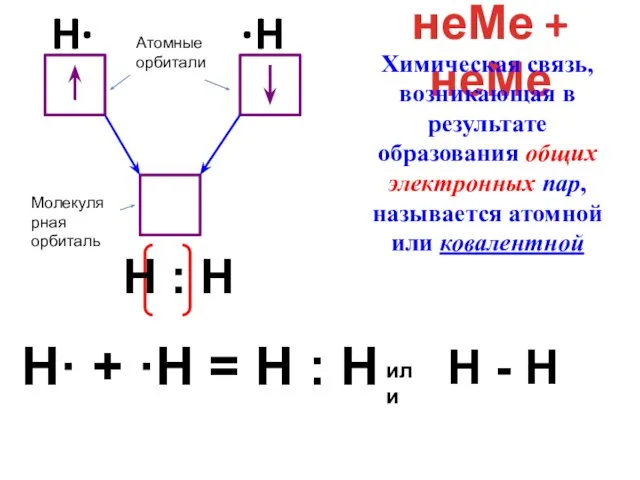
- 10. H· + ·Н = Н : Н неМе + неМе H· ·H Н : Н или
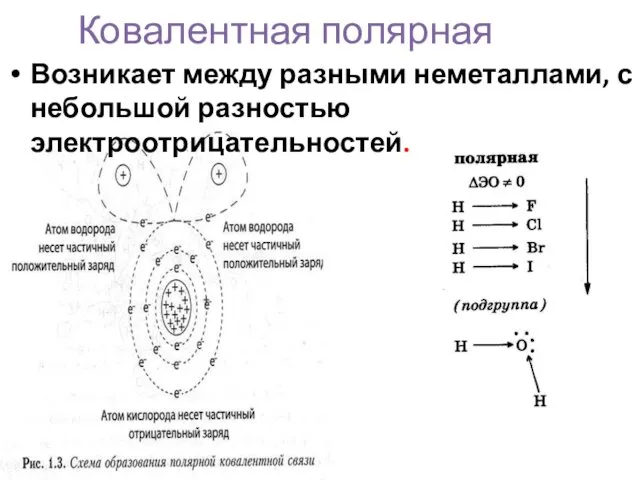
- 11. Ковалентная полярная Возникает между разными неметаллами, с небольшой разностью электроотрицательностей.
- 12. Электроотрицательность Способность атомов химических элементов оттягивать к себе общие электронные пары, называется электроотрицательнос-тью (ЭО)
- 13. Ряд электроотрицательности химических элементов H As I Si P Se C S Br Cl N O
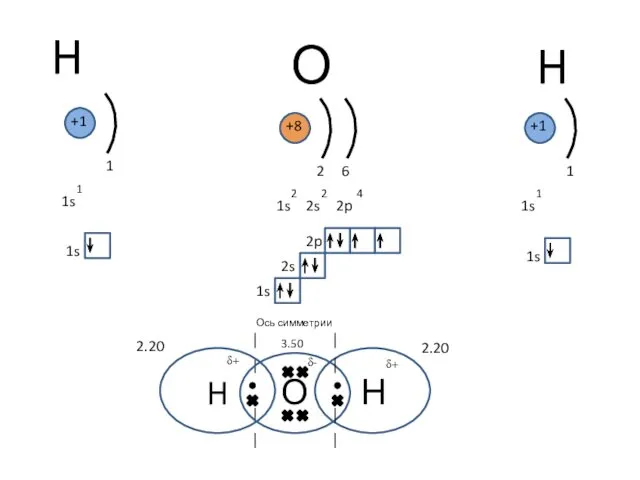
- 14. H 1s 1 1 +1 1s H Н 2.20 +8 1s 2s 2p 2 2 4
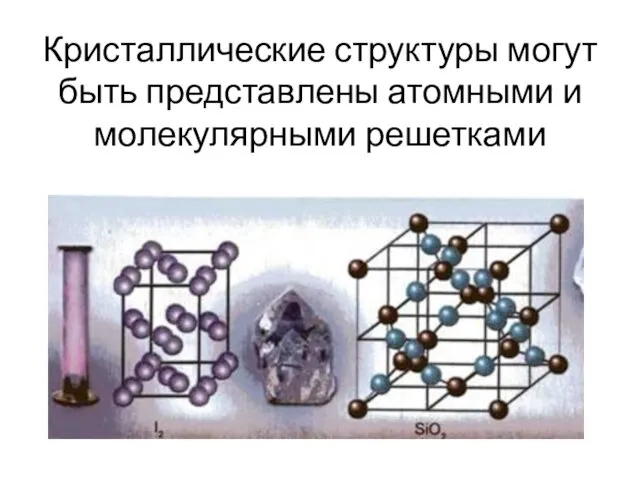
- 15. Кристаллические структуры могут быть представлены атомными и молекулярными решетками
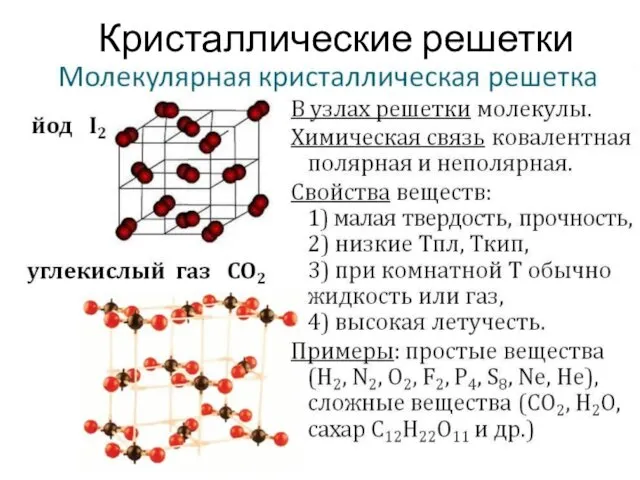
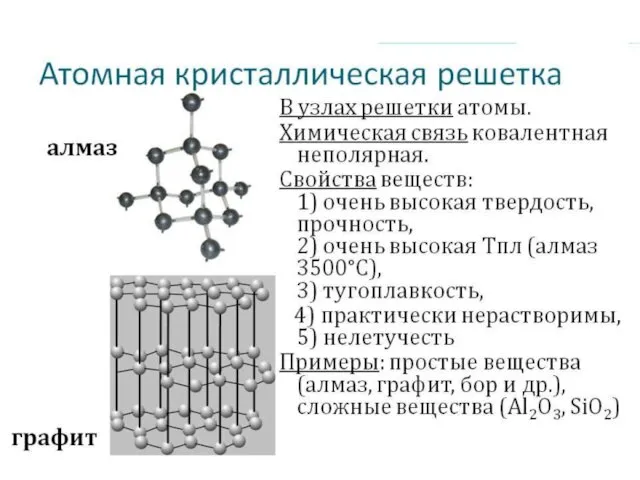
- 16. Кристаллические решетки
- 20. Домашнее задание Конспект в тетради Определить тип химической связи: К2О CS2 Зарисовать схемы образования связи
- 22. Скачать презентацию






 PSKhE
PSKhE Автор: преподаватель химии ФГОУ СПО «АПТ» С.М.Терешкова
Автор: преподаватель химии ФГОУ СПО «АПТ» С.М.Терешкова Кремний и 4 группа. 9 класс
Кремний и 4 группа. 9 класс Электрохимические процессы и явления
Электрохимические процессы и явления Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Белки. Аминокислоты
Белки. Аминокислоты Физические свойства металлов
Физические свойства металлов Презентация по Химии "Методика преподавания химии" - скачать смотреть
Презентация по Химии "Методика преподавания химии" - скачать смотреть  Основные законы и понятия химии. Тема №10
Основные законы и понятия химии. Тема №10 Кремний и его соединения
Кремний и его соединения Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Ди- және полисахаридтер
Ди- және полисахаридтер Масляная кислота
Масляная кислота Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния
Основные методы получения моно- и поликристаллического SiC. Диаграмма состояния Натрий. Роль натрия в организме
Натрий. Роль натрия в организме АМИНАЗИН РАБОТА студентки 5 курса биотехнологического факультета заочного обучения
АМИНАЗИН РАБОТА студентки 5 курса биотехнологического факультета заочного обучения  Експертиза коштовного каміння
Експертиза коштовного каміння prezentatsia_k_diplomu
prezentatsia_k_diplomu Первоначальная периодическая таблица Д.И.Менделеева
Первоначальная периодическая таблица Д.И.Менделеева Динамическая вулканизация термоэластопластов
Динамическая вулканизация термоэластопластов Железо от начала времен до конца средних веков
Железо от начала времен до конца средних веков Гетероциклические соединения
Гетероциклические соединения Окислительно-востановительные реакции
Окислительно-востановительные реакции Кислород- история открытия, роль в природе
Кислород- история открытия, роль в природе Метаболизм углеводов
Метаболизм углеводов Химическая реакция
Химическая реакция Повторение и обобщение знаний по темам "Металлы и сплавы."
Повторение и обобщение знаний по темам "Металлы и сплавы." Глюкоза. Будова глюкози та її властивості
Глюкоза. Будова глюкози та її властивості