Содержание
- 2. УГЛЕРОД УЧИТЕЛЬ ХИМИИ СТАШКОВА А.Э.
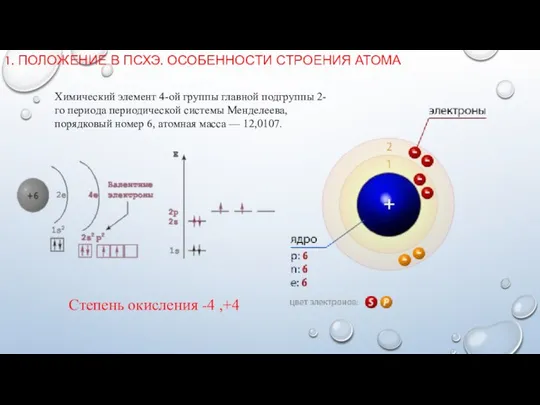
- 3. 1. ПОЛОЖЕНИЕ В ПСХЭ. ОСОБЕННОСТИ СТРОЕНИЯ АТОМА Химический элемент 4-ой группы главной подгруппы 2-го периода периодической
- 4. Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации
- 5. 3. ИЗОТОПЫ УГЛЕРОДА Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С
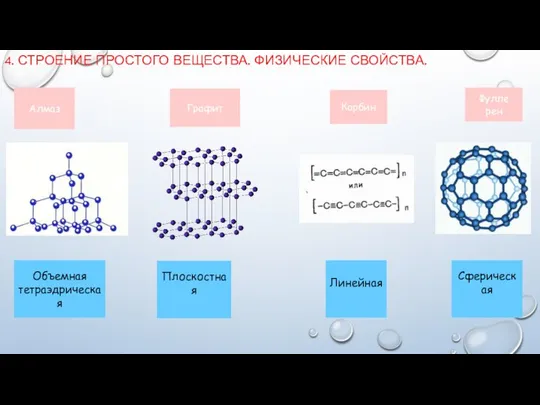
- 6. 4. СТРОЕНИЕ ПРОСТОГО ВЕЩЕСТВА. ФИЗИЧЕСКИЕ СВОЙСТВА. Алмаз Графит Карбин Фулле рен Объемная тетраэдрическая Плоскостная Линейная Сферическая
- 7. Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый Алмаз Алмаз тверже всех найденных в природе веществ,
- 8. Крупнейшие в мире алмазы: “Куллинан” - 3106 карат
- 9. “Эксельсиор” - 971,5 карат
- 10. Орлов” – 190 карат
- 11. Значительные месторождения алмазов находятся в Южной Африке, Бразилии, Якутии. Крупнейший в мире синий алмаз “Хоуп” -
- 12. ТЕМНО-СЕРЫЙ НЕПРОЗРАЧНЫЙ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК МЯГКИЙ МЕТАЛЛИЧЕСКИЙ БЛЕСК ОСТАВЛЯЕТ СЛЕД НА БУМАГЕ ЖИРНЫЙ НА ОЩУПЬ Графит
- 13. Аморфный углерод Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный
- 14. При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2
- 15. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО +
- 16. 5. ОКСИДЫ УГЛЕРОДА. Оксид углерода (II) монооксид углерода, окись углерода С=О 2С + О2 = 2СО
- 17. ФИЗИЧЕСКИЕ СВ-ВА ОКСИДОВ УГЛЕРОДА: CO2 углекислый газ Без цвета Без запаха В воде растворяется 1:1 Применяют
- 18. Оксид углерода (IV) диоксид углерода, двуоокись углерода О=С=О 2СО + О2 = 2СО2 СаСО3 = СО2
- 19. Осуществить цепочку превращений: С→СО→ СО2 → Na2CO3→ NaHCO3 → CO2 C→ CH4→ CO2→ H2CO3→ Na2CO3→ NaNO3
- 20. Какой объем (н.у.) оксида углерода (IV) можно получить при разложении 400г карбоната кальция, содержащего 6% примесей?
- 22. Скачать презентацию

















 Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Дифференциация и индивидуализация как важный фактор повышения качества знаний обучающихся по химии
Дифференциация и индивидуализация как важный фактор повышения качества знаний обучающихся по химии Предмет, задачи, понятия, законы химии
Предмет, задачи, понятия, законы химии Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов Теоретические основы неорганического синтеза
Теоретические основы неорганического синтеза Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья
Изомеризация легких парафиновых углеводородов. Термогидрокаталитические процессы. Гидроочистка нефтяного сырья Презентация по Химии "Явления природы.Физические явления. Химические явления." - скачать смотреть
Презентация по Химии "Явления природы.Физические явления. Химические явления." - скачать смотреть  Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж
Теоретичні основи локалізації та ліквідації пожеж. Визначення витрати вогнегасних речовин для гасіння пожеж Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2)
Основы теории сплавов. Типы сплавов. Диаграммы состояния сплавов, принцип их построения. (Лекция 2)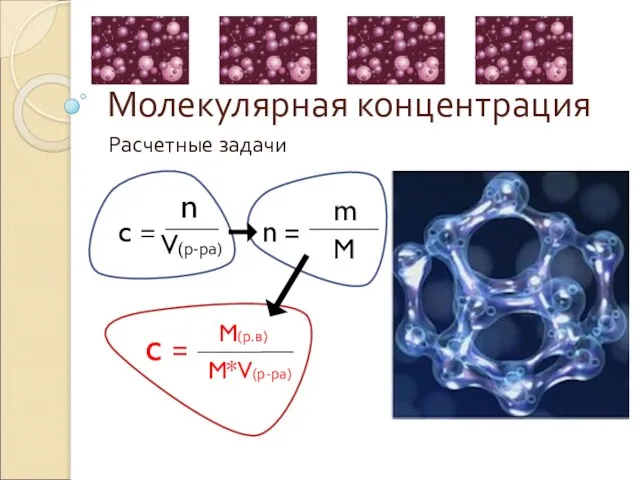 Молекулярная концентрация Расчетные задачи
Молекулярная концентрация Расчетные задачи Химия позволяет раскрыть тайны мироздания
Химия позволяет раскрыть тайны мироздания Радиогеохимия экзогенных процессов
Радиогеохимия экзогенных процессов Решение задач. Органическая химия
Решение задач. Органическая химия Насичені вуглеводні (алкани, парафіни)
Насичені вуглеводні (алкани, парафіни) Язык химии
Язык химии Композиционные или композитные материалы
Композиционные или композитные материалы Бензол и его свойства
Бензол и его свойства Фазовые диаграммы. Диаграммы состояния двухкомпонентных систем
Фазовые диаграммы. Диаграммы состояния двухкомпонентных систем План розміщення добрив у польовій сівозміні. (Лабораторна робота 22)
План розміщення добрив у польовій сівозміні. (Лабораторна робота 22) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Ag аргентум 8. him. Слайд – газета, издание команды Аргентум 8
Ag аргентум 8. him. Слайд – газета, издание команды Аргентум 8 Презентація по темі «Білки та Амінокислоти»
Презентація по темі «Білки та Амінокислоти»  Полярные электронные эффекты в органических соединениях
Полярные электронные эффекты в органических соединениях Презентация по Химии "женщины и химия" - скачать смотреть бесплатно
Презентация по Химии "женщины и химия" - скачать смотреть бесплатно Оксиды. Гидриды
Оксиды. Гидриды Фізичні та хімічні явища
Фізичні та хімічні явища Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Учение о растворах
Учение о растворах