Содержание
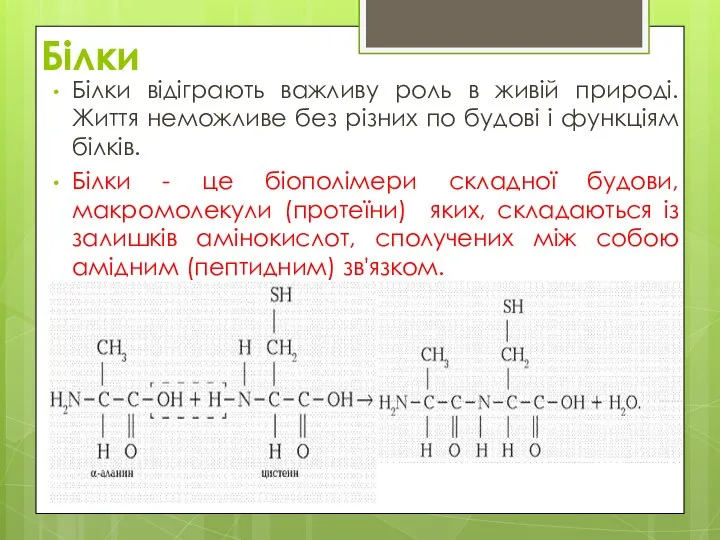
- 2. Білки Білки відіграють важливу роль в живій природі. Життя неможливе без різних по будові і функціям
- 3. Білки відіграють важливу роль в життєдіяльності всіх організмів. При травленні білкові молекули перетравлюються до амінокислот, які,
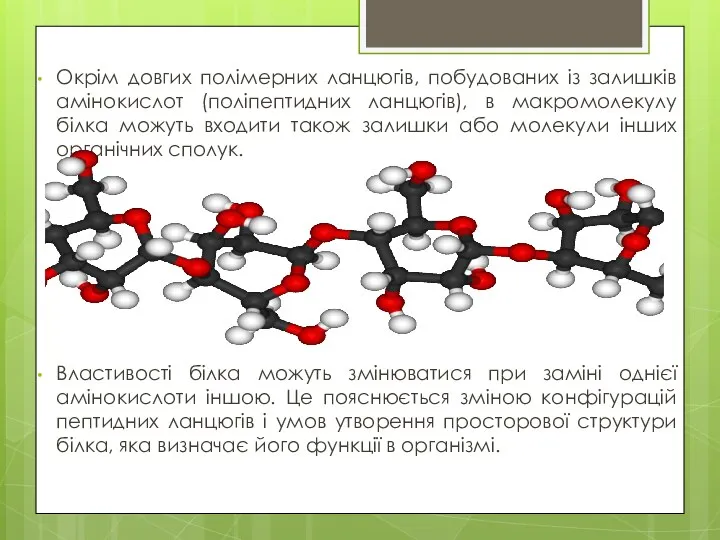
- 4. Окрім довгих полімерних ланцюгів, побудованих із залишків амінокислот (поліпептидних ланцюгів), в макромолекулу білка можуть входити також
- 5. КЛАСИФІКАЦІЯ БІЛКІВ Білки підрозділяються на дві великі групи: прості білки, або протеїни, і складні білки, або
- 6. Протеїди побудовані з протеїнів, сполучених з молекулами іншого типу. Фосфопротеїди містять молекули фосфорної кислоти, зв'язану у
- 7. Це цікаво Число амінокислотних залишків, що входять в молекули окремих білків, дуже різне: у інсуліні 51,
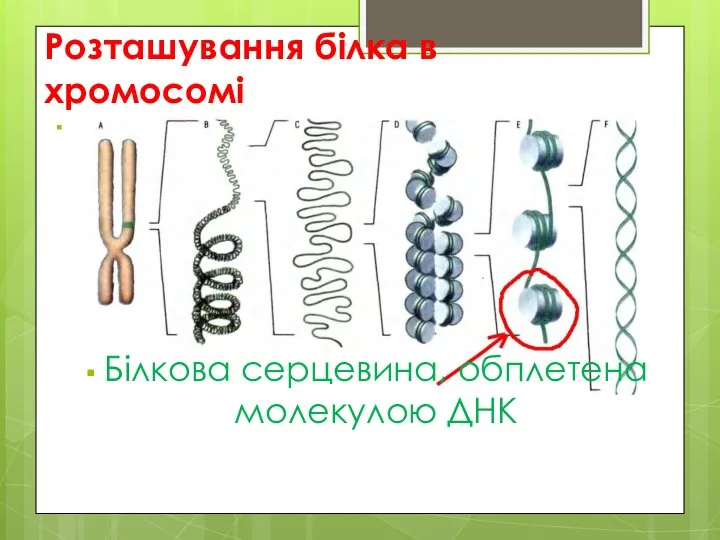
- 8. Розташування білка в хромосомі Білкова серцевина, обплетена молекулою ДНК
- 9. Сьогодні людина вже глибоко пізнала механізми біосинтезу білка і приступила до штучного отримання найважливіших білків на
- 10. Амінокислоти
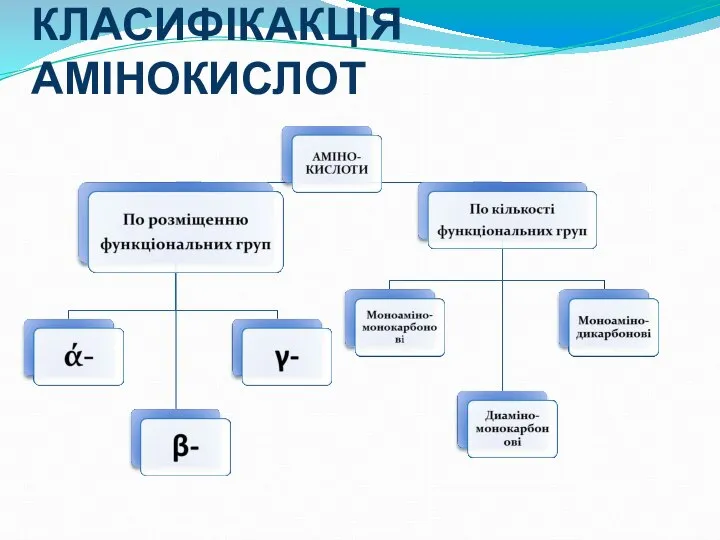
- 11. КЛАСИФІКАКЦІЯ АМІНОКИСЛОТ
- 12. ЗАГАЛЬНА ФОРМУЛА Для ά - амінокислот загальна формула має вигляд: NН2 – СН – СООН І
- 13. Способи отримання Лабораторний Промисловий Оцтова кислота → хлороцтова кислота → амінооцтова кислота СН3-СООН + Сl2 →
- 14. ФІЗИЧНІ ВЛАСТИВОСТІ Тверді кристалічні речовини. Мають високі температури плавлення. Добре розчиняються у воді. Мають різний смак:
- 15. ХІМІЧНІ ВЛАСТИВОСТІ Взаємодіють з кислотами: Н2N-СН2-СООН + НСІ → (Н3N-СН2-СООН)⁺СІ¯ Взаємодіють з лугами: Н2N-СН2-СООН + NaОН
- 16. Використання амінокислот Амінокислоти знаходять широке застосування в якості харчових добавок. Наприклад, на лізин, триптофан, треонін і
- 18. Скачать презентацию











 Планарные потенциометрические сенсоры на основе пилларарена -DNS-162
Планарные потенциометрические сенсоры на основе пилларарена -DNS-162 Нечаев 18
Нечаев 18 Ароматические углеводороды (лекция 10)
Ароматические углеводороды (лекция 10) Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Менделеев Дмитрий Иванович (1834-1907)
Менделеев Дмитрий Иванович (1834-1907) Удивительные свойства воздуха. Открытый урок
Удивительные свойства воздуха. Открытый урок Строение электронных оболочек атомов
Строение электронных оболочек атомов Водородная связь
Водородная связь Природные источники и переработка углеводородов
Природные источники и переработка углеводородов Щелочные металлы
Щелочные металлы Природный газ, его добыча и применение
Природный газ, его добыча и применение Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин)
Производные ксантина (дипрофиллин, ксантинола никотинат, пентоксифиллин) и гедантоина (фенитоин) Выращивание кристаллов из соли
Выращивание кристаллов из соли Классы неорганических соединений
Классы неорганических соединений Характеристика металу Алюміній
Характеристика металу Алюміній Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C
Исследование растворимости в системе уксусная кислота-этиловый спирт-этилацетат-вода методом изотермического титрования при 60˚C Чистые вещества и смеси. Способы разделения смесей. Загадка
Чистые вещества и смеси. Способы разделения смесей. Загадка Составить структурные формулы
Составить структурные формулы СПИРТЫ В ЖИЗНИ ЧЕЛОВЕКА Автор проекта: учитель химии МОУ «Петровская СОШ» Волохина С.А.
СПИРТЫ В ЖИЗНИ ЧЕЛОВЕКА Автор проекта: учитель химии МОУ «Петровская СОШ» Волохина С.А.  Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции в растворах Сульфат меди
Сульфат меди Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив
Автомобильные бензины и дизельные топлива. Характеристика и классификация автомобильных топлив Как вырастить кристалл
Как вырастить кристалл Методические рекомендации к изучению темы: Фосфор и его соединения. Выполнила: студентка 42бгр. Сподина Светлана.
Методические рекомендации к изучению темы: Фосфор и его соединения. Выполнила: студентка 42бгр. Сподина Светлана. Тривиальные названия неорганических соединений
Тривиальные названия неорганических соединений Щелочные металлы
Щелочные металлы Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Химические реакции
Химические реакции