Содержание
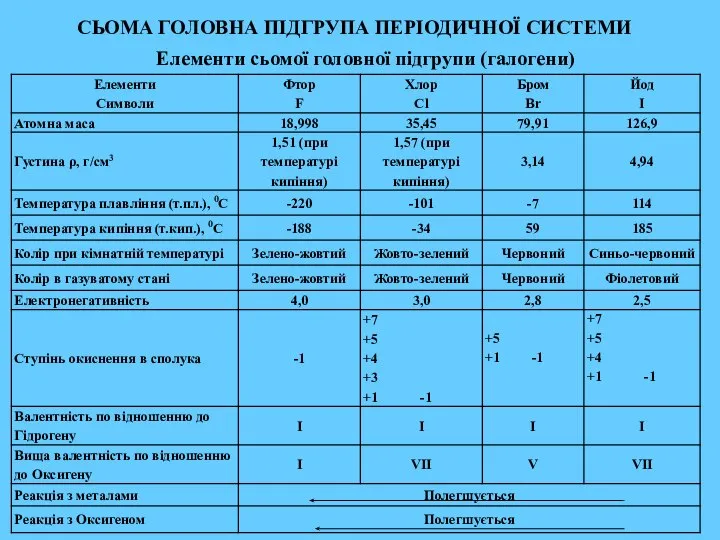
- 2. СЬОМА ГОЛОВНА ПІДГРУПА ПЕРІОДИЧНОЇ СИСТЕМИ Елементи сьомої головної підгрупи (галогени)
- 3. VII ГОЛОВНА ПІДГРУПА ПСЕ (ГАЛОГЕНІВ). ЗАГАЛЬНА ХАРАКТЕРИСТИКА ГАЛАГЕНІВ.
- 5. ХЛОР (Сl) ЗАГАЛЬНА ХАРАКТЕРИСТИКА ЕЛЕМЕНТА
- 7. Рис. 6. Вміст продуктів ПОЛ у жовтку яєць дослідних груп гусей, (М± м, n=5).
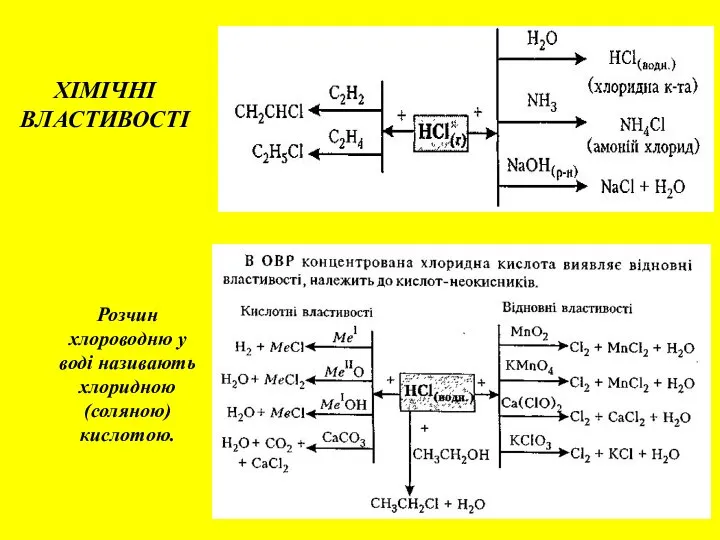
- 11. Розчин хлороводню у воді називають хлоридною (соляною) кислотою. ХІМІЧНІ ВЛАСТИВОСТІ
- 12. ОКСИГЕНОВМІСНІ СПОЛУКИ ХЛОРУ Хімічні властивості
- 13. ОКСИГЕНОВМІСНІ КИСЛОТИ ХЛОРУ ТА ЇХ СОЛІ Відомо чотири оксигеновмісні кислоти, що містять Хлор
- 21. ФЛУОР, БРОМ, ЙОД Флуор – найактивніший галоген. Він взаємодіє з багатьма металами, з виділенням великої кількості
- 22. ЗАСТОСУВАННЯ ГАЛОГЕНІВ ТА ЇХ СПОЛУК
- 23. Хлор має багато застосувань. Він застосовується у виробництві хлороводневої кислоти, деяких органічних розчинників, а також як
- 24. Основними харчовими джерелами йоду є морепродукти, жир із печінки тріски, фрукти і овочі. Частина кухонної солі
- 26. Скачать презентацию





















 Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Выдающиеся ученые - химики и их заслуги
Выдающиеся ученые - химики и их заслуги Альбітит-грейзенові родовища
Альбітит-грейзенові родовища Синтетические лекарственные средства
Синтетические лекарственные средства Презентация по химии на тему: «Применение кислорода»
Презентация по химии на тему: «Применение кислорода» Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Вчені - хіміки
Вчені - хіміки  Кинетика химических реакций. Основные понятия и законы химической кинетики
Кинетика химических реакций. Основные понятия и законы химической кинетики Роль женщин в химическом образовании и науке
Роль женщин в химическом образовании и науке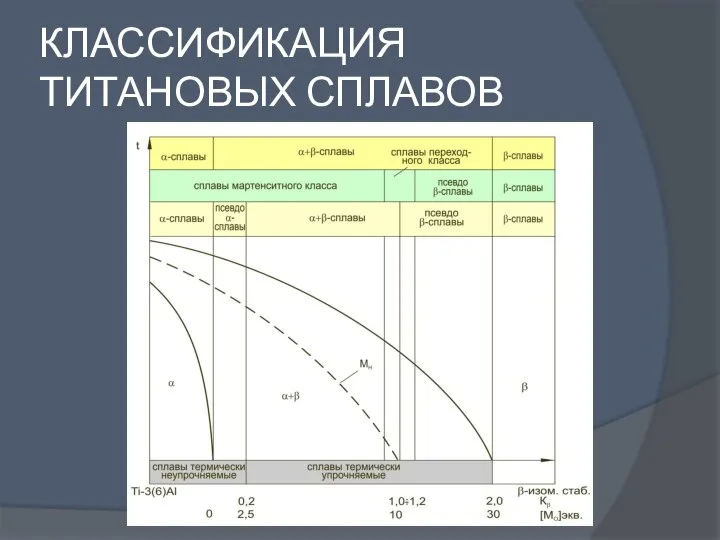 Классификация титановых сплавов
Классификация титановых сплавов Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота
Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота Бета-окисление жирных кислот
Бета-окисление жирных кислот Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.
Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.  Электрохимические методы анализа
Электрохимические методы анализа Превращение веществ в одной среде
Превращение веществ в одной среде Атомы и молекулы
Атомы и молекулы Дослід Ознайомлення зі змістом етикеток харчових продуктів
Дослід Ознайомлення зі змістом етикеток харчових продуктів  Адсорбционные равновесия. Межмолекулярные взаимодействия при адсорбции
Адсорбционные равновесия. Межмолекулярные взаимодействия при адсорбции Арены. 10 класс
Арены. 10 класс Горение вещества и способы его прекращения
Горение вещества и способы его прекращения Противомикробное средство растительного происхождения, хлорофиллипт
Противомикробное средство растительного происхождения, хлорофиллипт Химические свойства оксидов
Химические свойства оксидов Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.  Явище ізомерії. Структурна ізомерія Близнюки органічного світу
Явище ізомерії. Структурна ізомерія Близнюки органічного світу  Типы изомерии
Типы изомерии Тест по теме Алкины
Тест по теме Алкины