Содержание
- 2. Химическая кинетика – учение о скоростях химических реакций и влиянии различных факторов на скорость. Задачи химической
- 3. Химическая кинетика изучает протекание процессов во времени, т.е. в неравновесном состоянии системы. Основная кинетическая характеристика –
- 13. ПРИЧИНЫ НЕСОВПАДЕНИЯ МОЛЕКУЛЯРНОСТИ И ПОРЯДКА
- 15. Основной постулат формальной кинетики объединяет два подхода к описанию скорости реакции : КИНЕТИКА НЕОБРАТИМЫХ РЕАКЦИЙ ЦЕЛОГО
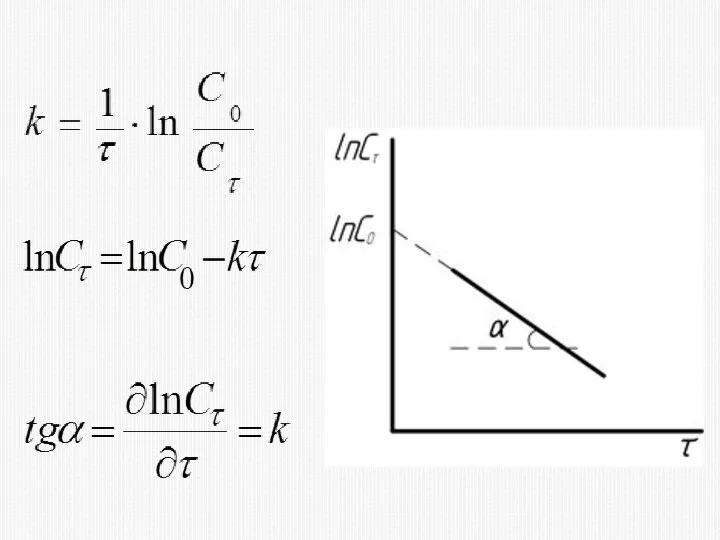
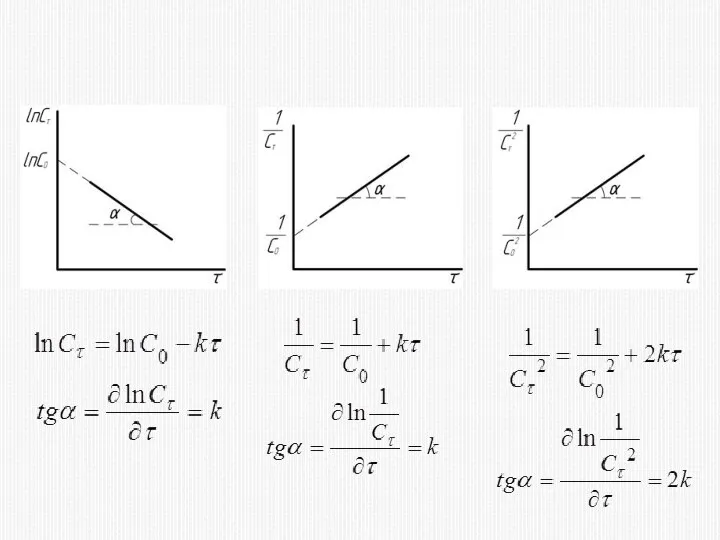
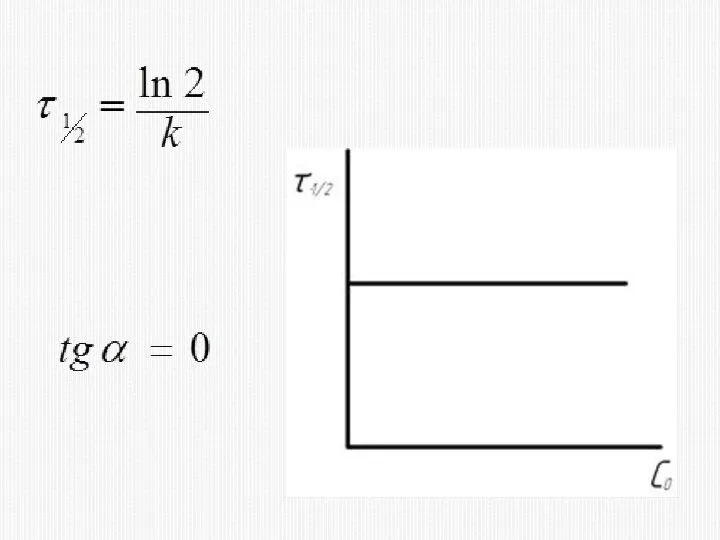
- 16. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ ПЕРВОГО ПОРЯДКА
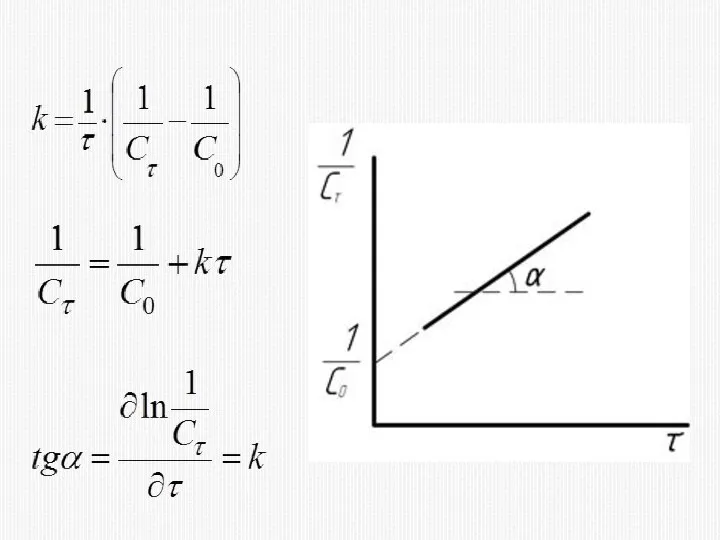
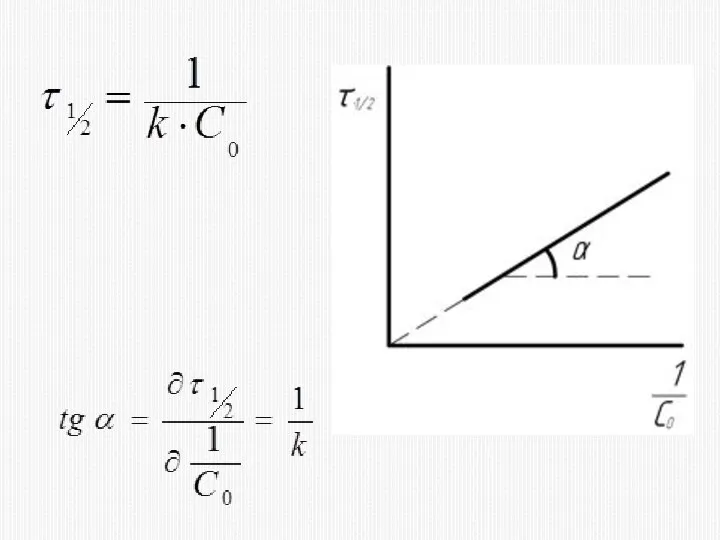
- 20. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ ВТОРОГО ПОРЯДКА
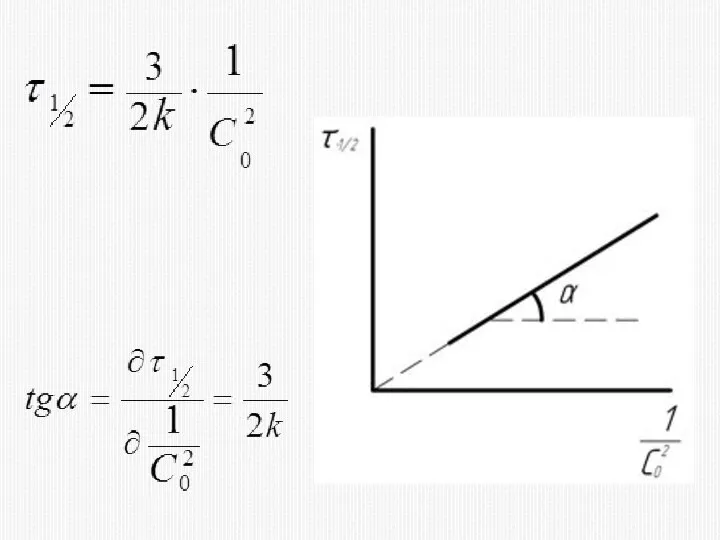
- 23. КИНЕТИЧЕСКОЕ УРАВНЕНИЕ РЕАКЦИИ ТРЕТЬЕГО ПОРЯДКА
- 25. Порядок реакции является эмпирической величиной и не может быть рассчитан теоретически, если не известен механизм реакции.
- 27. метод подстановки (аналитический и графический) метод времени полупревращения метод Оствальда-Нойеса (аналитический) ИНТЕГРАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ
- 28. 1) МЕТОД ПОДСТАНОВКИ
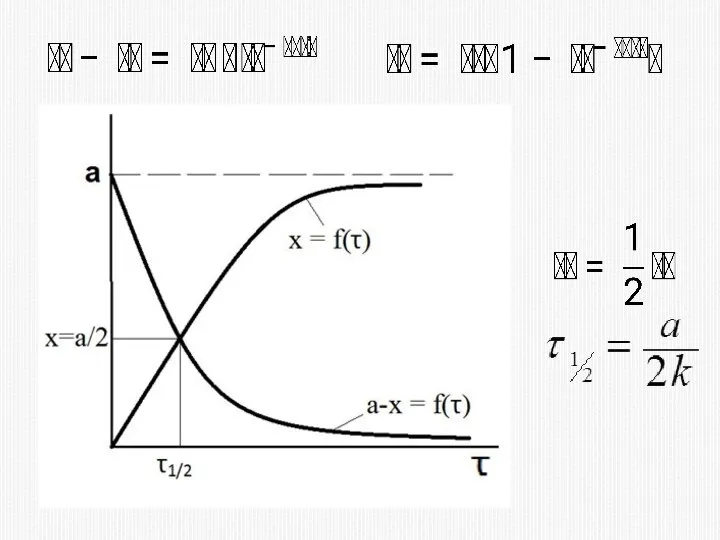
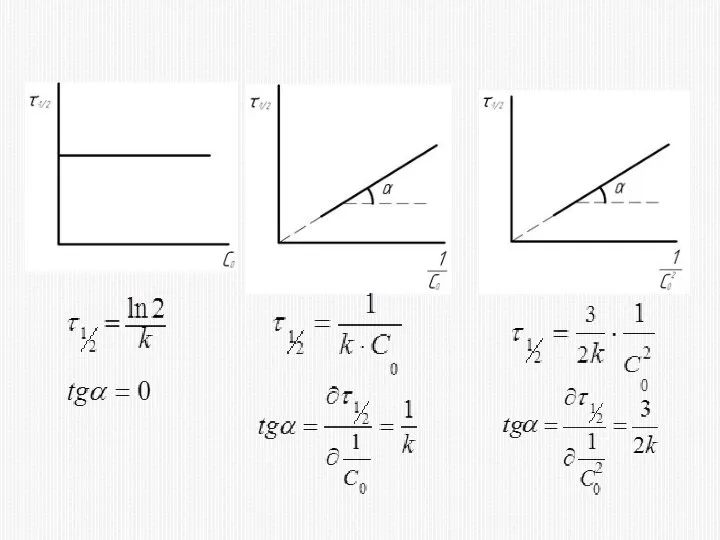
- 33. 2) МЕТОД ВРЕМЕНИ ПОЛУПРЕВРАЩЕНИЯ
- 39. 3) МЕТОД ОСТВАЛЬДА-НОЙЕСА
- 40. метод избытка или изоляции (графический метод Оствальда-Нойеса) метод Вант-Гоффа ДИФФЕРЕНЦИАЛЬНЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ
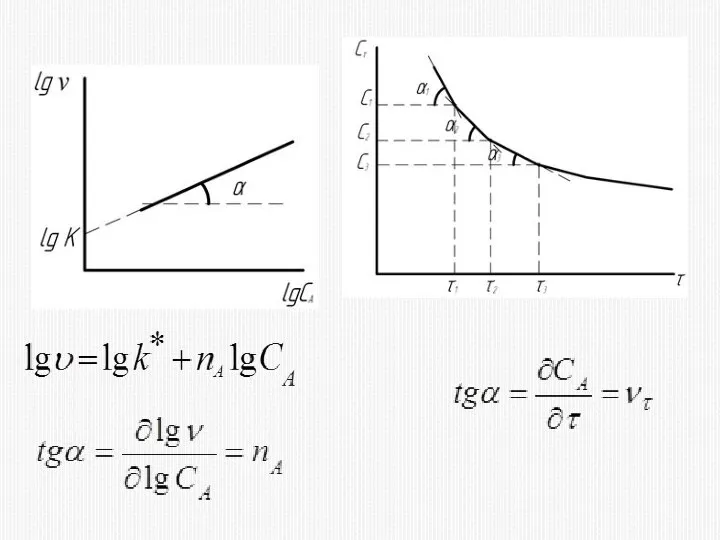
- 41. 1) МЕТОД ИЗБЫТКА (ИЗОЛЯЦИИ)
- 44. Скачать презентацию





















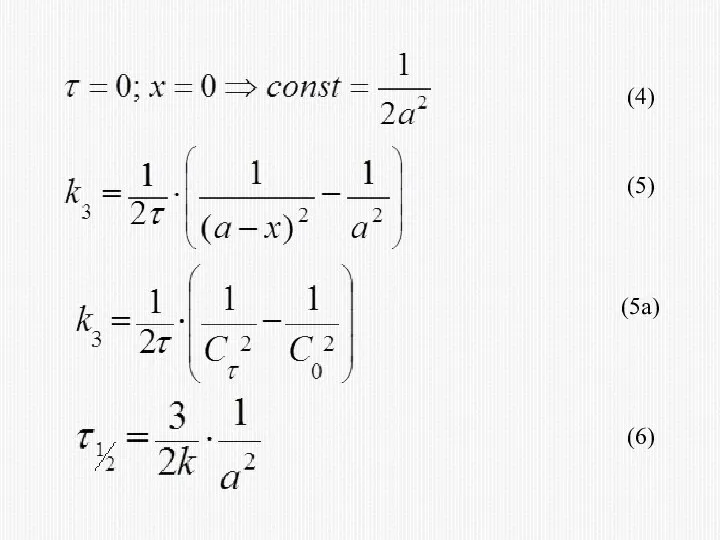










 Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП
Мельхіор, Нейзильбер, застосування і склад інших сплавів для приборів в ТВКП Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Автометаморфизм
Автометаморфизм 5 группа элементов
5 группа элементов Химия - тұрмыста
Химия - тұрмыста Витаминные препараты
Витаминные препараты Кремний. Получение кремния
Кремний. Получение кремния Химические свойства хрома
Химические свойства хрома Дисперсные системы: получение и свойства. Часть 2
Дисперсные системы: получение и свойства. Часть 2 Строение сплавов
Строение сплавов Кислородные соединения углерода
Кислородные соединения углерода Двовимірний ямр. Основні принципи
Двовимірний ямр. Основні принципи Белки. Определение
Белки. Определение Полимерные материалы
Полимерные материалы Гидролиз солей
Гидролиз солей Железо-углеродистые сплавы
Железо-углеродистые сплавы Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Презентация по Химии "Презентация Коррозия металлов" - скачать смотреть
Презентация по Химии "Презентация Коррозия металлов" - скачать смотреть  Спирты. Классификация спиртов
Спирты. Классификация спиртов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Презентация по Химии "Явления природы.Физические явления. Химические явления." - скачать смотреть
Презентация по Химии "Явления природы.Физические явления. Химические явления." - скачать смотреть  Арены
Арены Презентация на тему «Биография Д.И. Менделеева» Работа Ученицы 9 – «А» класса СОШ № 1 Давыдовой Полины Под руководством Конд
Презентация на тему «Биография Д.И. Менделеева» Работа Ученицы 9 – «А» класса СОШ № 1 Давыдовой Полины Под руководством Конд Аффинаж солей урана. Получение оксидов урана
Аффинаж солей урана. Получение оксидов урана Концепции химических процессов
Концепции химических процессов Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Оксиды. Оксид магния
Оксиды. Оксид магния Матеріалознавство. Будова твердих тіл та вплив на їх властивості
Матеріалознавство. Будова твердих тіл та вплив на їх властивості