ЗАГАЛЬНА ХАРАКТЕРИСТИКА НЕМЕТАЛІЧНИХ ЕЛЕМЕНТІВ. НЕМЕТАЛИ ЯК ПРОСТІ РЕЧОВИНИ. ЯВИЩЕ АЛОТРОПІЇ, АЛОТРОПНІ ВИДОЗМІНИ ОКСИГЕНУ І
Содержание
- 2. Атоми хімічних елементів сполучаються між собою, утворюючи всю різноманітність речовин, або хімічних сполук. Усі речовини вважаються
- 3. РЕЧОВИНИ Речовина— вид матерії, яка на відміну від поля, характеризується масою. Речовина складається з елементарних частинок
- 4. Речовини поділяють на прості й складні. Прості речовини – форма існування хімічних елементів у вільному стані.
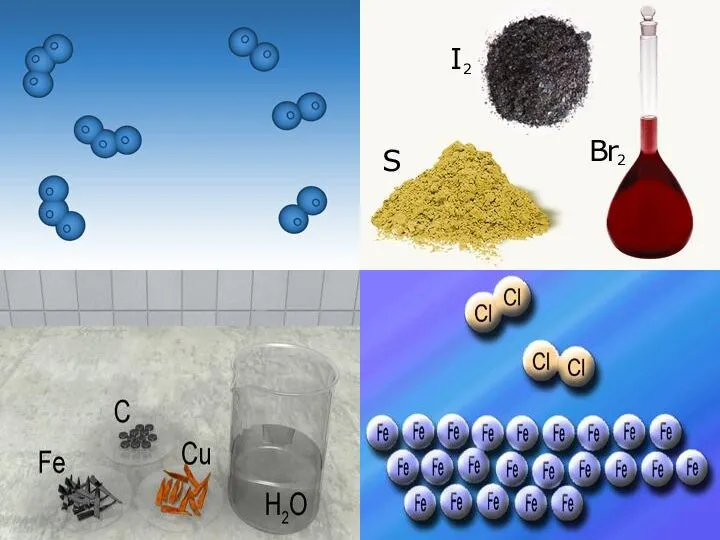
- 5. Переважна більшість елементів, які містяться у природних об’єктах, виділені у вигляді простих речовин, наприклад азот N2,
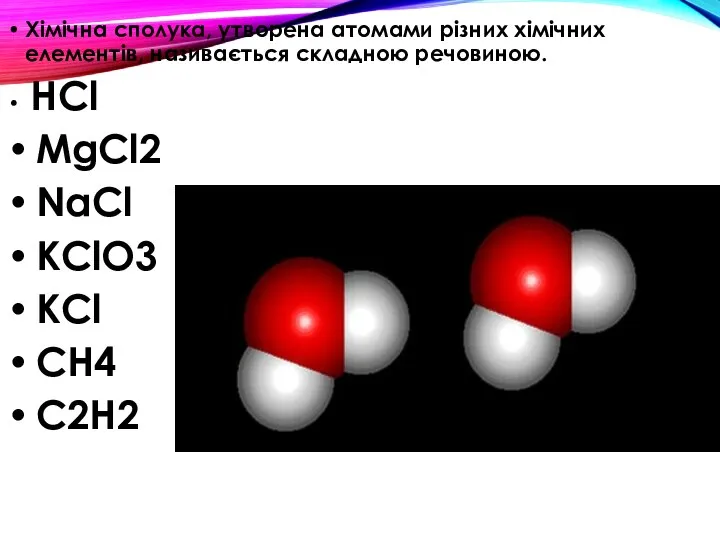
- 6. Хімічна сполука, утворена атомами різних хімічних елементів, називається складною речовиною. HCl MgCl2 NaCl KClO3 KCl CH4
- 7. Прості речовини поділяють на: метали (натрій Na, цинк Zn, барій Ва, магній Mg) неметали (сірка S,
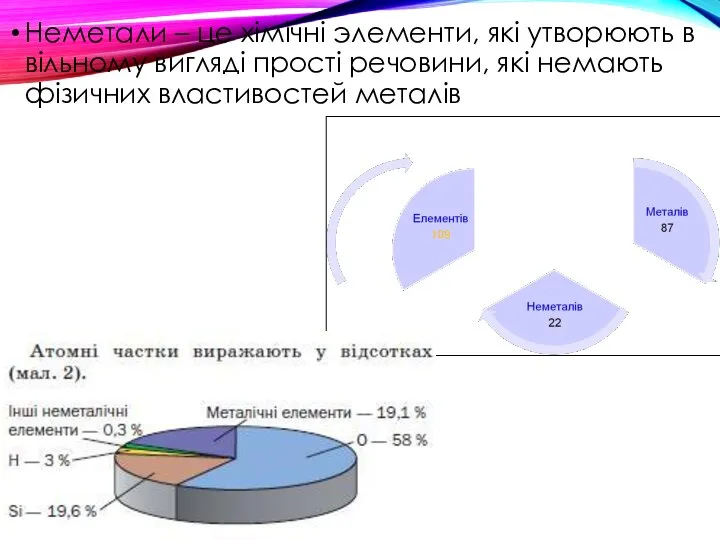
- 9. Неметали – це хімічні элементи, які утворюють в вільному вигляді прості речовини, які немають фізичних властивостей
- 10. НЕМЕТАЛИ Неметали – прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для
- 11. Неметали
- 12. Властивості неметалів Неметали можуть мати як молекулярну, так і немолекулярну структури. Вони погано проводять теплоту й
- 13. Сірка Фосфор Углерод
- 14. НЕМЕТАЛИ МАЮТЬ РІЗНИЙ АГРЕГАТНИЙ СТАН ЗА ЗВИЧАЙНИХ УМОВ:
- 15. Азот Сіліцій Бром гелій
- 17. ПОЛОЖЕННЯ НЕМЕТАЛІВ В ПС Неметали розташовані в основному в правому верхньому куті ПС, умовно обмеженому діагоналлю
- 19. ОСОБЛИВОСТІ БУДОВИ АТОМІВ НЕМЕТАЛІВ. Атоми неметалічних елементів на зовнішньому енергетичному рівні мають, як правило, від 4
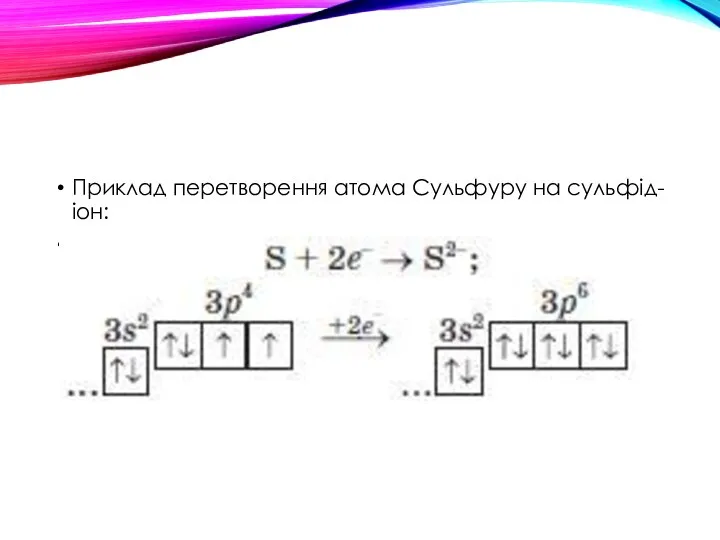
- 20. Приклад перетворення атома Сульфуру на сульфід-іон:
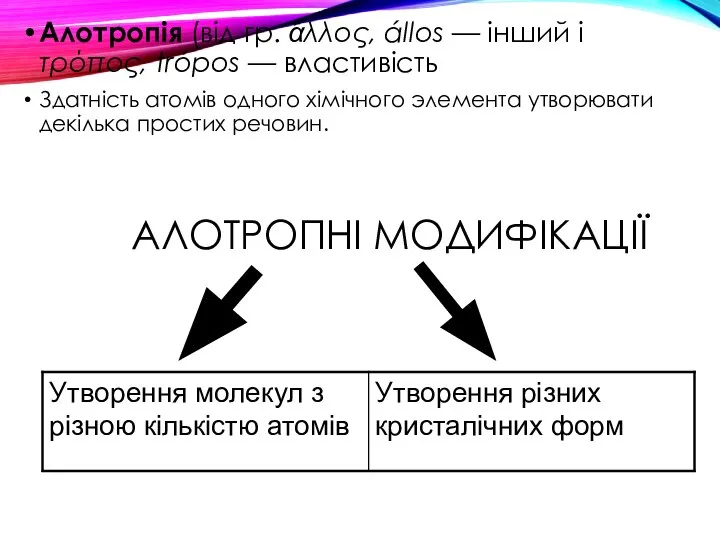
- 21. Елементи - неметали більш здатні, в порівнянні з металами, до Алотропії. Здатність атомів одного хімічного елемента
- 22. АЛОТРОПНІ МОДИФІКАЦІЇ Алотропія (від гр. ἄλλος, állos — інший і τρόπος, trópos — властивість Здатність атомів
- 23. Поширення в природі. Оксиген – найпоширеніший елемент у природі. Входить до складу води, багатьох мінералів і
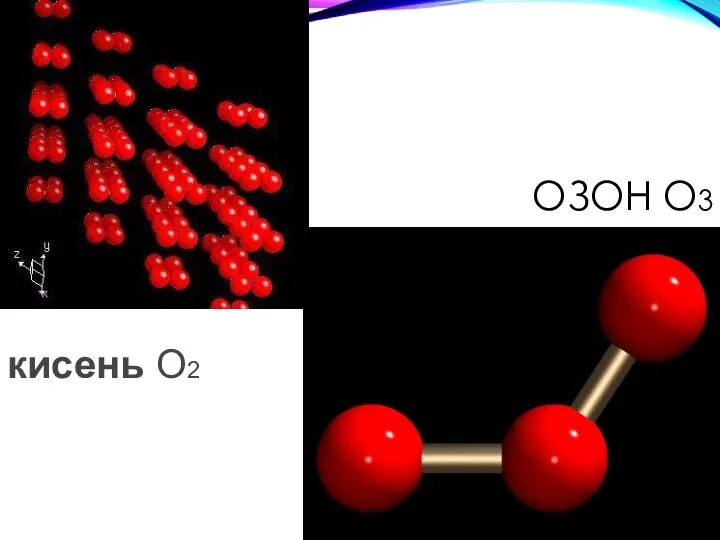
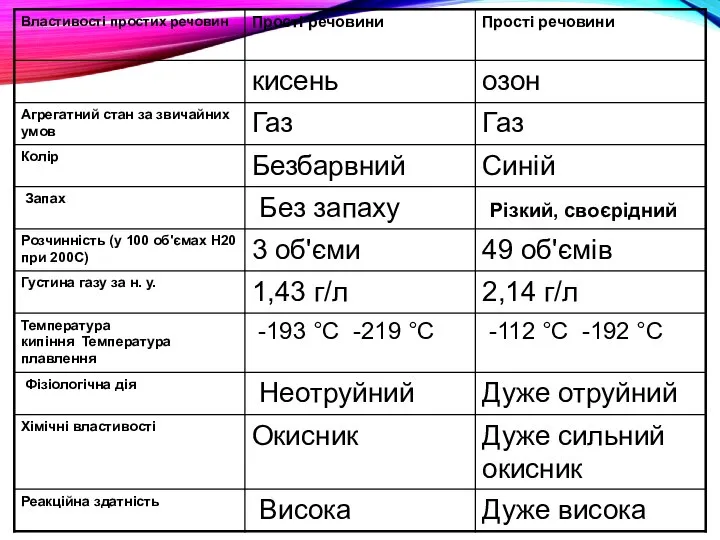
- 24. ОЗОН O3 кисень O2
- 26. Фізичні властивості. Озон – газ синього кольору із своєрідним різким запахом, розчинність у воді майже в
- 27. Озон можна добути в лабораторії
- 28. Поширення в природі Озон присутній в атмосфері Землі. Біля поверхні Землі озону мало. Його концентрація у
- 29. Над Україною (окрім південної частини) загальний вміст озону за останні 20 років зменшився на 6 %,
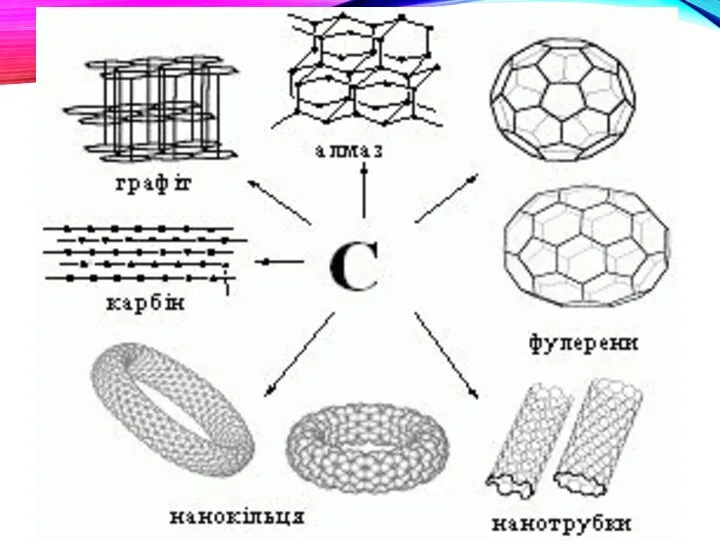
- 30. ВСЕ ЦЕ - ЧИСТИЙ КАРБОН
- 33. Дві основні різновиди вуглецю - графіт і алмаз - істотно відрізняються за властивостями. М'який графіт має
- 34. Структура алмазу типово тетраедріческая; атоми вуглецю міцно з'єднані за рахунок перекриття sp3-орбіталей.
- 35. ФІЗИЧНІ ВЛАСТИВОСТІ АЛМАЗУ І ГРАФІТУ. Алмаз Прозорий, безбарвний. Не проводить електричний струм, оскільки немає вільних електронів.
- 37. Скачать презентацию
























 Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Выдающиеся ученые - химики и их заслуги
Выдающиеся ученые - химики и их заслуги Альбітит-грейзенові родовища
Альбітит-грейзенові родовища Синтетические лекарственные средства
Синтетические лекарственные средства Презентация по химии на тему: «Применение кислорода»
Презентация по химии на тему: «Применение кислорода» Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Вчені - хіміки
Вчені - хіміки  Кинетика химических реакций. Основные понятия и законы химической кинетики
Кинетика химических реакций. Основные понятия и законы химической кинетики Роль женщин в химическом образовании и науке
Роль женщин в химическом образовании и науке Классификация титановых сплавов
Классификация титановых сплавов Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота
Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота Бета-окисление жирных кислот
Бета-окисление жирных кислот Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.
Органічні сполуки Жири, білки, вуглеводи, вітаміни як компоненти їжі, їх роль в організмі.  Электрохимические методы анализа
Электрохимические методы анализа Превращение веществ в одной среде
Превращение веществ в одной среде Атомы и молекулы
Атомы и молекулы Дослід Ознайомлення зі змістом етикеток харчових продуктів
Дослід Ознайомлення зі змістом етикеток харчових продуктів  Адсорбционные равновесия. Межмолекулярные взаимодействия при адсорбции
Адсорбционные равновесия. Межмолекулярные взаимодействия при адсорбции Арены. 10 класс
Арены. 10 класс Горение вещества и способы его прекращения
Горение вещества и способы его прекращения Противомикробное средство растительного происхождения, хлорофиллипт
Противомикробное средство растительного происхождения, хлорофиллипт Химические свойства оксидов
Химические свойства оксидов Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон
Выполнила: Ученица 11 «Б» класса Урывкова Анастасия Кон Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.
Металлы ГОУ СОШ № 661 УЧИТЕЛЬ ХИМИИ Ефремова С.А.  Явище ізомерії. Структурна ізомерія Близнюки органічного світу
Явище ізомерії. Структурна ізомерія Близнюки органічного світу  Типы изомерии
Типы изомерии Тест по теме Алкины
Тест по теме Алкины