Содержание
- 2. Botulinum toxin type A: исследование В Калифорнийском Университете доктором Herman Sommer выделена чистая форма ботулинического токсина
- 3. Botulinum toxin type A: исследование Американский микробиолог и токсиколог Dr. Edward J. Schantz в Висконсинском Университете
- 4. Botulinum toxin type A: исследование
- 5. Конвенция о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их
- 6. Botulinum toxin type A: исследование
- 7. История компании Medy-Tox inc.
- 8. История компании Меди-Токс Инк. 2000 – Основание компании Меди-Токс в Ю. Корее 2001 – Создание Института
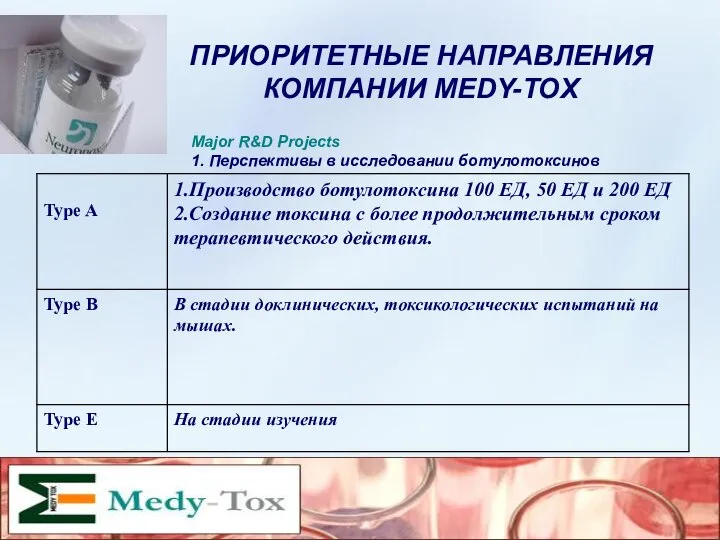
- 9. ПРИОРИТЕТНЫЕ НАПРАВЛЕНИЯ КОМПАНИИ MEDY-TOX Major R&D Projects 1. Перспективы в исследовании ботулотоксинов
- 10. Neuronox® в мире KSB: Korean Standards for Biologicals JP: Japanese Pharmacophoeia KP: Korean Pharmacophoeia
- 11. Различия между препаратами на основе ботулинического токсина типа А Технология изготовления определяет клинические свойства: Размер и
- 12. Биологические препараты не могут рассматриваться как «генерики» Различные составы препаратов, процессы производства и методы определения биологической
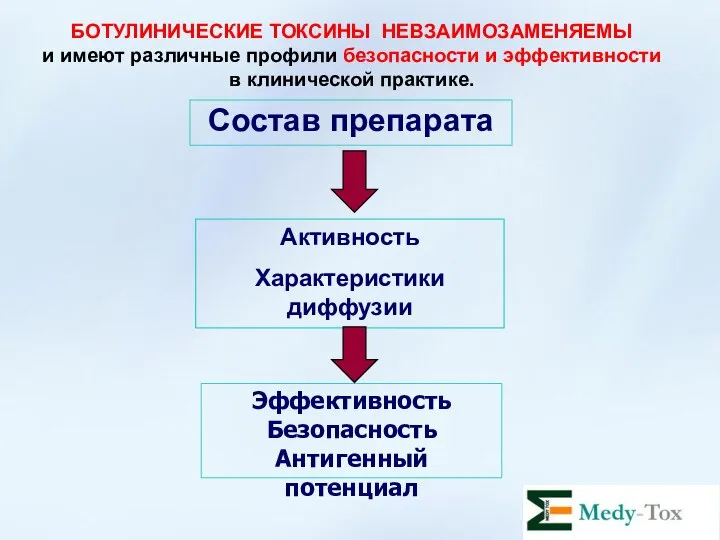
- 13. БОТУЛИНИЧЕСКИЕ ТОКСИНЫ НЕВЗАИМОЗАМЕНЯЕМЫ и имеют различные профили безопасности и эффективности в клинической практике. Состав препарата Активность
- 14. Botulinum Neurotoxins Clostridium botulinum производит семь отличных серотипов нейротоксина: A, B, C1, C2, D, E, F
- 15. Различные ботулотоксины типа А синтезируются различными штаммами бактерий Clostridium botulinum При производстве BTX-A (Allergan) - используется
- 16. Ботулинические токсины типа А Сейчас на рынке имеется пять препаратов: BOTOX®, (ALLERGAN Ltd) Dysport ®, (Ipsen
- 17. ПРОИЗВОДСТВО ПРЕПАРАТА NEURONOX® ШАГ ПЕРВЫЙ Небольшому количеству бактерий, штамм Hall, Clostridium botulinum тип A производится «прививка»
- 18. ПРОИЗВОДСТВО ПРЕПАРАТА NEURONOX® ШАГ ВТОРОЙ По мере размножения бактерий, параллельно происходит процесс их ферментации и аутолиза
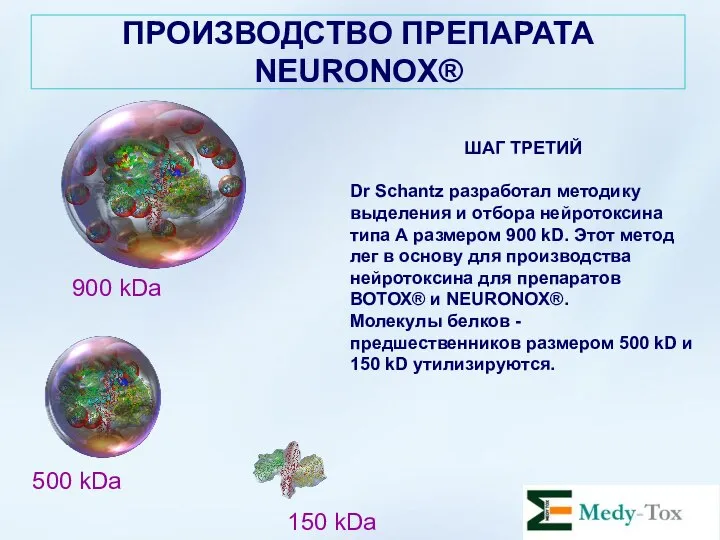
- 19. ПРОИЗВОДСТВО ПРЕПАРАТА NEURONOX® ШАГ ТРЕТИЙ Dr Schantz разработал методику выделения и отбора нейротоксина типа А размером
- 20. ПРОИЗВОДСТВО ПРЕПАРАТА NEURONOX® ШАГ ЧЕТВЕРТЫЙ Незначительное количество ботулотоксина типа А 900kD, которое синтезируется при производственном процессе,
- 21. ПРОИЗВОДСТВО ПРЕПАРАТА NEURONOX®
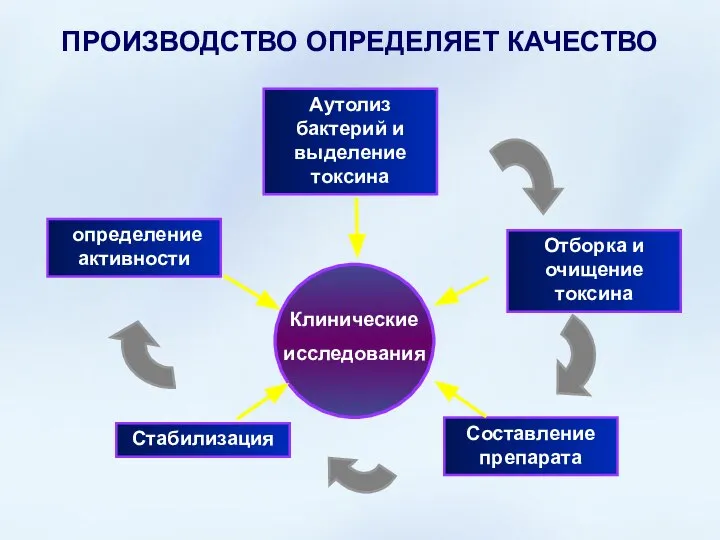
- 22. ПРОИЗВОДСТВО ОПРЕДЕЛЯЕТ КАЧЕСТВО Аутолиз бактерий и выделение токсина Клинические исследования Отборка и очищение токсина определение активности
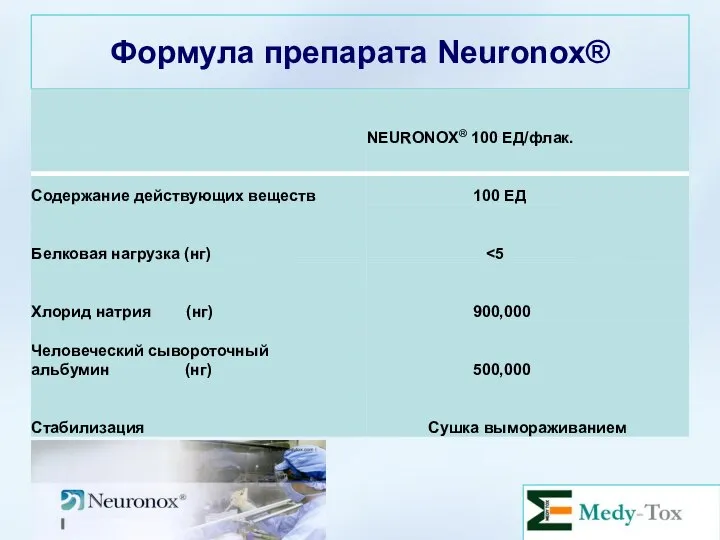
- 23. Формула препарата Neuronox®
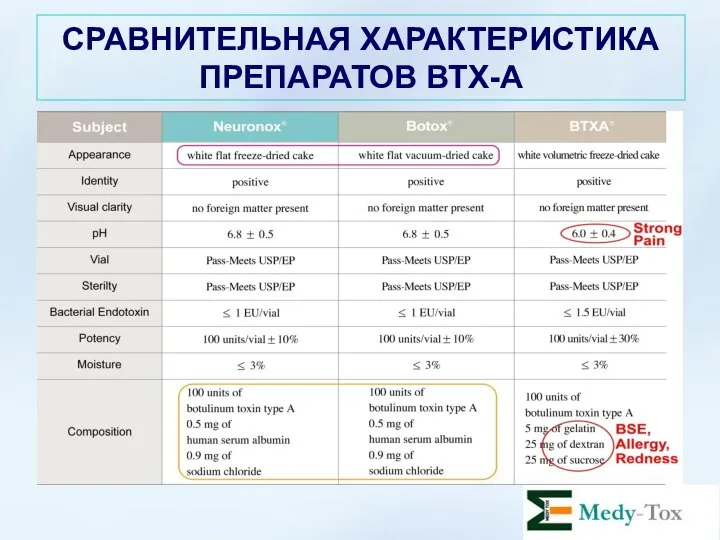
- 24. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПРЕПАРАТОВ ВТХ-А
- 25. Стабилизатор в некоторых вакцинах и других инъекционных препаратах Денатурированный коллаген, полученный из животного сырья Желатин производится
- 26. Желатин связан с АЛЛЕРГИЧЕСКИМИ реакциями Желатин в вакцинах считается ответственным за возникновение гиперчувствительных реакций, в т.ч.
- 27. УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВКИ ПРЕПАРАТА Neuronox® Срок годности 24 месяца с момента выпуска Неразведенный препарат -
- 28. Характеристики и преимущества Neuronox®
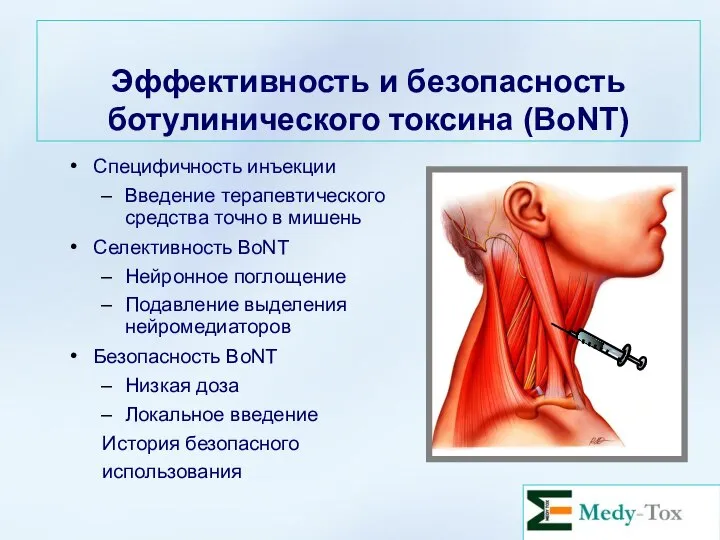
- 29. Эффективность и безопасность ботулинического токсина (BoNT) Специфичность инъекции Введение терапевтического средства точно в мишень Селективность BoNT
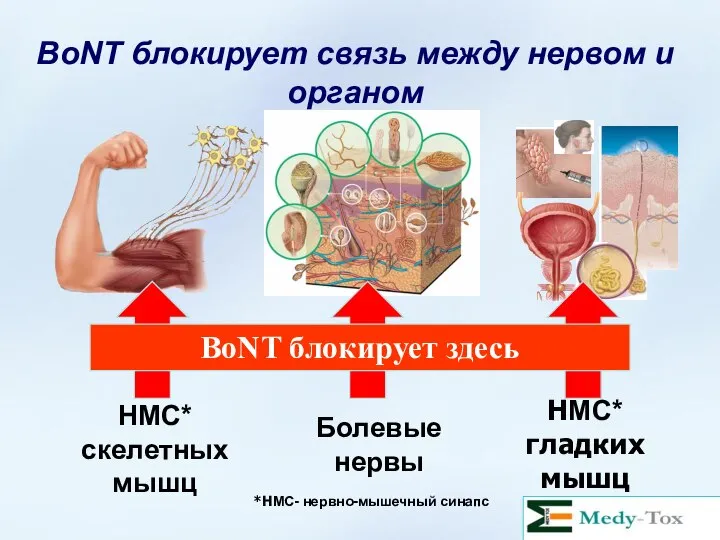
- 30. НМС* скелетных мышц Болевые нервы НМС* гладких мышц BoNT блокирует связь между нервом и органом BoNT
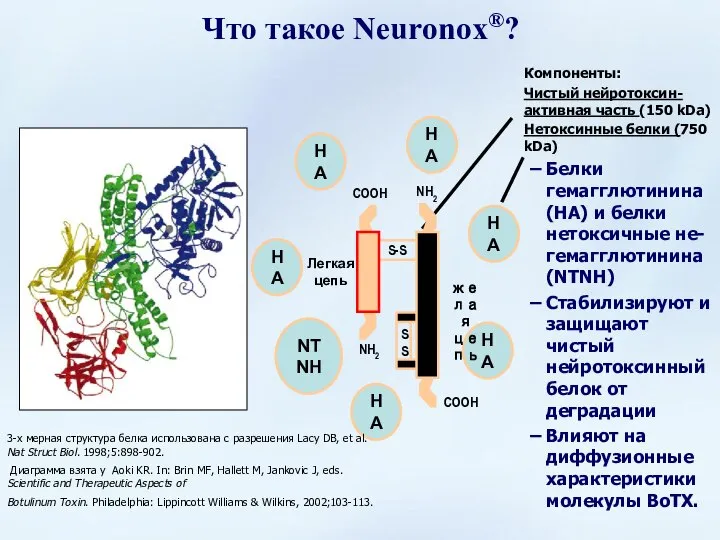
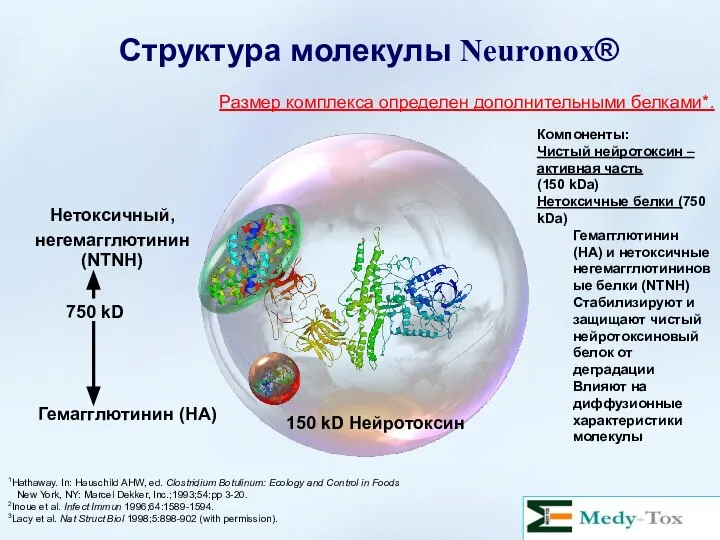
- 31. Компоненты: Чистый нейротоксин- активная часть (150 kDa) Нетоксинные белки (750 kDa) Белки гемагглютинина (HA) и белки
- 32. Структура молекулы Neuronox® 1Hathaway. In: Hauschild AHW, ed. Clostridium Botulinum: Ecology and Control in Foods New
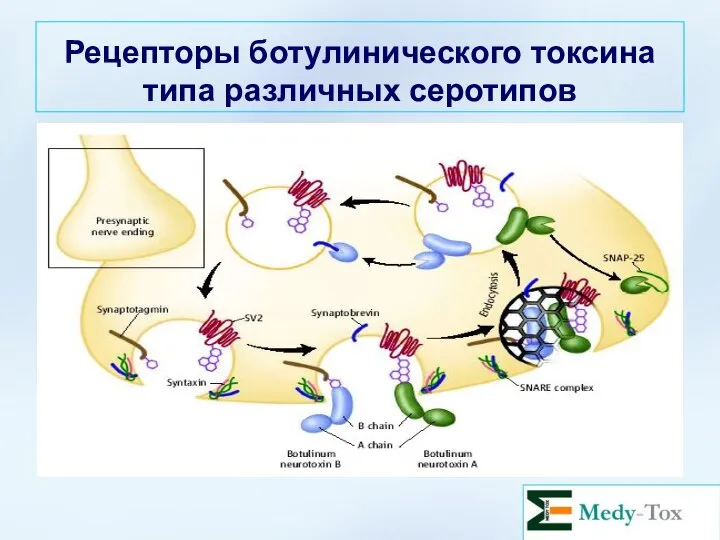
- 33. Рецепторы ботулинического токсина типа различных серотипов
- 34. Са+ Легкая цепь ботулотоксина конкурентно замещает ионы Са в домене транспортного комплекса * 30-60 минут ДОМЕН
- 35. Почему это важно? Недавние сообщения по рецепторам BoNT подтверждают нейронную селективность Как это скажется на клинической
- 36. ТЕРАПИЯ БОТУЛОТОКСИНАМИ ДОЗОЗАВИСИМАЯ! ЧЕМ ВЫША ДОЗА ВВОДИМОГО БОТУЛОТОКСИНА – ТЕМ ПРОДОЛЖИТЕЛЬНЕЙ ТЕРАПЕВТИЧЕСКИЙ ЭФФЕКТ!!! Почему это важно?
- 38. Сообщенные случаи клинического применения BoNT очень разнообразны и сфера его применения все расширяется Ахалазия Нервно-мышечные Автономные
- 39. Использование в медицине ботулотоксина типа А (нелицензированные показания) множественные дистонии дрожание гиперсаливация головные боли теннисный локоть
- 40. Разница в диффузии, разница в эффекте!
- 41. Вопросы диффузии Существует обратная корреляция между размером молекулы белка и скоростью диффузии в водной среде и
- 42. Структура ботулинических токсинов 150 kDa 500 kDa 900 kDa Крупная молекулярная структура BoNT приводит к минимальной
- 43. Размер и структура ВoNT влияют на степень диффузии Диапазон Диффузии Neuronox® BOTOX® ? Диапазон диффузии определяется
- 44. Закон диффузии Частицы большего молекулярного веса диффундируют через водную среду медленнее, чем более мелкие молекулы, если
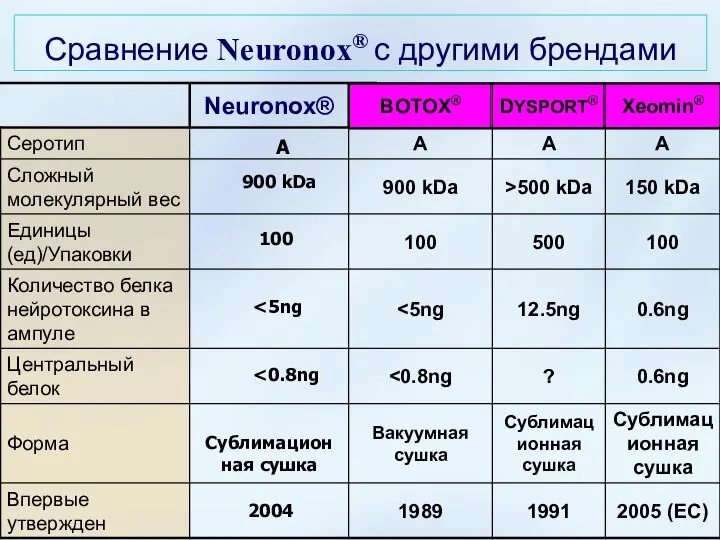
- 45. Сравнение Neuronox® с другими брендами A 900 kDa 100 Сублимационная сушка 2004
- 46. Какое клиническое значение имеет диффузия ботулинического токсина?
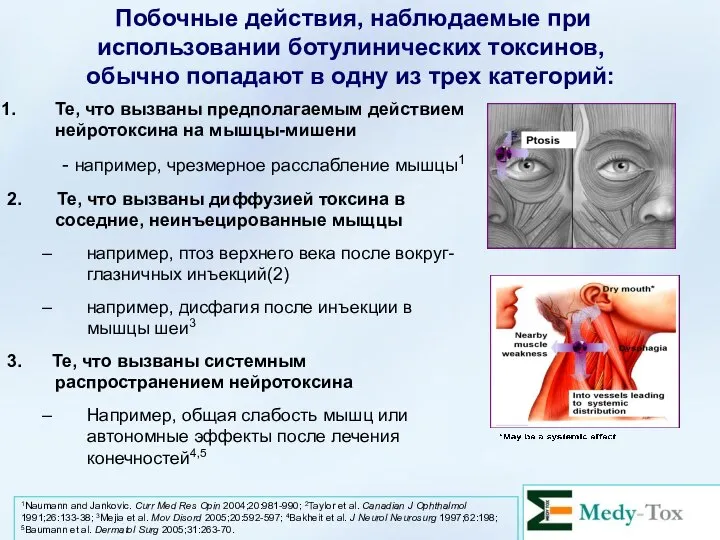
- 47. Те, что вызваны предполагаемым действием нейротоксина на мышцы-мишени - например, чрезмерное расслабление мышцы1 2. Те, что
- 48. Почему диффузия имеет большое значение? Желательна Необходима для максимального локального эффекта (неврологические показания, гипергидроз) Дойти до
- 49. Подведение итогов по безопасности и эффективности BoNT/A Из-за различий в производственных условиях и технологиях результаты применения
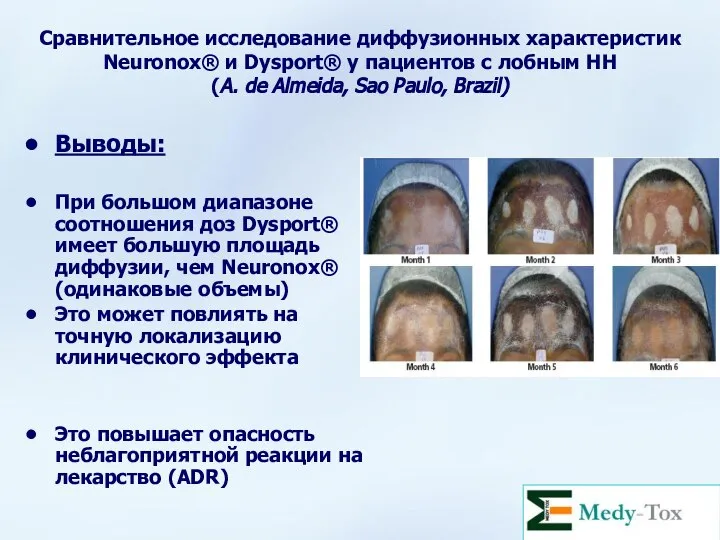
- 50. Сравнительное исследование диффузионных характеристик Neuronox® и Dysport® у пациентов с лобным HH (A. de Almeida, Sao
- 51. Neuronox® ☞ Подтвержденные данные по безопасности
- 52. Цифровая шкала расслабления мышцы (ЦШРМ) Когда мышь поднимают за хвост, ее лапки рефлекторно занимают характерное положение
- 53. Оценка эффективности Эффективность Цифровая шкала расслабления мышцы (ЦШРМ, 0-4) ВМ локальная эффективность (ЭД50) Эффект локальной мышечной
- 54. Определение Диапазон безопасности Локальный эффект в сравнении с системным эффектом ЛД50 / ЭД50 (Летальная
- 55. Диапазон безопасности Чем шире диапазон безопасности (в числовом выражении), тем большая разница между эффективной и токсической
- 56. Диапазон безопасности и диапазон диффузии: определения Диапазон безопасности Локальный эффект по сравнению с системным эффектом
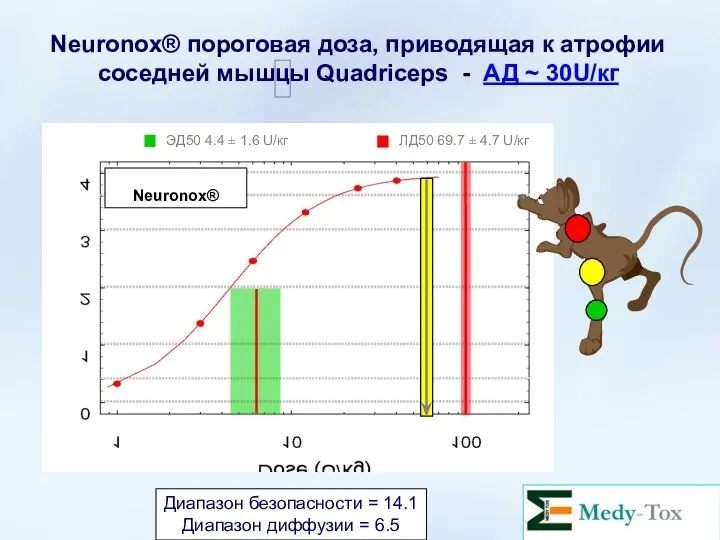
- 57. Neuronox® пороговая доза, приводящая к атрофии соседней мышцы Quadriceps - АД ~ 30U/кг Диапазон безопасности =
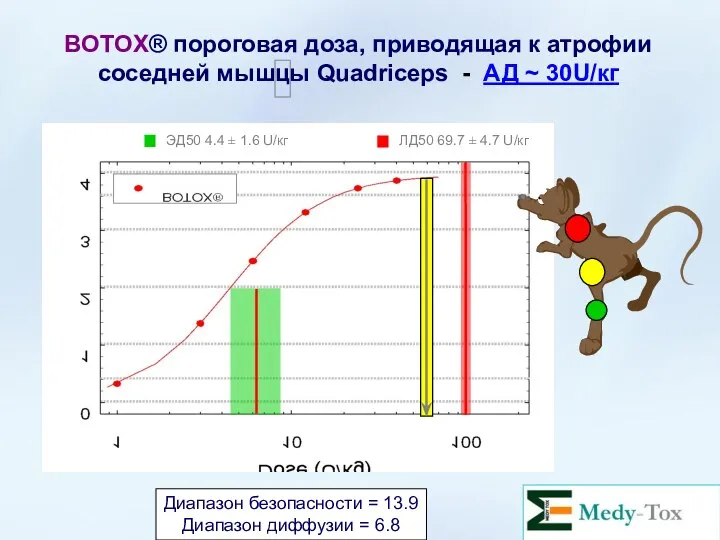
- 58. BOTOX® пороговая доза, приводящая к атрофии соседней мышцы Quadriceps - АД ~ 30U/кг Диапазон безопасности =
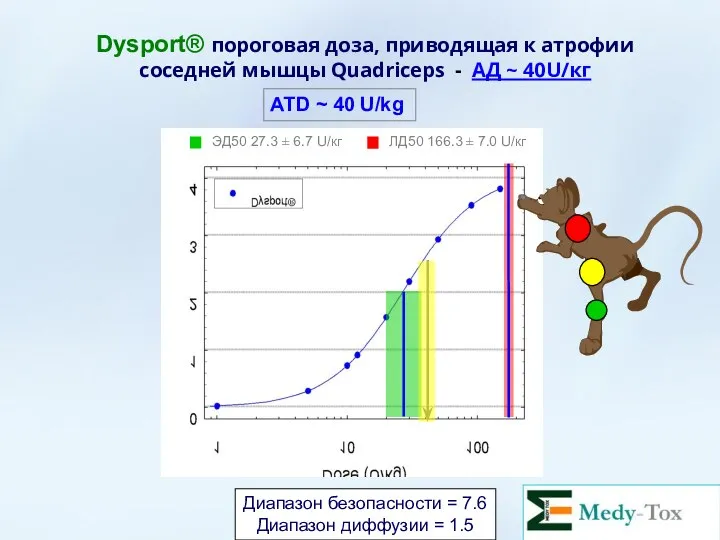
- 59. Dysport® пороговая доза, приводящая к атрофии соседней мышцы Quadriceps - АД ~ 40U/кг Диапазон безопасности =
- 60. Визуальное представление эффективности по сравнению с диффузией Локальная эффективность (ЦШРМ ЭД50) Диффузия в quadriceps мышцу, приводящая
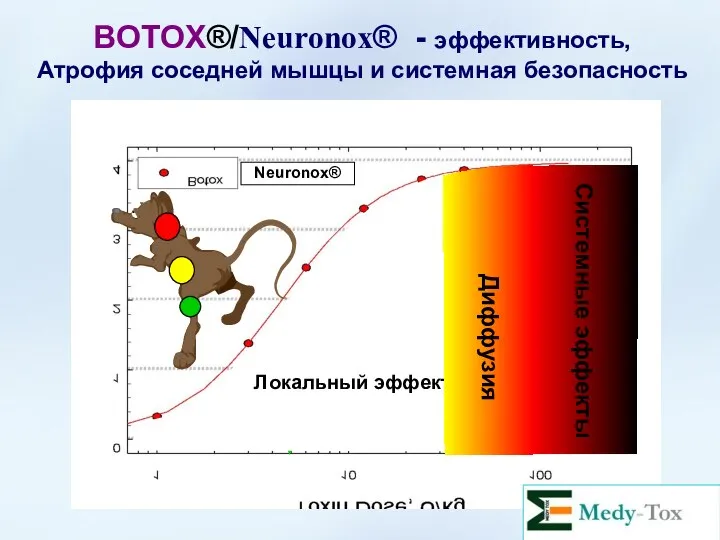
- 61. BOTOX®/Neuronox® - эффективность, Атрофия соседней мышцы и системная безопасность ED50 (4.4) LD50 (70) Diffusion (30) Neuronox®
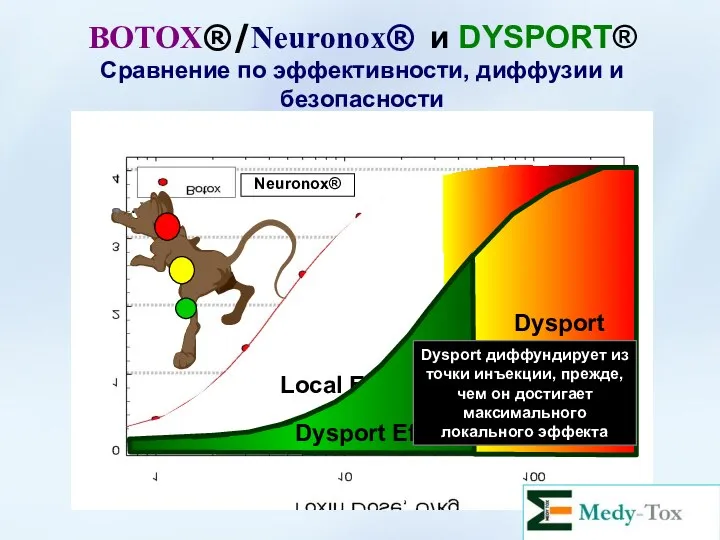
- 62. BOTOX®/Neuronox® и DYSPORT® Сравнение по эффективности, диффузии и безопасности ED50 (4.4) LD50 (70) Diffusion (30) Dysport
- 63. Прекрасная безопасность в клинической практике Первый опубликованный систематический анализ переносимости Neuronox® по всему спектру показаний к
- 64. КЛИНИЧЕСКИЕ ИСПЫТАНИЯ Наблюдения за изминениями в интенсивности спазма при клинических испытаниях Neuronox® (фаза III) у пациентов
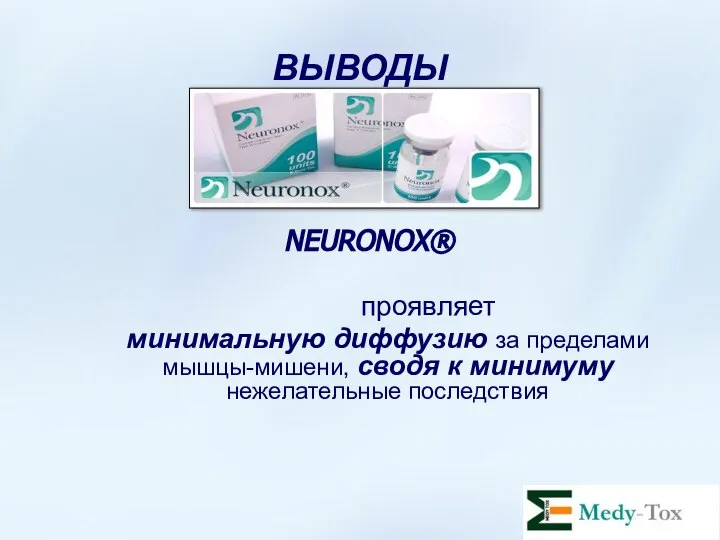
- 65. ВЫВОДЫ NEURONOX® проявляет минимальную диффузию за пределами мышцы-мишени, сводя к минимуму нежелательные последствия
- 66. ВЫВОДЫ поэтому NEURONOX® создают у ваших пациентов - естественный вид - заставляют ваших пациентов вернуться к
- 68. Скачать презентацию





































 Компания Amway
Компания Amway Маркетинговая стратегия
Маркетинговая стратегия Академия ИТС по продажам сервисов 1С:ИТС. Занятие №7. Этап выявление потребностей. Технология СРП
Академия ИТС по продажам сервисов 1С:ИТС. Занятие №7. Этап выявление потребностей. Технология СРП Магия чисел. Тренинг, привлекающий успех
Магия чисел. Тренинг, привлекающий успех Об Цифровое телевидение уфанет
Об Цифровое телевидение уфанет Стать супервайзером
Стать супервайзером HYDR8 это диетическая добавка для приготовления щелочной воды
HYDR8 это диетическая добавка для приготовления щелочной воды Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия. ООО ПРОММЕТЭКС
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия. ООО ПРОММЕТЭКС Genera fresh. Кубики в бачок Вlu
Genera fresh. Кубики в бачок Вlu Компания AZ Express
Компания AZ Express Как грамотно выбрать квартиру в Санкт-Петербурге и Ленинградской области на рынке первичного жилья в 2022 году
Как грамотно выбрать квартиру в Санкт-Петербурге и Ленинградской области на рынке первичного жилья в 2022 году производство сухих молочных смесей для питания детей.ОАО Беллакт
производство сухих молочных смесей для питания детей.ОАО Беллакт Исследование рынка предприятий быстрого питания г. Екатеринбурга
Исследование рынка предприятий быстрого питания г. Екатеринбурга Рейтинг лидеров будущего
Рейтинг лидеров будущего Сервис интернет такси У руля
Сервис интернет такси У руля ATLAS Your ideas change the world
ATLAS Your ideas change the world Скрипт входящего звонка. Скелет
Скрипт входящего звонка. Скелет What makes an advertising campaign successful
What makes an advertising campaign successful KRSunderwear - Магазин нижнего белья
KRSunderwear - Магазин нижнего белья Маркетинговые коммуникации
Маркетинговые коммуникации Маркетинговые концепции качества
Маркетинговые концепции качества Исследования ассортимента и качества аквариумных фильтров
Исследования ассортимента и качества аквариумных фильтров Реклама и маркетинг
Реклама и маркетинг Aqueen's Mission
Aqueen's Mission Радиостанция Radio Coffee
Радиостанция Radio Coffee Работа в группе ВКонтакте. Группа ЭВЕРЕСТ
Работа в группе ВКонтакте. Группа ЭВЕРЕСТ Туалетный столик
Туалетный столик Грязные деньги
Грязные деньги