Содержание
- 2. Антитела Антитела (АТ) - это γ-глобулины (Ig) (растворимые белки), которые присутствуют в сыворотке крови и других
- 3. Свойства АТ: Аффинность – сила специфического взаимодействия АТ с АГ. Зависит от комплементарности (степени сродства) антигенсвязывающего
- 4. Выделяют АТ: 1. а)Циркулирующие: сывороточные и секреторные (sIgA) б) Рецепторные (мономеры IgM, IgD) 2. а) специфические
- 5. Моноклональные АТ (АТ, полученные от одного клона лимфоцитов) В ответ на поступление АГ в организме активи-руется
- 6. Получение моноклональных антител
- 7. Антиглобулиновые антитела Ig, как белки, обладают антигенными свойствами и при попадании в чужеродный организм индуцируют выработку
- 8. Структура иммуноглобулинов Является белком с определенной биохимической структурой. Состоит из 2 пар: легких (L) и тяжелых
- 9. Легкие цепи бывают 2 типов: каппа (κ) и лямбда (λ). Тяжелые 5 типов: альфа (α), гамма
- 10. Структура иммуноглобулинов
- 11. Классы и типы иммуноглобулинов Выделяют 5 классов Ig: Иммуноглобулин класса G. 70-80% всех сывороточных Ig. Период
- 12. Иммуноглобулин класса М. 5-10% всех сывороточных белков. Период полураспада 5 дней. Пентамер, имеет 10 антигенсвязывающих центров.
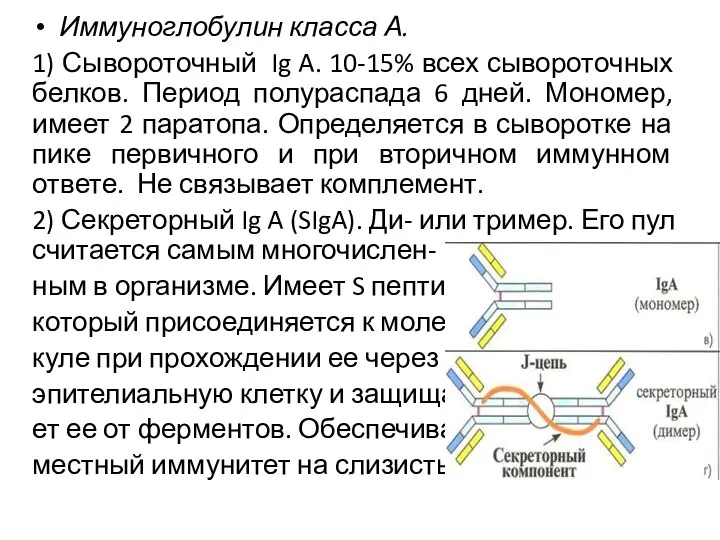
- 13. Иммуноглобулин класса А. 1) Сывороточный Ig A. 10-15% всех сывороточных белков. Период полураспада 6 дней. Мономер,
- 14. Иммуноглобулин класса Е. 0, 002% всех сывороточных иммуноглобулинов. Мономер. Не связывает комплемент. Fc фрагмент связывается с
- 15. Рецепторы антигенреактивных лейкоцитов В-клеточный рецептор (BCR) представлен иммуно-глобулинами чаще классов М и D (мономеры) (строение –
- 16. Рецептор В-лимфоцита (BCR)
- 17. Т-клеточный рецептор (TCR) Состоит из двух полипептидные цепей (αβ или γδ), состоящих из вариабельных (V) и
- 18. Рецепторы Т-лимфоцитов (TCR)
- 19. Fc-рецепторы (FcR) FcR- трансмембранная белковая молекула, специализированная к определенному изотипу тяжелой цепи молекулы АТ. Бывают высокоаффинные
- 20. Антителозависимые механизмы защиты Прямые эффекты: Нейтрализация. АТ связывается с активным центром биологически активной молекулы и тем
- 21. В большинстве случаев связывание АТ с АГ не приводит к разрушению АГ. Чаще АТ, связываясь с
- 22. Связывание с иммунным комплексом индуцирует у них выброс биологически активных веществ, разрушающих клетку: перекисные и NО-радикалы,
- 23. Генетический контроль иммунного ответа. В организме здорового человека в течение жизни образуется несколько миллионов вариантов антител
- 24. В отличие от генов других белков, гены Ig имеют фрагментарную структуру и разбросаны в хромосомах во
- 25. Гены Ig фрагментированы и образуют три группы, которые располагаются в трех различных хромосомах и наследуются независимо.
- 26. Тяжелая цепь (Н) кодируется генами из 4 участков: 1) V (вариабельный) имеет около 50 сегментов 2)
- 27. Гены легких цепей образованы сочетанием сегментов из 3 своих областей: V, J (вариабельный домен) и С.
- 28. Гены тяжелой цепи (Н)
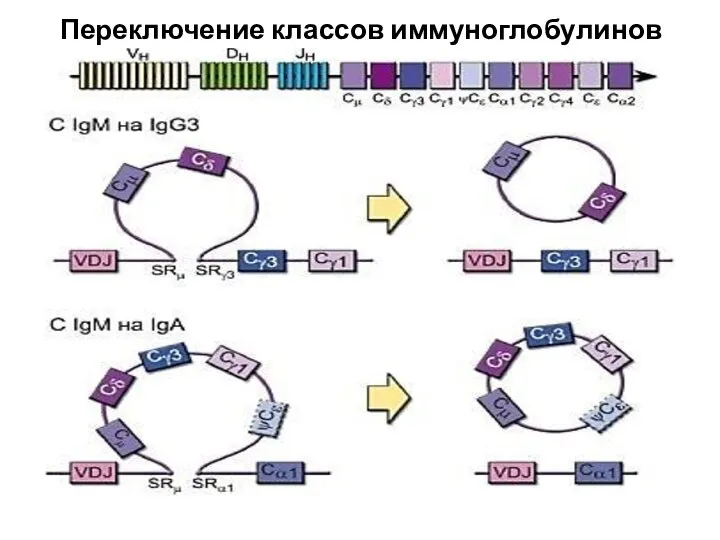
- 29. Переключение классов иммуноглобулинов Структурные гены константных частей Ig расположены в тех же хромосомах, что и VDJ
- 30. Переключение классов иммуноглобулинов
- 31. Гуморальный иммунитет. Основа – активация В-лимфоцитов и их дифференцировка в антителопродуцирующие плазматические клетки. АГ поступивший в
- 32. Также между двумя клетками образуются связи молекул CD28 – CD80/86 и др. Получив необходимую цитокиновую стимуляцию
- 33. Также между двумя клетками образуются связи молекул CD28 – CD80/86, CD40-CD40L и др. После этого, получив
- 34. Активация гуморального звена иммунитета.
- 35. Клеточный иммунитет. Основа – активация ЦТЛ, а также макрофагов и NК-клеток. При поступлении АГ в организм
- 36. Также эпитоп поглощенного АПК антигена выставляется на ее поверхности в комплексе с МНС I класса. ЦТЛ
- 38. Скачать презентацию

































 Физиология послеродового периода
Физиология послеродового периода Профилактика курения
Профилактика курения Профилактика употребления ПАВ в подростковой среде
Профилактика употребления ПАВ в подростковой среде Аноректальные пороки развития у детей
Аноректальные пороки развития у детей Инфекция. Бактериялар мен вирустардың патогендігі және вируленттігі
Инфекция. Бактериялар мен вирустардың патогендігі және вируленттігі Сымбат пиелонефрит
Сымбат пиелонефрит Аптека под ногами
Аптека под ногами Родительские послания: 10 фраз, которые определяют жизнь человека
Родительские послания: 10 фраз, которые определяют жизнь человека ЛФК при переломах
ЛФК при переломах Этиология и патогенез лихорадки
Этиология и патогенез лихорадки Общая патология, как отрасль медицины
Общая патология, как отрасль медицины Лимфатическая система. Кровь. Тема 21. ч1
Лимфатическая система. Кровь. Тема 21. ч1 Болезни желудочно-кишечного тракта
Болезни желудочно-кишечного тракта Скелет головы
Скелет головы Пероральные сахароснижающие ЛС
Пероральные сахароснижающие ЛС Измерение артериального давления
Измерение артериального давления Дифференциальная диагностика при гепатомегалии
Дифференциальная диагностика при гепатомегалии Взаимосвязь толерантности и агрессивности
Взаимосвязь толерантности и агрессивности Клінічні прояви психічних захворювань і їх судово-психіатрична оцінка. Тема 3
Клінічні прояви психічних захворювань і їх судово-психіатрична оцінка. Тема 3 Авторская психотерапевтическая программа «дизайн человека совершенного»
Авторская психотерапевтическая программа «дизайн человека совершенного» Препараты гормонов и их синтетические аналоги
Препараты гормонов и их синтетические аналоги Терапия. Задача. Диагноз: ХОБЛ, GOLD II, mMRC-2, степень риска В, вне обострения
Терапия. Задача. Диагноз: ХОБЛ, GOLD II, mMRC-2, степень риска В, вне обострения Психологическая уравновешенность. Стресс и его влияние на человека
Психологическая уравновешенность. Стресс и его влияние на человека Оттискные материалы
Оттискные материалы Хронічна серцева недостатність. Визначення. Класифікація. Клініка. Діаганостика. Лікування
Хронічна серцева недостатність. Визначення. Класифікація. Клініка. Діаганостика. Лікування Функциональная биохимия нервной ткани
Функциональная биохимия нервной ткани ВИЧ-инфекция. Термины, открытие, устойчивость вируса
ВИЧ-инфекция. Термины, открытие, устойчивость вируса Рациональное вскармливание детей первого года жизни
Рациональное вскармливание детей первого года жизни