Содержание
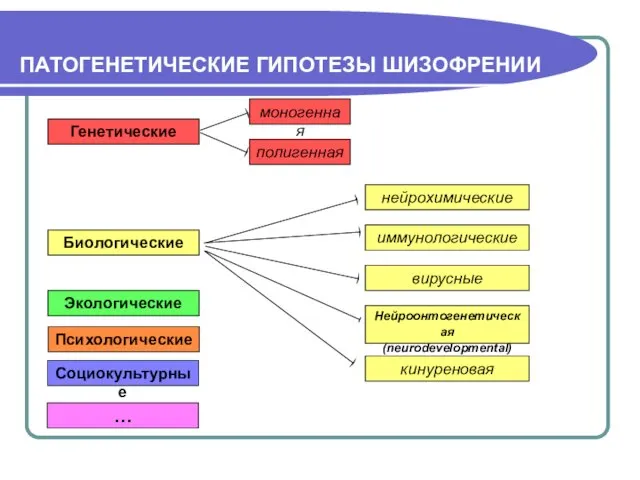
- 2. ПАТОГЕНЕТИЧЕСКИЕ ГИПОТЕЗЫ ШИЗОФРЕНИИ Генетические моногенная полигенная иммунологические нейрохимические Нейроонтогенетическая (neurodevelopmental) Биологические кинуреновая Психологические Социокультурные … Экологические
- 3. РОЛЬ НАСЛЕДСТВЕННЫХ ФАКТОРОВ В РАЗВИТИИ ШИЗОФРЕНИИ (Шахматова-Павлова, 1972, Москаленко 1980, Гиндилис, Вартанян 1982, Gershon et al.,
- 4. РОЛЬ СРЕДОВЫХ ФАКТОРОВ В РАЗВИТИИ ШИЗОФРЕНИИ Коэффициент наследуемости (вклад генетических факторов) – 80%. Современные генетические представления:
- 5. МОНОГЕННАЯ ГИПОТЕЗА (Т.J. Crow, 90-е годы ХХ века - Am. J Psychiatry, 2007) Аргументы «за»: частота
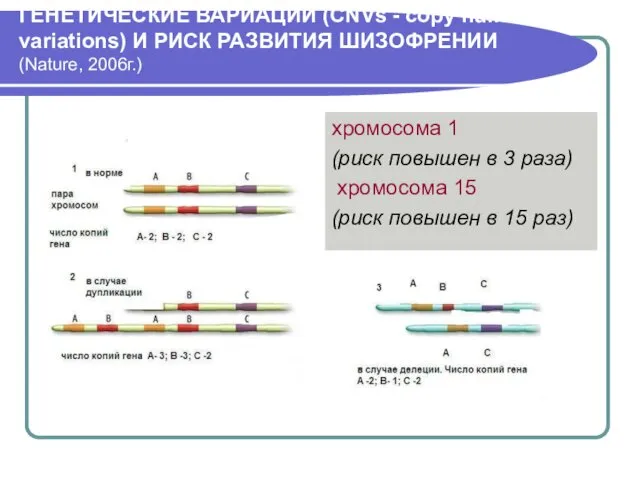
- 6. ГЕНЕТИЧЕСКИЕ ВАРИАЦИИ (CNVs - copy number variations) И РИСК РАЗВИТИЯ ШИЗОФРЕНИИ (Nature, 2006г.) хромосома 1 (риск
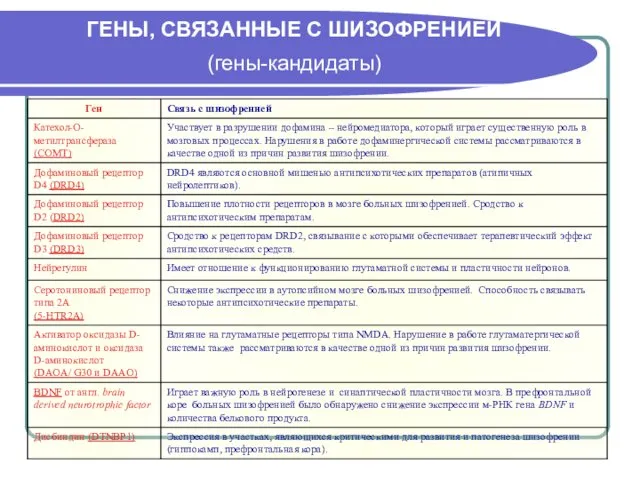
- 7. ГЕНЫ, СВЯЗАННЫЕ С ШИЗОФРЕНИЕЙ (гены-кандидаты)
- 8. ГЕНЕТИЧЕСКИЕ ГИПОТЕЗЫ ШИЗОФРЕНИИ Болезнь – результат структурных изменений генома на различных уровнях: нуклеотидные замены в генах,
- 9. ГЕНЕТИЧЕСКИЕ ГИПОТЕЗЫ ШИЗОФРЕНИИ В настоящее время невозможно с определенностью утверждать, что какая-либо модификация гена увеличивает риск
- 10. ВИРУСНАЯ ГИПОТЕЗА РАЗВИТИЯ ШИЗОФРЕНИИ (Fuller Torrey, 80-е годы ХХ века) Болезнь – следствие вирусного заражения во
- 11. СВОЙСТВА ВИРУСОВ, ВАЖНЫЕ С ТОЧКИ ЗРЕНИЯ ВИРУСНЫХ ТЕОРИЙ ШИЗОФРЕНИИ Способность поражать узко ограниченные участки мозга. Способность
- 12. ВИРУСНЫЕ ГИПОТЕЗЫ ШИЗОФРЕНИИ Аргументы «ЗА»: У матерей, перенесших грипп в течение первых трех месяцев беременности, большая
- 13. ФАКТОРЫ РИСКА ОКРУЖАЮЩЕЙ СРЕДЫ БИОЛОГИЧЕСКИЕ Инфекционные заболевания у матери в период беременности Осложнения беременности и родов
- 14. НЕЙРООНТОГЕНЕТИЧЕСКАЯ ГИПОТЕЗА ШИЗОФРЕНИИ, ОСНОВЫВАЮЩАЯСЯ НА ДЕФЕКТАХ РАЗВИТИЯ НЕРВНОЙ СИСТЕМЫ (neurodevelopmental hypothesis) (Weinberger D.R., 80-е годы ХХ
- 15. НЕЙРООНТОГЕНЕТИЧЕСКАЯ ГИПОТЕЗА ШИЗОФРЕНИИ Аргументы «за»: 1. МРТ-исследования + постмортальные исследования: - сокращение объема мозга - сокращение
- 16. НЕЙРООНТОГЕНЕТИЧЕСКАЯ ГИПОТЕЗА ШИЗОФРЕНИИ (продолжение) Аргументы «за»: 5. Измененная активность ряда маркеров развития мозга (NCAM- молекула нейрональной
- 17. ОБОБЩЕННАЯ МОДЕЛЬ РАЗВИТИЯ ШИЗОФРЕНИИ (в соответствии с нейроонтогенетической гипотезой) Этиология: совокупность различных экзогенных и эндогенных факторов
- 18. ТАКИМ ОБРАЗОМ: Одним из основных патофизиологических механизмов развития шизофрении и расстройств шизофренического спектра, возможно, является структурно-функциональная
- 19. ПЕРВАЯ ФОРМУЛИРОВКА DA-ГИПОТЕЗЫ ШИЗОФРЕНИИ (Carlsson and Lindqvist, 1963) Болезнь – результат гиперактивной DA-трансмиссии Основание: активация психостимуляторами
- 20. ОСНОВНЫЕ ДОФАМИНЕРГИЧЕСКИЕ ПУТИ ГОЛОВНОГО МОЗГА
- 21. СОВРЕМЕННАЯ DA-ГИПОТЕЗА (Knable and Weinberger, 1997; Goldman-Rakic et al., 2000) Шизофрения – результат дисбаланса DA-системы в
- 22. ДОФАМИНО-СЕРОТОНИНОВАЯ ГИПОТЕЗА ШИЗОФРЕНИИ В формирование DA-дисбаланса вовлечена серотониновая система ОСНОВАНИЕ: Антипсихотический эффект атипичных нейролептиков связан не
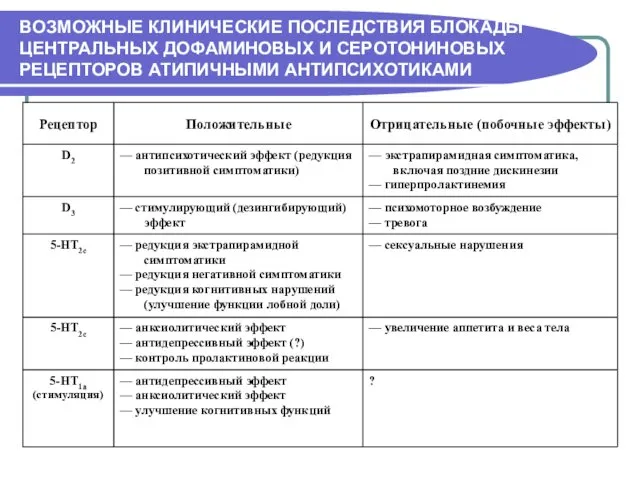
- 23. ВОЗМОЖНЫЕ КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ БЛОКАДЫ ЦЕНТРАЛЬНЫХ ДОФАМИНОВЫХ И СЕРОТОНИНОВЫХ РЕЦЕПТОРОВ АТИПИЧНЫМИ АНТИПСИХОТИКАМИ
- 24. ГЛУТАМАТНАЯ ГИПОТЕЗА ШИЗОФРЕНИИ (J.Kim, 1980, C. Tamminga., J.Crystal., 2000г. ) Болезнь – результат снижения активности ГЛУ-зависимого
- 25. СОВРЕМЕННАЯ ТРАКТОВКА глу-ГИПОТЕЗЫ ШИЗОФРЕНИИ (Г. Бурбаева, И. Бокша, V. Haroutunyan, C. Tamminga, C. Beasley, S. Tsai
- 26. СЕРОТОНИН-ГЛУТАМАТНАЯ ГИПОТЕЗА ШИЗОФРЕНИИ В формирование нарушений глутаматной системы вовлечена серотониновая система (формирование серотонин-глутаматных рецепторных комплексов в
- 27. АУТОИММУННАЯ ГИПОТЕЗА ШИЗОФРЕНИИ (Вартанян М.Е., Коляскина Г.И., Семенов С.Ф. Yancovich J., 60-70е годы ХХ века) Циркулирующие
- 28. данные литературы (2003-2009гг) АКТИВАЦИЯ ВРОЖДЕННОГО ИММУНИТЕТА ПРИ ШИЗОФРЕНИИ (Воспалительные реакции при шизофрении) Увеличение концентрации провоспалительных цитокинов
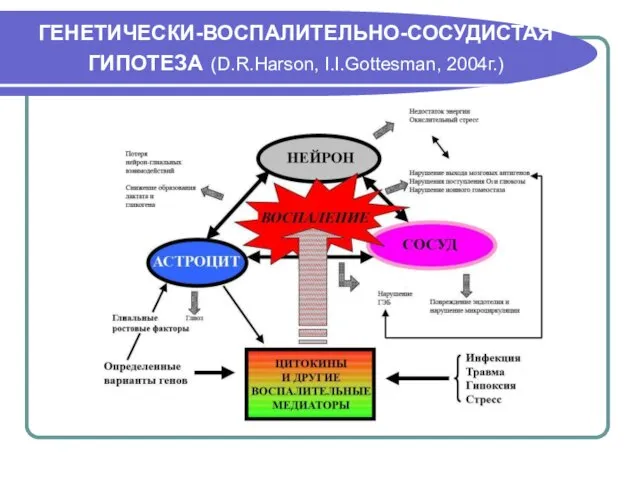
- 29. ГЕНЕТИЧЕСКИ-ВОСПАЛИТЕЛЬНО-СОСУДИСТАЯ ГИПОТЕЗА (D.R.Harson, I.I.Gottesman, 2004г.)
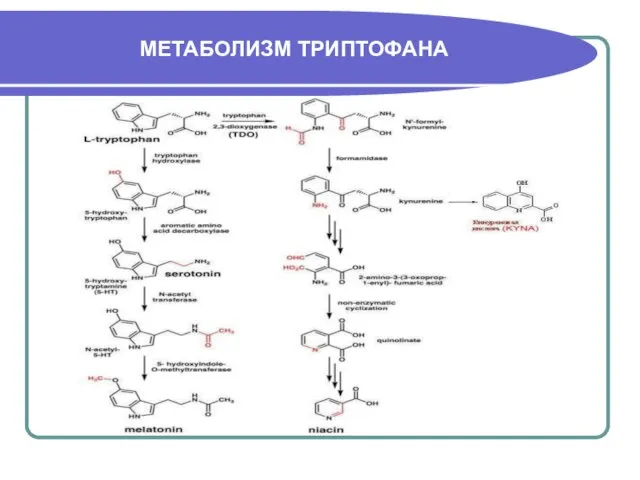
- 30. МЕТАБОЛИЗМ ТРИПТОФАНА
- 31. ПСИХОТРОПНЫЕ СВОЙСТВА КИНУРЕНОВОЙ КИСЛОТЫ (KYNA) KYNA: Единственный эндогенный антагонист NMDA-рецепторов (вызывает гипофункцию глу-системы и реципрокно активирует
- 32. КИНУРЕНОВАЯ ГИПОТЕЗА ШИЗОФРЕНИИ Erhardt S., Schwieler L., Nilsson L., Lindholm K., Engberg G. (2004г) Болезнь –
- 33. ЗАКЛЮЧЕНИЕ (биологические гипотезы): При шизофрении наблюдаются нарушения иммунной системы, различных нейромедиаторных систем (DA, 5HT,Glu), метаболизма триптофана.
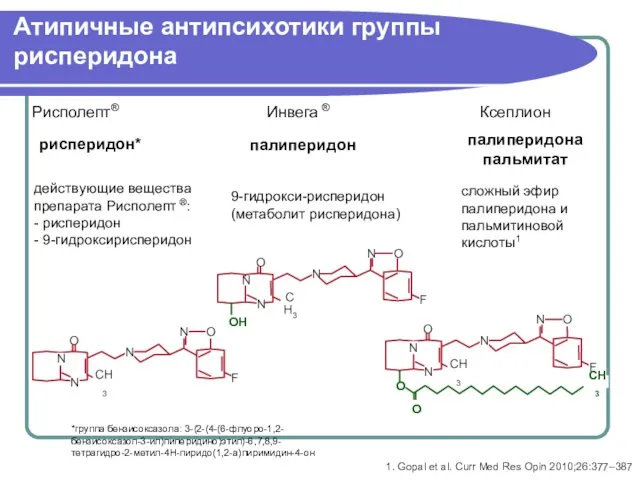
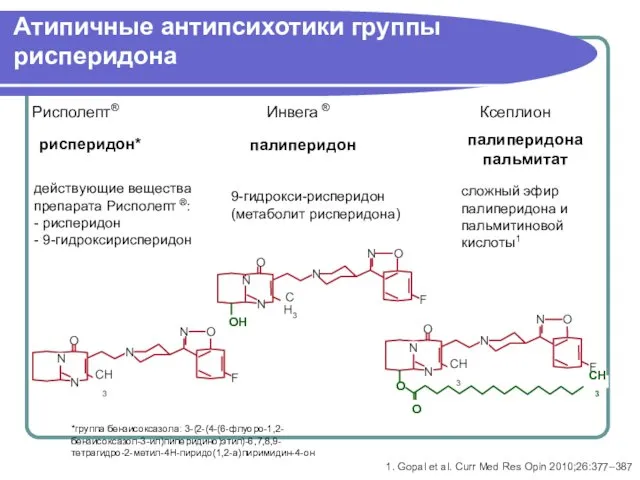
- 34. Атипичные антипсихотики группы рисперидона рисперидон* палиперидон палиперидона пальмитат 9-гидрокси-рисперидон (метаболит рисперидона) сложный эфир палиперидона и пальмитиновой
- 35. Инвега Антипсихотический препарат для лечения шизофрении Целенаправленно объединяет: Мощный антипсихотический эффект с низкой вероятностью лекарственных взаимодействий
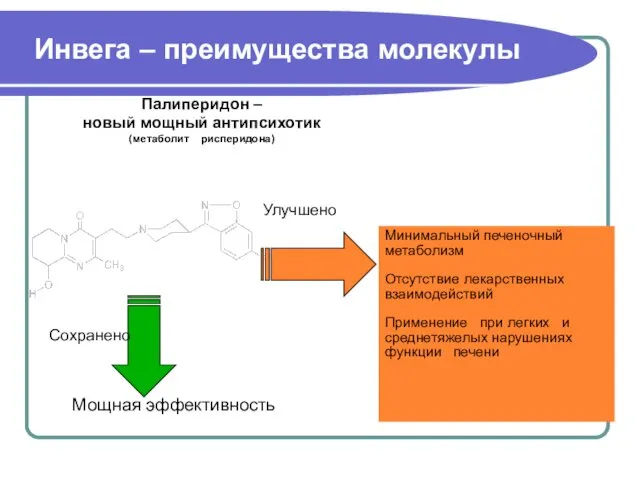
- 36. Инвега – преимущества молекулы Сохранено Мощная эффективность Улучшено Минимальный печеночный метаболизм Отсутствие лекарственных взаимодействий Применение при
- 37. Палиперидон Высокая аффинность к D2-, 5HT2A-, α1 and α2 адренергическим рецепторам1 Выделяется преимущественно почками 59% выделяется
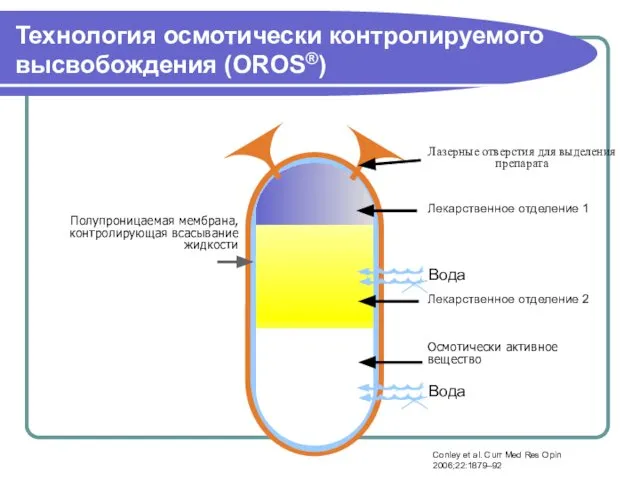
- 38. Технология осмотически контролируемого высвобождения (OROS®) Лазерные отверстия для выделения препарата Лекарственное отделение 2 Лекарственное отделение 1
- 39. Палиперидон: система доставки OROS® Обеспечивает контролируемое высвобождение палиперидона на протяжении 24 часов1 Минимальные колебания концентрации в
- 40. 3 мг n=127 Частота экстрапирамидных симптомов: объединенные данные 6-недельных исследований плацебо 6 мг 9 мг 12
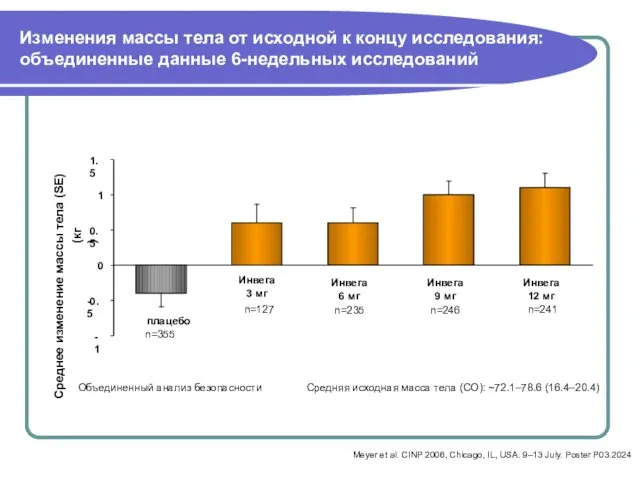
- 41. Изменения массы тела от исходной к концу исследования: объединенные данные 6-недельных исследований Объединенный анализ безопасности плацебо
- 42. Переносимость и безопасность: пролактин Срединное повышение сывороточного пролактина отмечалось у 67% пациентов1 Побочные эффекты, потенциально связанные
- 43. Режим дозирования Инвега продемонстрировала достоверное улучшение общего балла PANSS в дозе 6 мг1 3 мг: Более
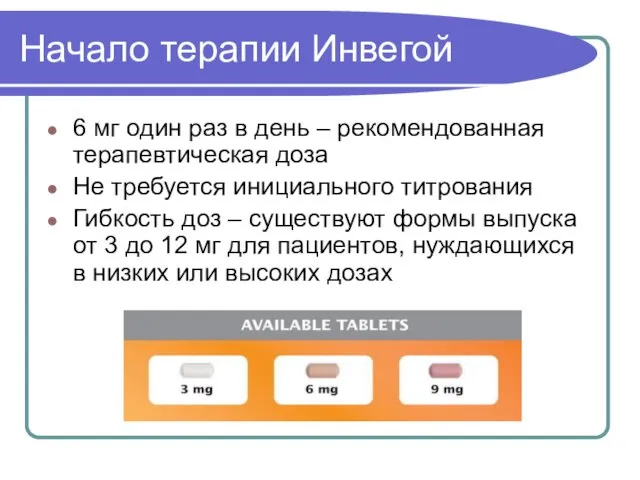
- 44. Начало терапии Инвегой 6 мг один раз в день – рекомендованная терапевтическая доза Не требуется инициального
- 45. Заключение Инвега разработана целенаправленно с целью объединения эффективности антипсихотика с осмотической системой доставки в течение 24
- 46. Инструкция по применению Инвега – таблетки пролонгированного действия Активное вещество: 3 мг, 6 мг или 9
- 47. Предупреждения: С осторожностью назначать пациентам с сердечно-сосудистыми заболеваниями или с семейным анамнезом удлинения интервала QT. С
- 48. КСЕПЛИОН новый препарат для лечения шизофрении
- 49. Атипичные антипсихотики группы рисперидона рисперидон* палиперидон палиперидона пальмитат 9-гидрокси-рисперидон (метаболит рисперидона) сложный эфир палиперидона и пальмитиновой
- 50. Показания к применению КСЕПЛИОН показан для лечения шизофрении и профилактики рецидивов шизофрении. На КСЕПЛИОН удобно переводить
- 51. Обзор препарата КСЕПЛИОН Молекула Действующее вещество: палиперидон Химико-физическая структура: пальмитат (сложный эфир пальмитиновой кислоты) палиперидона. Форма:
- 52. Обзор препарата КСЕПЛИОН Фармакокинетика и фармакодинамика Максимальная концентрация препарата в плазме крови (tmax) достигается к 13-14
- 53. Обзор препарата Терапия Показания: лечение шизофрении и профилактика рецидивов шизофрении Назначение: назначается без перорального перекрытия при
- 54. Обзор препарата Результаты Эффективность и безопасность по сравнению с плацебо: доказаны в 4 краткосрочных и долгосрочном
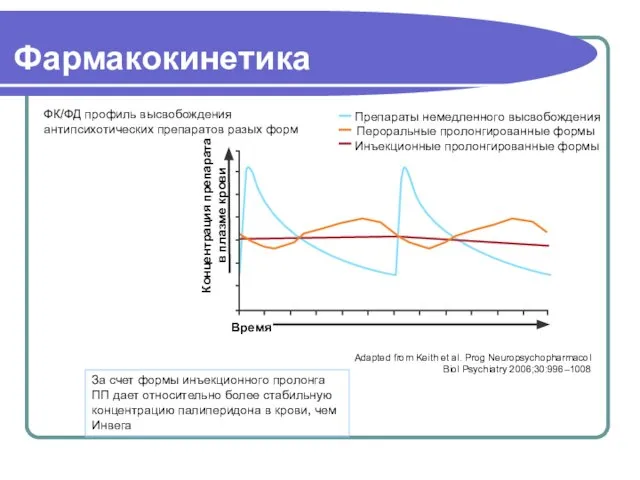
- 55. Фармакокинетика ФК/ФД профиль высвобождения антипсихотических препаратов разых форм За счет формы инъекционного пролонга ПП дает относительно
- 56. Пациенты особых категорий: рекомендации по дозировке Почечная недостаточность: Легкая (клиренс креатинина ≥50– Доза в интервале 25–100
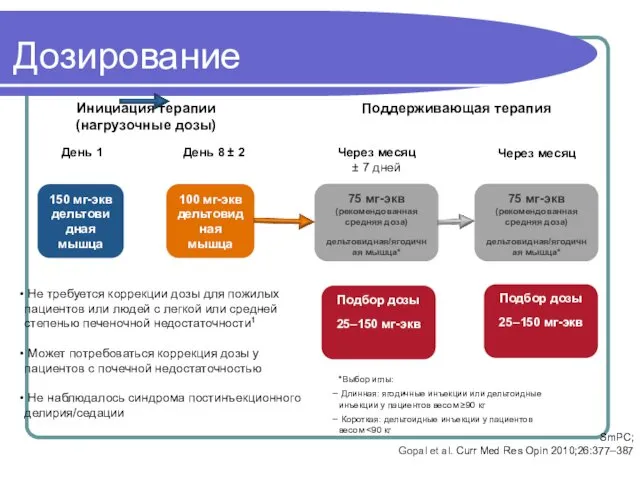
- 57. Дозирование Инициация терапии (нагрузочные дозы) Поддерживающая терапия Через месяц Через месяц ± 7 дней Подбор дозы
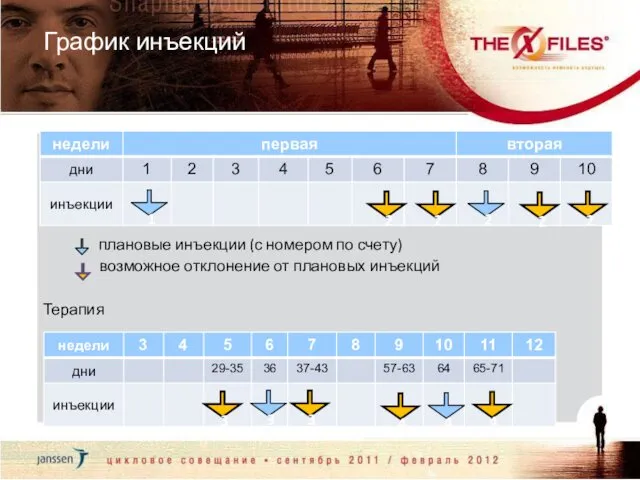
- 58. График инъекций 1 плановые инъекции (с номером по счету) возможное отклонение от плановых инъекций 2 2
- 59. Пропуск инъекций при поддерживающей терапии (с третьей инъекции) *Кроме случаев, когда состояние пациента было стабилизировано на
- 60. Необходимость инициирующих доз При начале терапии с дозы 75 мг экв концентрация палиперидона в плазме крови
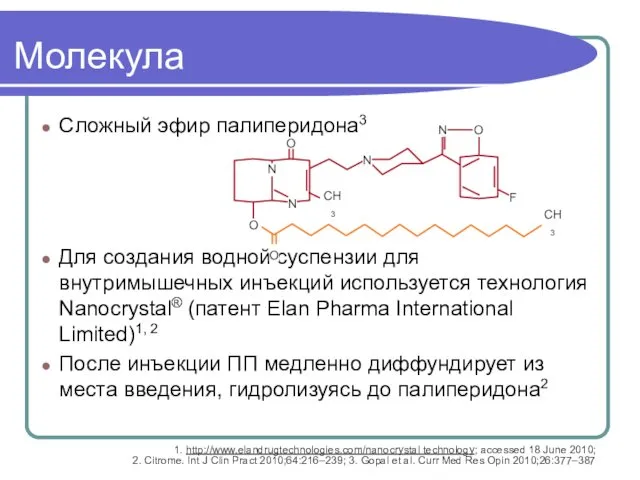
- 61. Молекула Сложный эфир палиперидона3 Для создания водной суспензии для внутримышечных инъекций используется технология Nanocrystal® (патент Elan
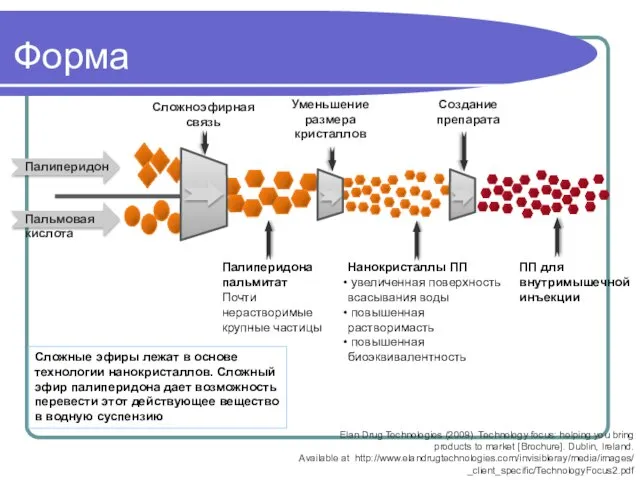
- 62. Форма Палиперидона пальмитат Почти нерастворимые крупные частицы Нанокристаллы ПП увеличенная поверхность всасывания воды повышенная растворимасть повышенная
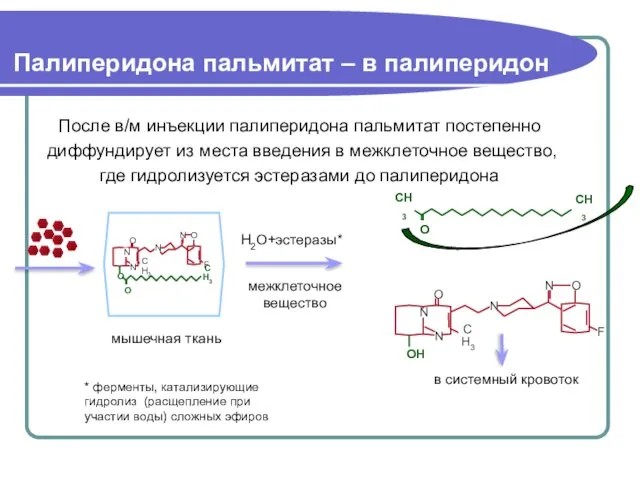
- 63. Палиперидона пальмитат – в палиперидон После в/м инъекции палиперидона пальмитат постепенно диффундирует из места введения в
- 64. Различия пролонгированных инъекционных рисперидона и палиперидона пальмитата
- 65. Выводы Программа клинической разработки палиперидона пальмитата позволила оптимизировать стратегию инициирующей терапии и выбора места инъекции Отмечается
- 67. Скачать презентацию














































 Основные принципы хирургических операций
Основные принципы хирургических операций Эрих Фромм: гуманистическая теория личности
Эрих Фромм: гуманистическая теория личности Рентгенодиагностика дегенеративно-дистрофических заболеваний легких. Рентгенодиагностика пневмокониозов
Рентгенодиагностика дегенеративно-дистрофических заболеваний легких. Рентгенодиагностика пневмокониозов Қазақстан Республикасында иммунопрофилактиканы жүргізудің ерекшеліктері
Қазақстан Республикасында иммунопрофилактиканы жүргізудің ерекшеліктері Госпожа Ци Чжун Фэн
Госпожа Ци Чжун Фэн Удушение. Асфикси́я
Удушение. Асфикси́я Конфликты среди людей и способы их разрешения
Конфликты среди людей и способы их разрешения Хирургический шов на этапах оперативного вмешательства. Аргументация выбора
Хирургический шов на этапах оперативного вмешательства. Аргументация выбора Костная пластика челюстей. Ошибки и осложнения при пластических операциях
Костная пластика челюстей. Ошибки и осложнения при пластических операциях Дисграфия
Дисграфия Электрокардиографические методы диагностики поражения сердца при тиреоидной патологии
Электрокардиографические методы диагностики поражения сердца при тиреоидной патологии Медициналық көмек түрлері
Медициналық көмек түрлері Инструкция по передаче медицинских изделий
Инструкция по передаче медицинских изделий Культурно-исторический подход в психологии
Культурно-исторический подход в психологии Групповая динамика. Фазы развития группы
Групповая динамика. Фазы развития группы Бүкіл антиген сипаттамасы
Бүкіл антиген сипаттамасы Вебинар Оценка готовности санитарного обеспечения
Вебинар Оценка готовности санитарного обеспечения Лучевая диагностика заболеваний и повреждений позвоночника
Лучевая диагностика заболеваний и повреждений позвоночника Развитие речи 7-10 лет
Развитие речи 7-10 лет Теория развития интеллекта Жана Пиаже
Теория развития интеллекта Жана Пиаже Генетическое исследование мтДНК для прогнозирования и ранней диагностики MELAS в пренатальный период
Генетическое исследование мтДНК для прогнозирования и ранней диагностики MELAS в пренатальный период Диагностика особенностей развития личности дошкольника
Диагностика особенностей развития личности дошкольника Этиология, патогенез, классификация и клиника гиперпластических процессов эндометрия (ГПЭ)
Этиология, патогенез, классификация и клиника гиперпластических процессов эндометрия (ГПЭ) Эпилепсия. Классификация. Диагностика. Лечение. ЭЭГ. Соматоформные расстройства
Эпилепсия. Классификация. Диагностика. Лечение. ЭЭГ. Соматоформные расстройства Опухоли. Онкология
Опухоли. Онкология Психологическая помощь в Калуге
Психологическая помощь в Калуге Травма грудной клетки
Травма грудной клетки Құрамында антрацен туындылары бар дәрілік өсімдіктер, шикізаттар мен өнімдер
Құрамында антрацен туындылары бар дәрілік өсімдіктер, шикізаттар мен өнімдер