Содержание
- 2. 2 – денсиметрия позволяет определять плотность воды с точностью до 10-7. Пример. Концентрация дейтерия в тяжелой
- 3. Способы выражения плотности d [г/см3] [г/мл] 1 см3 – объем куба со стороной 1 см. 1
- 4. dtt (безразмерная) dt4 – плотность пробы при температуре t [г/мл], (dt4)ст – плотность воды со стандартным
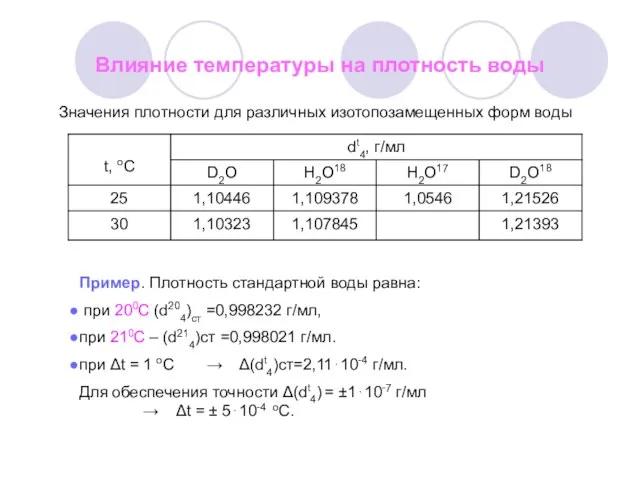
- 5. Влияние температуры на плотность воды Значения плотности для различных изотопозамещенных форм воды Пример. Плотность стандартной воды
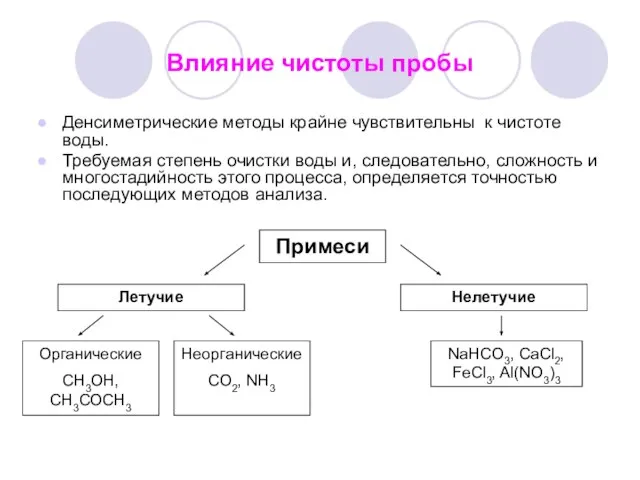
- 6. Влияние чистоты пробы Денсиметрические методы крайне чувствительны к чистоте воды. Требуемая степень очистки воды и, следовательно,
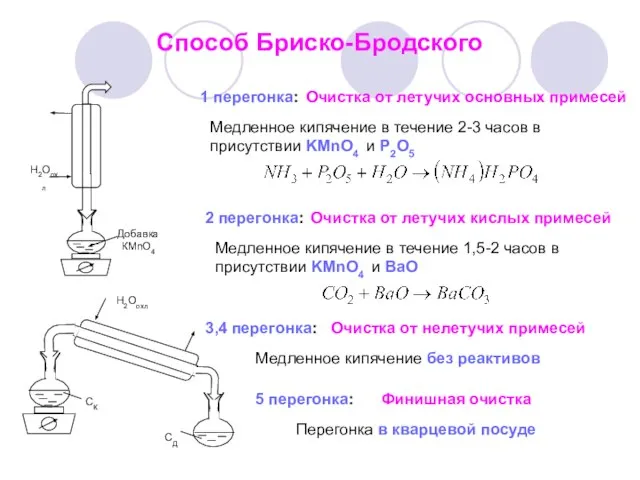
- 7. Способ Бриско-Бродского 1 перегонка: Медленное кипячение в течение 2-3 часов в присутствии KMnO4 и Р2О5 Очистка
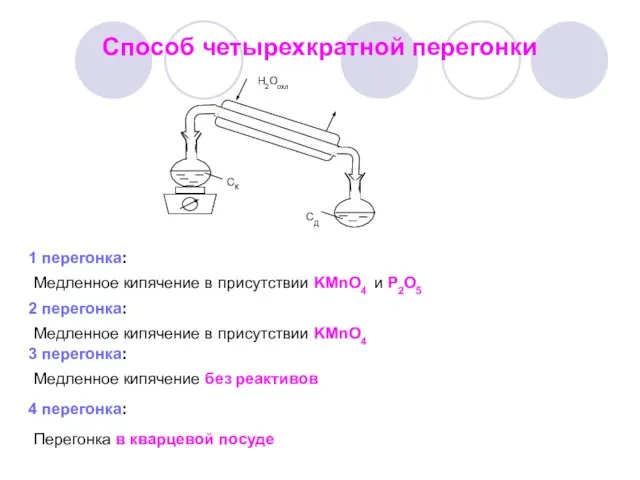
- 8. Способ четырехкратной перегонки 1 перегонка: Медленное кипячение в присутствии KMnO4 и Р2О5 2 перегонка: Медленное кипячение
- 9. Техника перегонки При перегонке первая фракция всегда обогащена легким изотопом, а вода, которая остается в колбе
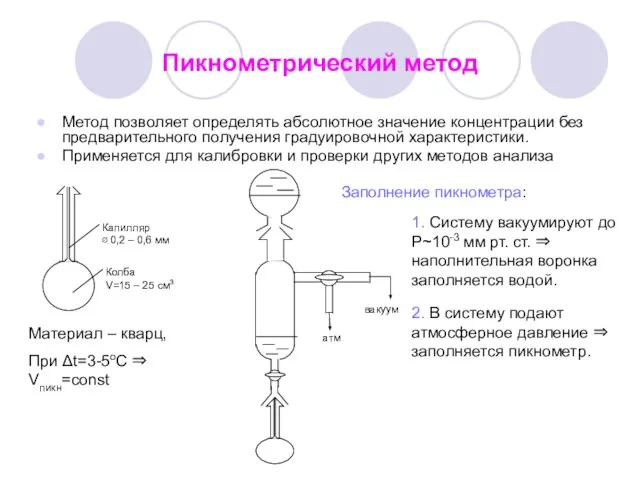
- 10. Пикнометрический метод Метод позволяет определять абсолютное значение концентрации без предварительного получения градуировочной характеристики. Применяется для калибровки
- 11. 1. Определяют массу пустого пикнометра m1. 2. Определяют массу пустого пикнометра, приведенную к пустоте m1*: dкв
- 12. 5. Определяют массу бидистиллата в пикнометре mст: 6. Определяют массу пробы в пикнометре mХ: 7. Для
- 13. Точность анализа зависит от ряда причин: кривизны мениска, массы влаги, адсорбированной на наружной поверхности пикнометра, механических
- 15. Скачать презентацию

![Способы выражения плотности d [г/см3] [г/мл] 1 см3 – объем куба](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/601276/slide-2.jpg)
![dtt (безразмерная) dt4 – плотность пробы при температуре t [г/мл], (dt4)ст](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/601276/slide-3.jpg)




 Вторая жизнь вещей. Поделки из пластиковых бутылок своими руками
Вторая жизнь вещей. Поделки из пластиковых бутылок своими руками 20130419_kartiny_ivana_shishkina
20130419_kartiny_ivana_shishkina Право на труд. Трудовые отношения
Право на труд. Трудовые отношения 20160108_prezentatsiya_microsoft_office_powerpoint_1
20160108_prezentatsiya_microsoft_office_powerpoint_1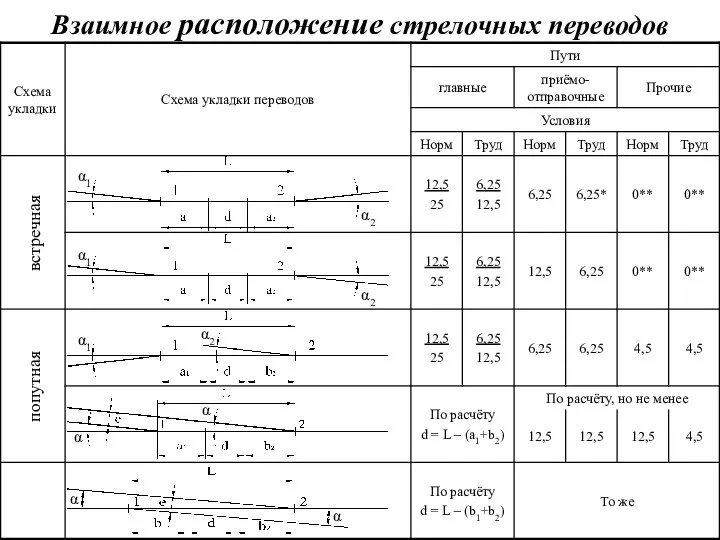 Взаимное расположение стрелочных переводов
Взаимное расположение стрелочных переводов Welding. In practice rightward
Welding. In practice rightward Устройство и назначение станка СТД-120М
Устройство и назначение станка СТД-120М Система безналичного питания, дополнительных услуг
Система безналичного питания, дополнительных услуг Влияние добавок, содержащих полифосфорную кислоту, на свойства битума и асфальтобетона
Влияние добавок, содержащих полифосфорную кислоту, на свойства битума и асфальтобетона Германия
Германия Виды транспорта в Лондоне
Виды транспорта в Лондоне 20151003_reklama_v_sovremennom_mire
20151003_reklama_v_sovremennom_mire Астрономия параграфы 22 и 23
Астрономия параграфы 22 и 23 prezentatsia_dlya_zaschity
prezentatsia_dlya_zaschity Мои любимые занятия. Валиулина Мария
Мои любимые занятия. Валиулина Мария Церемония вручения оскара за 2015 год
Церемония вручения оскара за 2015 год Подарок от любимой
Подарок от любимой Работа социального педагога с родителями одаренных, трудных, педагогически запущенных детей, а также с родителями
Работа социального педагога с родителями одаренных, трудных, педагогически запущенных детей, а также с родителями Event DJ AndRave pres-2
Event DJ AndRave pres-2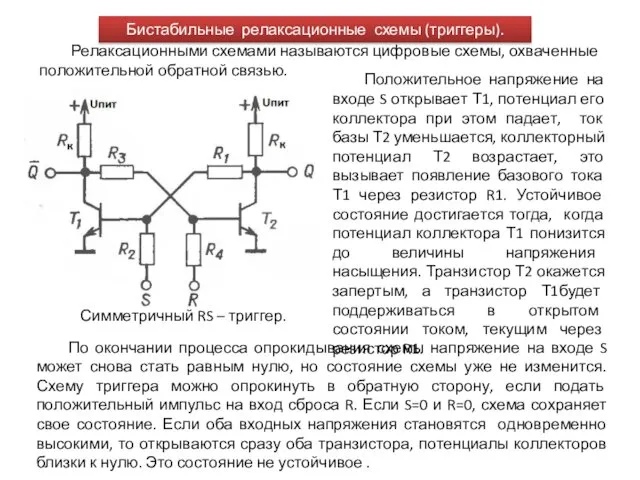 Бистабильные релаксационные схемы (триггеры). Лекция10
Бистабильные релаксационные схемы (триггеры). Лекция10 Монтаж и эксплуатация оборудования и систем газоснабжения
Монтаж и эксплуатация оборудования и систем газоснабжения Bright Ideas 3
Bright Ideas 3 20141208_prezentatsiya_k_uroku_v_serdevekovom_zamke_v_6_klasse
20141208_prezentatsiya_k_uroku_v_serdevekovom_zamke_v_6_klasse Active learning methods
Active learning methods Умножители напряжения. (Лекция 3)
Умножители напряжения. (Лекция 3) Техники оформления пасхального яйца
Техники оформления пасхального яйца Генератор 2ГВ.003
Генератор 2ГВ.003 Презентация для сети Формат
Презентация для сети Формат