Содержание
- 2. До хімічної промисловості належать галузі, які забезпечують економіку України мінеральними добривами, содою, фарбами, паливно-мастильними продуктами, пластмасами,
- 3. В Україні розвинута багатогалузева хімія і нафтохімія. Найкрупнішими підрозділами цієї галузі є виробництва основної хімії (49%
- 4. Неорганічна хімія переважно виробляє напівфабрикати, що використовуються в інших галузях промисловості. Виняток становлять мінеральні добрива, котрі
- 5. Основна хімія як галузь обіймає кислотну, содову промисловість та виробництво мінеральних добрив. Сірчанокислотна промисловість виробляє продукт,
- 6. Промисловість хімії органічного синтезу використовує як сировину нафту. Це багатогалузеве виробництво, підприємства тяжіють до районів нафтовидобутку,
- 7. Види продукції, які виробляє хімічна промисловість гірничо-хімічна сировина, основні хімічні продукти (аміак, неорганічні кислоти, сода, хлоропродукти,
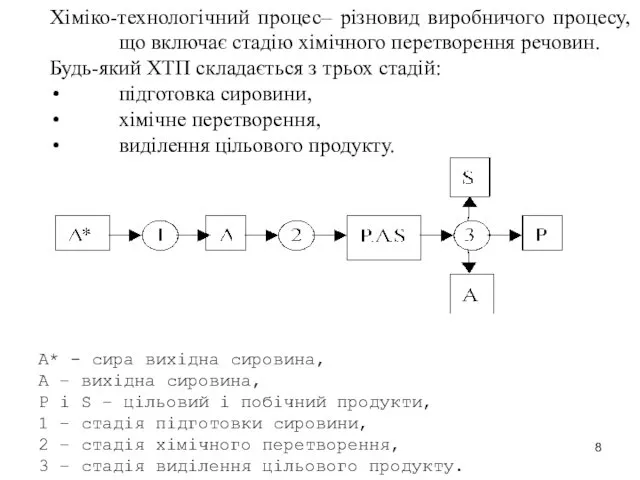
- 8. Хіміко-технологічний процес– різновид виробничого процесу, що включає стадію хімічного перетворення речовин. Будь-який ХТП складається з трьох
- 9. Основою класифікації можуть бути: спосіб організації процесу, кратність обробки сировини, вид використовуваної сировини, тип основної хімічної
- 10. 3.комбінованими. Комбіновані процеси можуть характеризуватися: безперервним надходженням сировини і періодичним відводом продукту, періодичним надходженням сировини і
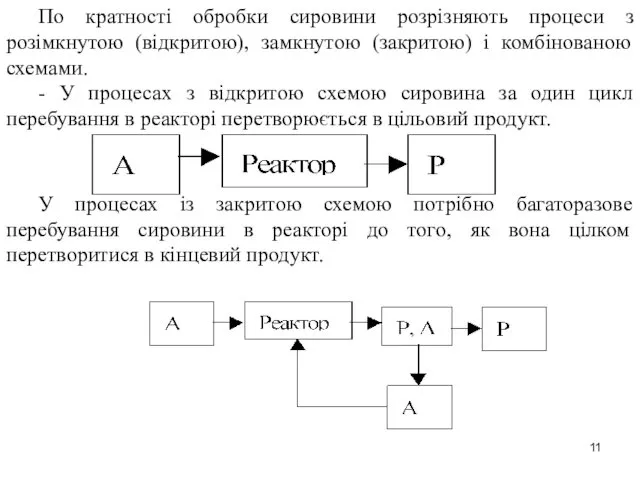
- 11. По кратності обробки сировини розрізняють процеси з розімкнутою (відкритою), замкнутою (закритою) і комбінованою схемами. - У
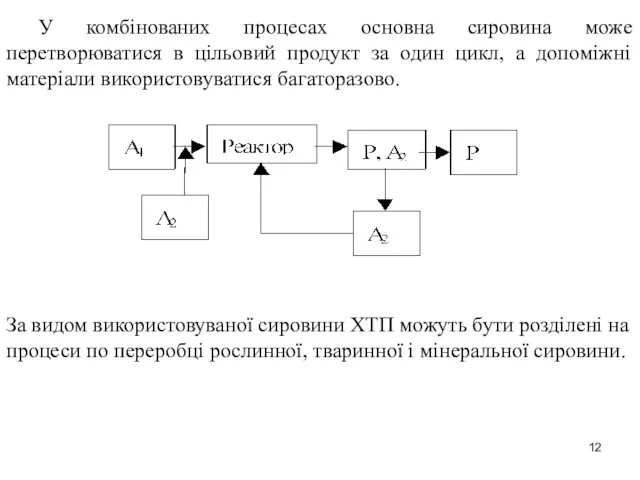
- 12. У комбінованих процесах основна сировина може перетворюватися в цільовий продукт за один цикл, а допоміжні матеріали
- 13. Основу ХТП складають різні хімічні реакції: прості і складні, оборотні і необоротні, гомогенні і гетерогенні, екзотермічні
- 14. ВИРОБНИЦТВО СІРЧАНОЇ КИСЛОТИ ВИКОРИСТАННЯ: для виробництва добрив, очищення нафтопродуктів, у кольоровій металургії, при травленні металів. Особливо
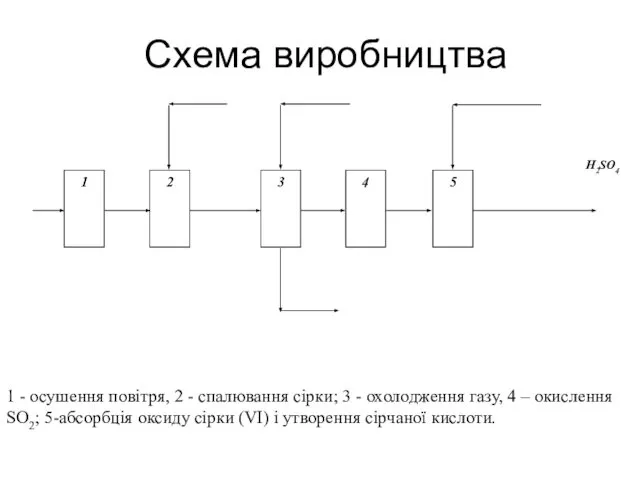
- 15. Схема виробництва 1 - осушення повітря, 2 - спалювання сірки; 3 - охолодження газу, 4 –
- 16. Основні стадії виробництва Отримання діоксиду сірки (у випадку спалювання сірки або сірководню) Конверсія діоксиду сірки в
- 17. Перспективне використання як абсорбера WSA конденсатора – вертикальної оболонки, обладнаної пучком труб з низпадаючою плівкою конденсату.
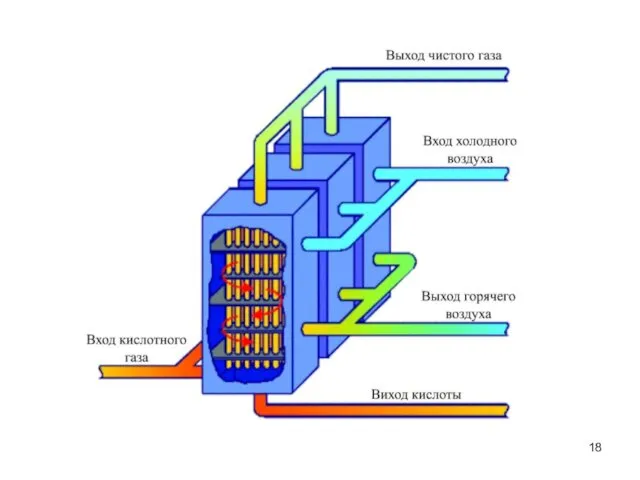
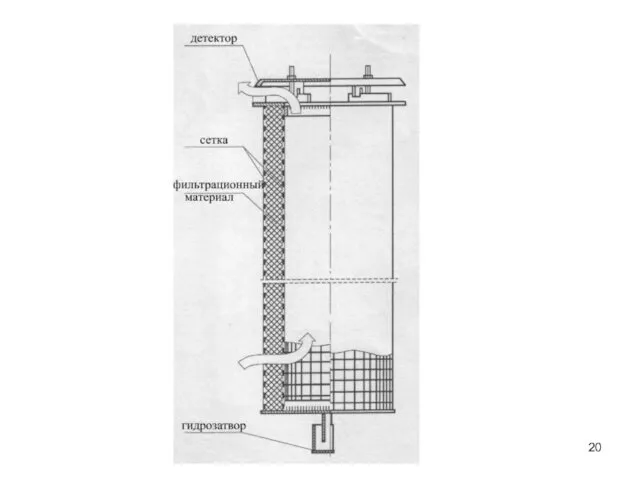
- 19. Основні негативні впливи на навколишнє середовище Забруднення атмосфери сірковміс-ними газами та парами сірчаної кислоти. Попередження: Встановлення
- 21. 2. Забруднення поверхневих вод кислими стоками. Попередження: Встановлен-ня станцій нейтралізації кислих стоків.
- 22. ВИРОБНИЦТВО ФОСФОРНОЇ КИСЛОТИ ВИКОРИСТАННЯ: виробництво фосфорних добрив, використовується у виробництві різних технічних солей, у тому числі
- 23. Стадії виробництва екстракційної фосфорної кислоти: 1-екстракція, 2-фільтрування, 3-випарення. Екстракція Н3РО4 полягає в обробці порошку природного фосфату
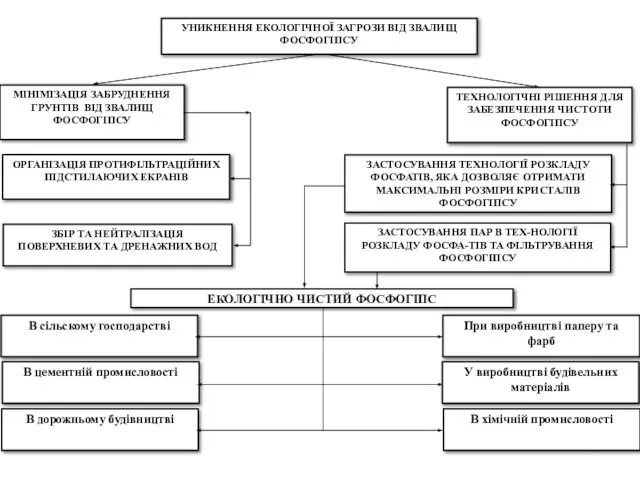
- 24. При кристалізації гіпсу в його кристалічні ґрати входять аніони НРО4-2, що приводить до утворення фосфогіпсу –
- 25. Для одержання 1 т Р2О5 у вигляді 54%-го розчину екстракційної фосфорної кислоти витрачається до 220 м3
- 26. Термічний спосіб одержання Н3РО4 заснований на відновленні фосфору з фосфатів в електродугових печах за допомогою вуглецю
- 27. При спалюванні 1кг Р виділяється 24,6 МДж тепла, при гідратації – ще 3МДж. У процесі гідратації
- 28. При цьому одержують у вигляді відходів: шлак, т – 10-11, ферофосфор, кг – 40-100, грубний газ
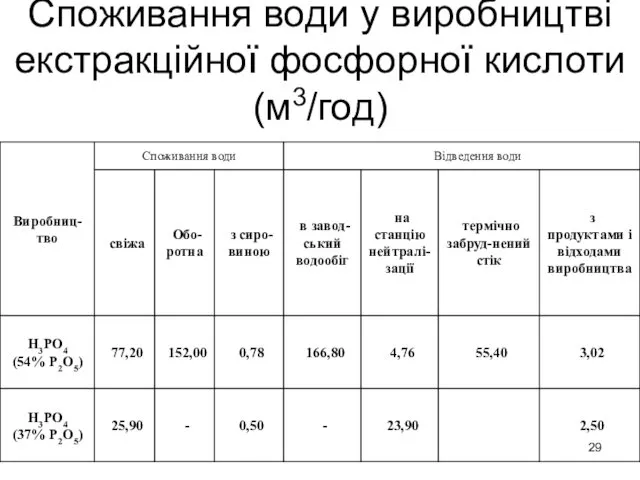
- 29. Споживання води у виробництві екстракційної фосфорної кислоти (м3/год)
- 30. ВИРОБНИЦТВО КАЛЬЦИНОВАНОЇ СОДИ Na2CO3 Розсіл, що містить 300-310г/дм3 NaCl насичують в абсорбційній колоні аміаком, а потім
- 31. Для виробництва 1т Na2CO3 потрібні: NaCl – 1,6т, CaCl2 – 1,1-1,25т, NH3 – 2,5кг, кокс –
- 32. ВИРОБНИЦТВО ДОБРИВ Фосфорні добрива Простий суперфосфат одержують сірчанокислотним розкладанням фторапатиту: 2Ca5F(PO4)3 + 7H2SO4 + 3H2O =
- 33. Подвійний суперфосфат одержують дією екстракційної Н3РО4 на фторапатит: Ca5F(PO4)3 + 7H3PO4 + 5H2O = 5Ca(H2PO4)2*H2O +
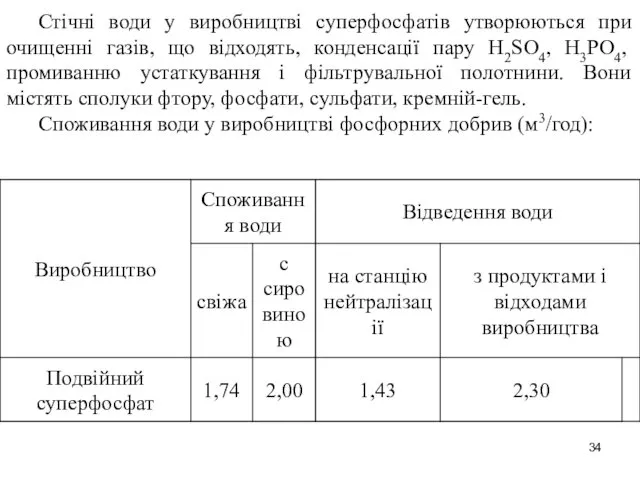
- 34. Стічні води у виробництві суперфосфатів утворюються при очищенні газів, що відходять, конденсації пару H2SO4, Н3РО4, промиванню
- 35. Азотні добрива. Аміачна селітра: NH3 + HNO3 = NH4NO3 + Q (виділяється) Рідинні викиди відсутні, тому
- 36. Карбамід (сечовина): NH3 + СО2 = (NH2)2CO + Н2О Процес йде при температурі 200оС і тиску
- 37. Калійні добрива Найчастіше у виді добрив застосовують природні речовини (KCl, сильвініт - mKCl*nNaCl) чи продукти їхньої
- 38. Повторення Вплив розробок калійних солей, які використовуються як калійні добрива, на довкілля
- 39. Родовище полімінеральних калійних руд на Україні
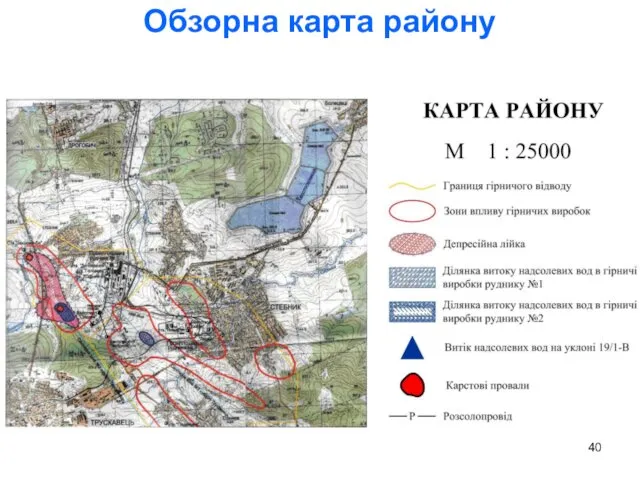
- 40. Обзорна карта району
- 41. Характеристика поліменеральних калійних руд Прикарпаття Хімічний склад руди (%) MgCl2 -0,03 MgSO4 -23,2 CaSO4 -4,2 K2SO4
- 42. Галургійна схема переробки руд включає Одержання сульфату калію Флотаційне розділення малорозчинних калійних мінералів і галіту Одержання
- 43. Хвостосховище Стебниківського ДГХП «Полімінерал»
- 45. Характеристика хвостосховища Загальна площа хвостосховища -125 га Площа акваторії -70 га Висота дамби -12 м Довжина
- 46. Хімічний склад розсолів хвостосховища Na+ - 115 г/л K+ - 14 г/л Mg+ - 6,4 г/л
- 47. Нафтохімічні виробництва. Всі похідні із сирої нафти нафтопродукти розділяються на дві групи: 1) спрямовані на безпосереднє
- 48. Виготовлення фарб. Фарби — це однорідні суспензії пігментів у речовинах, що утворюють плівки покриття. Фарби застосовуються
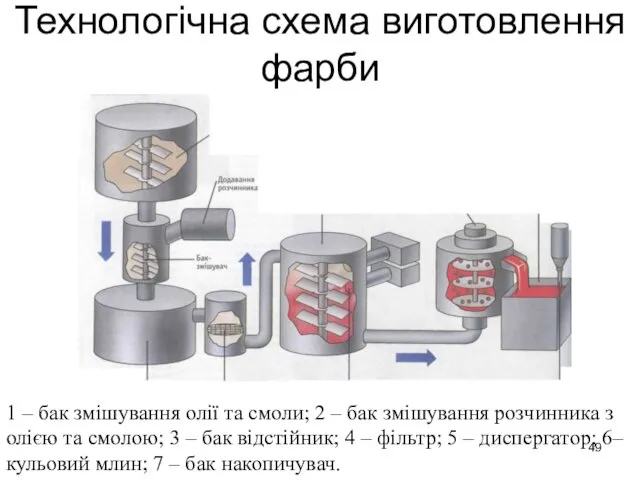
- 49. Технологічна схема виготовлення фарби 1 – бак змішування олії та смоли; 2 – бак змішування розчинника
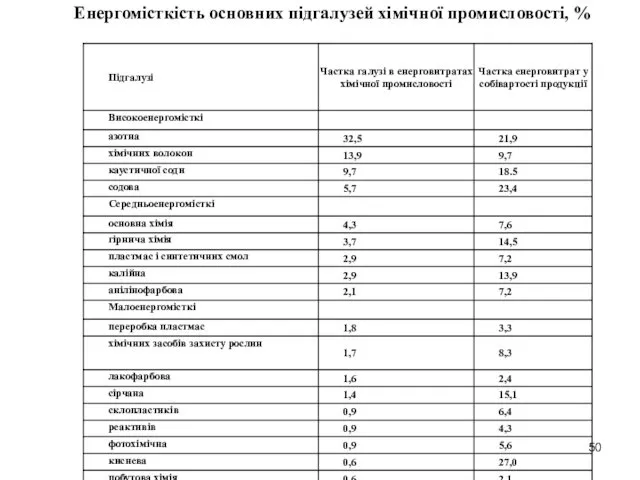
- 50. Енергомісткість основних підгалузей хімічної промисловості, %
- 51. Виробництва хімічної промисловості - забруднюючі атмосфери
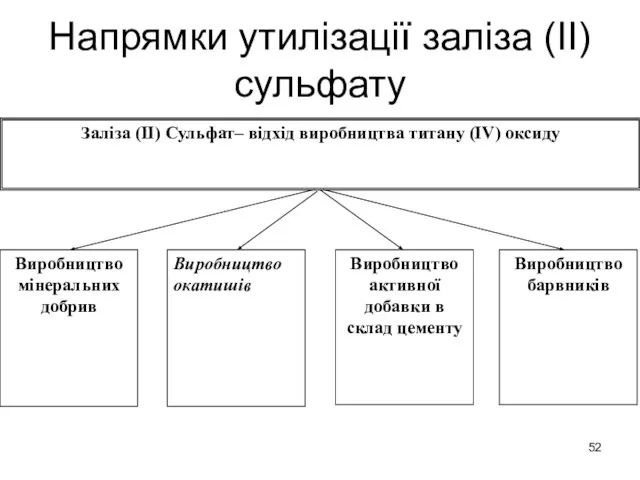
- 52. Напрямки утилізації заліза (ІІ) сульфату
- 55. Скачать презентацию






































 80 лет бабушке
80 лет бабушке Сила влияния Божьего слуги
Сила влияния Божьего слуги Моделирование плечевого изделия с цельнокроенным рукавом
Моделирование плечевого изделия с цельнокроенным рукавом Производство детского сухого молочного питания
Производство детского сухого молочного питания ЖД ГИД (СПО)
ЖД ГИД (СПО) Анилиновая кожа
Анилиновая кожа Христинский смысл таинства крещения
Христинский смысл таинства крещения Сретение Господне
Сретение Господне Проект дома 2
Проект дома 2 Конденсаторы в электронных системах безопасности
Конденсаторы в электронных системах безопасности Взаимодействие гостиниц и турфирм
Взаимодействие гостиниц и турфирм 20150202_kvn_5_klass_literatura
20150202_kvn_5_klass_literatura 20150208_literatura_i_muzyka
20150208_literatura_i_muzyka Тип культурного (художественного) сознания
Тип культурного (художественного) сознания МЧС России
МЧС России Храм Бога Хонсу в Карнаке
Храм Бога Хонсу в Карнаке Работа с каталогом. Общий поиск. Как найти книгу
Работа с каталогом. Общий поиск. Как найти книгу Неопалимая Купина
Неопалимая Купина Самоконтроль
Самоконтроль Фотографии
Фотографии Связующие вещества
Связующие вещества Новгородский областной колледж искусств им. С.В. Рахманинова
Новгородский областной колледж искусств им. С.В. Рахманинова Агитация
Агитация Жұлдызды сәт ойыны
Жұлдызды сәт ойыны VellеsMotоrs. Исходные данные
VellеsMotоrs. Исходные данные Шаблон проекта Мой бизнес
Шаблон проекта Мой бизнес Доклад о состоянии передачи исполнительной документации для регистрации оборудования и трубопроводов технологических систем
Доклад о состоянии передачи исполнительной документации для регистрации оборудования и трубопроводов технологических систем Виды рекламы и её влияние на дошкольников
Виды рекламы и её влияние на дошкольников