Содержание
- 2. Heredity Heredity is the property of an organism to repeat a complex of characteristics found in
- 3. Variability Variability is diversity of characteristics among representatives of a species as well as the property
- 4. Modification variability Changes in an organism connected to phenotype alteration caused by the environment and in
- 5. Modification variability in most cases modification variability results in positive adaptation of an organism to environmental
- 6. Mutations Mutation is persistent genotype change taking place under the influence of external or internal environment
- 7. Genome mutations Polyploidy is the increase of chromosome set fold to the number of chromosomes in
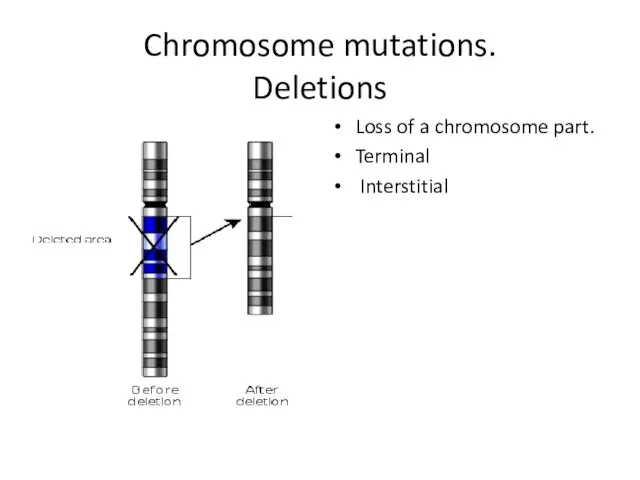
- 8. Chromosome mutations. Deletions Loss of a chromosome part. Terminal Interstitial
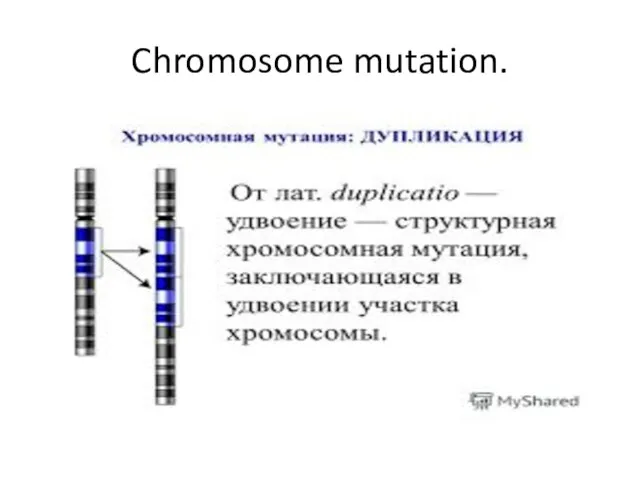
- 9. Chromosome mutation.
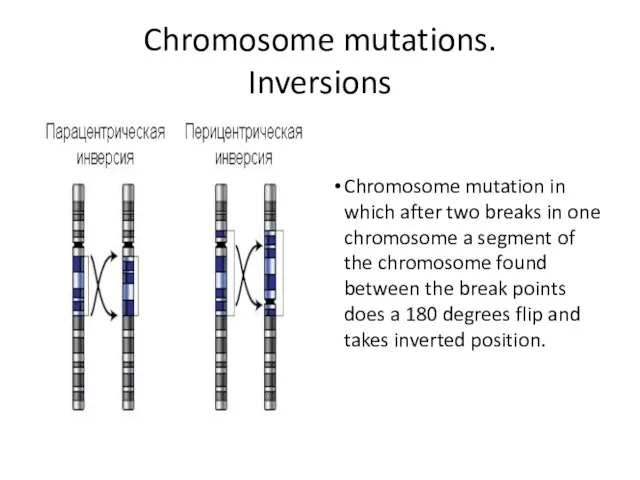
- 10. Chromosome mutations. Inversions Chromosome mutation in which after two breaks in one chromosome a segment of
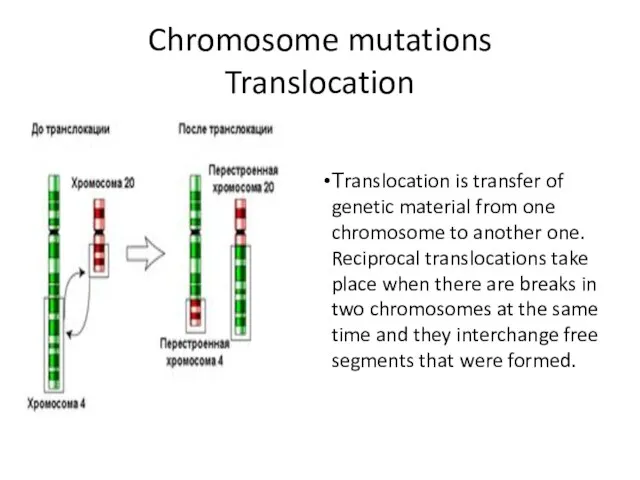
- 11. Chromosome mutations Translocation Тranslocation is transfer of genetic material from one chromosome to another one. Reciprocal
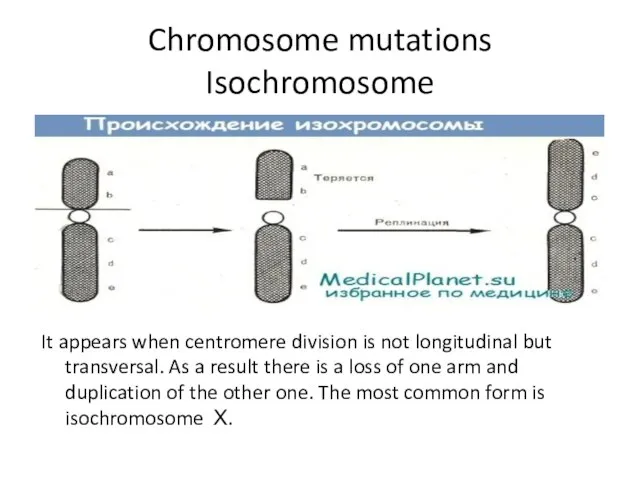
- 12. Chromosome mutations Isochromosome It appears when centromere division is not longitudinal but transversal. As a result
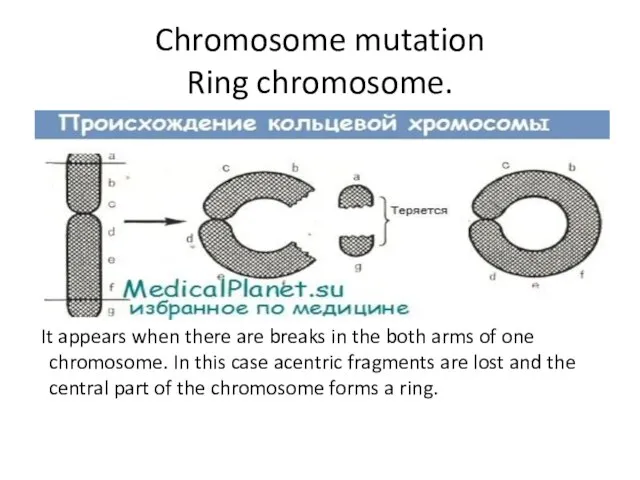
- 13. Chromosome mutation Ring chromosome. It appears when there are breaks in the both arms of one
- 14. Basic types of gene mutations Gene mutations are any changes in nucleotide sequence within the limits
- 15. Nonsense mutations
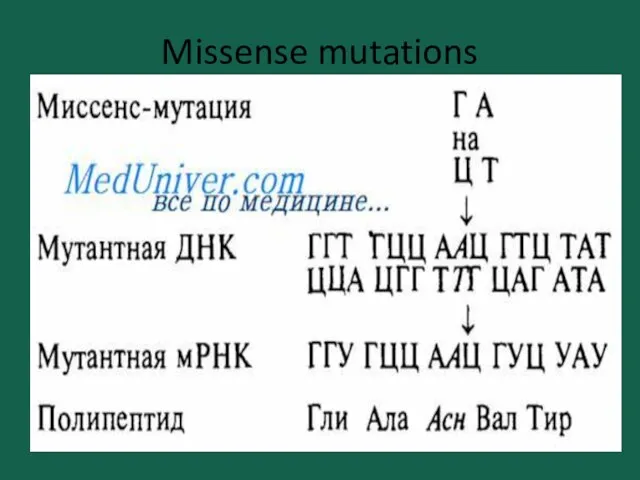
- 16. Missense mutations
- 17. Types of gene mutations Deletions or insertions. When three nucleotides are affected in polypeptide composition: either
- 18. Morphogenesis Morphogenesis is realization of a genetic program in three-dimensional space and time induced by environmental
- 19. Characteristics of dysmorphogenesis in diagnostics of hereditary pathology Minor development abnormalities or congenital morphogenetic variants. They
- 20. Symptoms of dysmorphogenesis Skin: angiomas, telangiectasia, pigment spots, depigmentation, dark-brown freckles (> 20), hypertrichosis, hirsutism, lipomas,
- 21. Symptoms of dysmorphogenesis White hair strand Folded skin
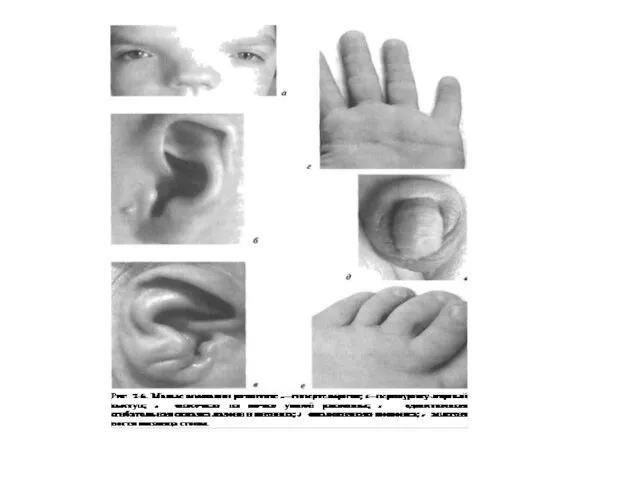
- 22. Symptoms of dysmorphogenesis. Scull: hydrocepally, microcephally, macrocephally, brachycephally, dolichocephally, trigonocephally, acrocephally, prominent forehead (occiput). Ear auricle:
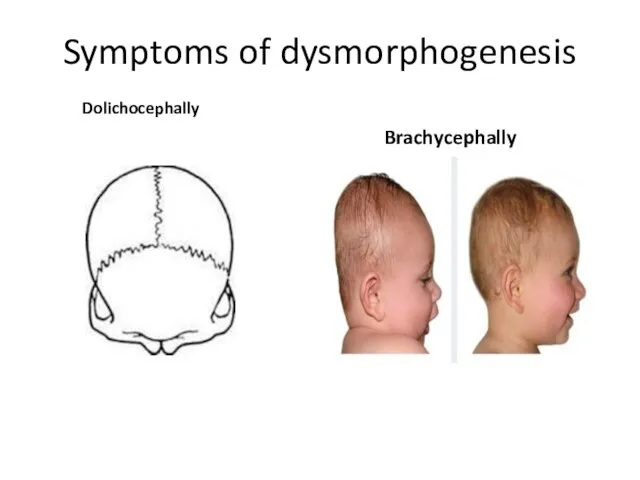
- 23. Symptoms of dysmorphogenesis Dolichocephally Brachycephally
- 24. Symptoms of dysmorphogenesis Trigonocephally Acrocephally
- 25. Symptoms of dysmorphogenesis Nose: short, beak shaped, saddle shaped nasal bridge, wide and flat nasal bridge,
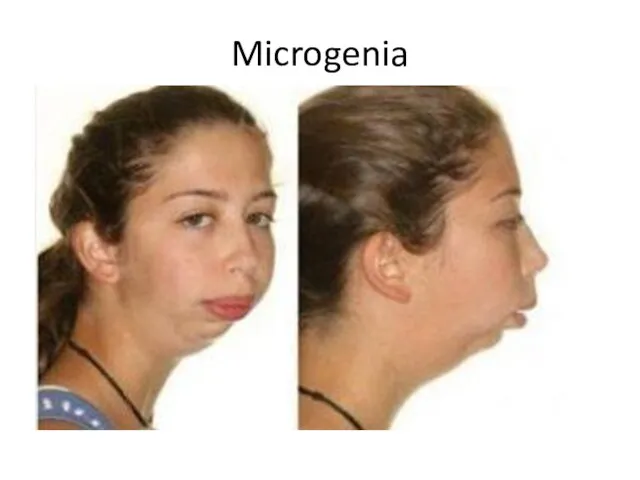
- 26. Microgenia
- 27. Symptoms of dysmorphogenesis Teeth: malposition, irregular shape, congenital excess or absence of one or more teeth,
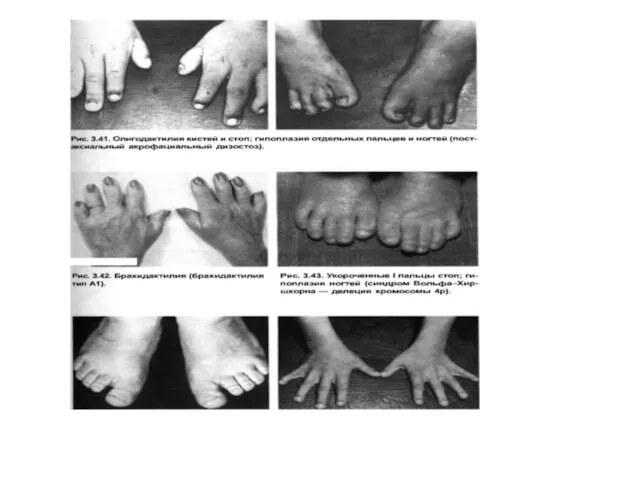
- 28. Symptoms of dysmorphogenesis Extremeties: shortened , elongated, valgoid, varus deformations, polydactyly, oligodactyly, brachydactyly, arachnodactyly, syndactyly, clinodactyly,
- 31. Clinical-genealogical method The method includes compilation of family tree model, clinical examination of its members and
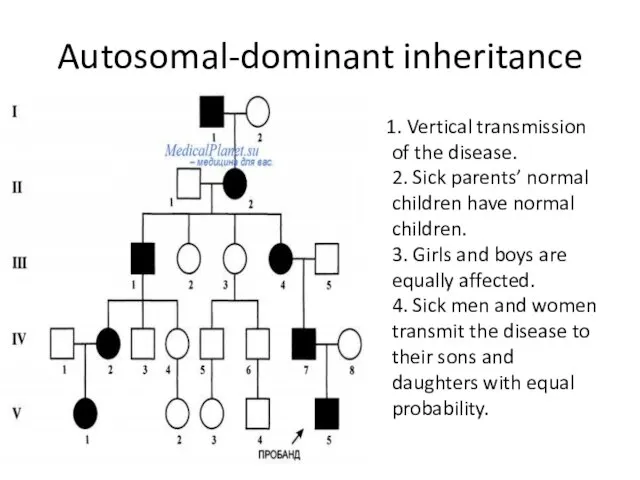
- 32. Autosomal-dominant inheritance 1. Vertical transmission of the disease. 2. Sick parents’ normal children have normal children.
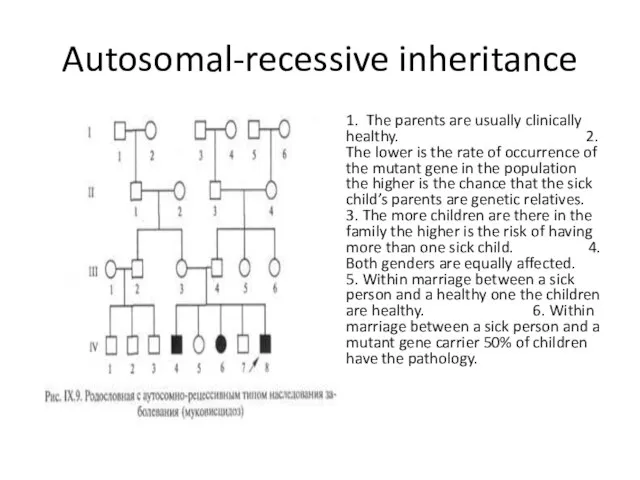
- 33. Autosomal-recessive inheritance 1. The parents are usually clinically healthy. 2. The lower is the rate of
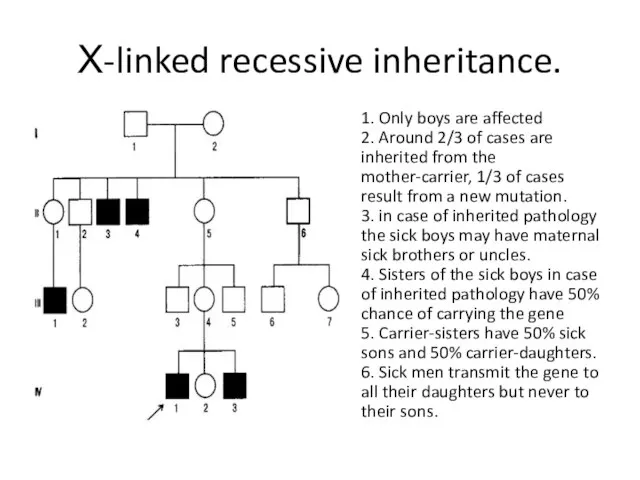
- 34. Х-linked recessive inheritance. 1. Only boys are affected 2. Around 2/3 of cases are inherited from
- 36. Syndromological method Detection of a minimal diagnostic symptom complex of required characteristics. One and the same
- 37. Cytogenetic diagnostics Indications: 1. Impairment of reproductive function of unclear etiology. а) spontaneous abortions (two or
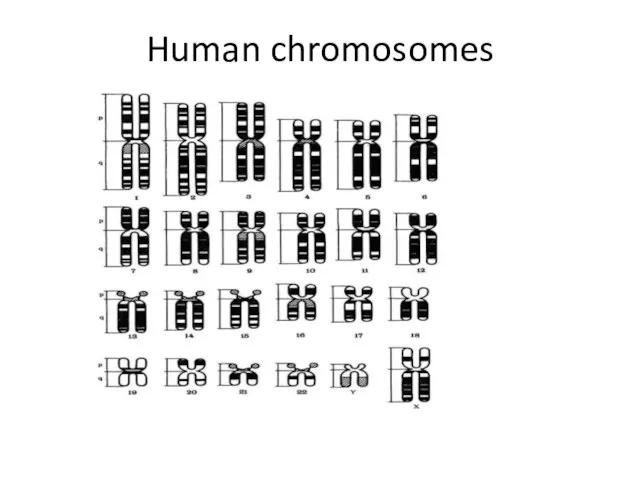
- 38. Human chromosomes
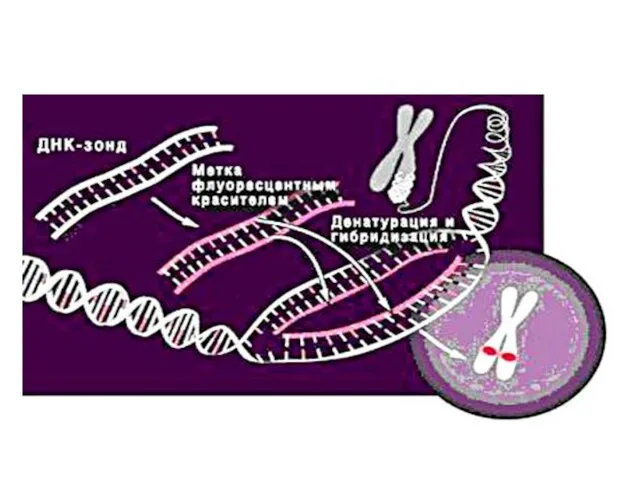
- 39. Molecular cytogenetics 1. Fluorescent in situ hybridization (FISH). Chromosome DNA after denaturation forms stable hybrids with
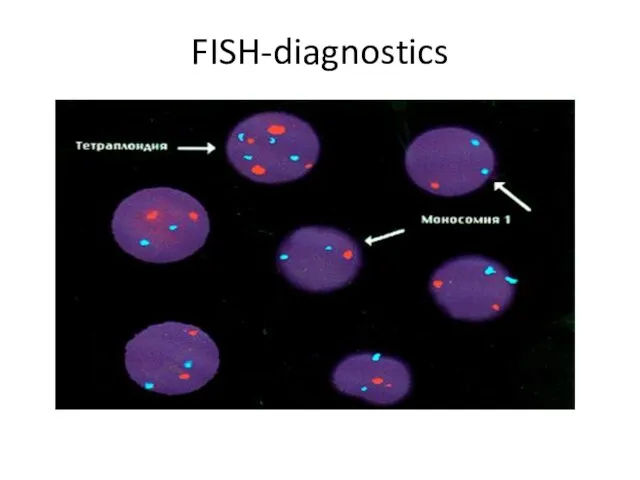
- 41. FISH-diagnostics
- 42. Спектроскопический анализ хромосом (SKY). Метод основан на использовании наборов зондов и флуоресцентных красителей, имеющих сродство к
- 43. Сравнительная геномная гибридизация(CGH). Метод позволяет провести скрининг всего кариотипа на предмет числовых и несбалансированных хромосомных перестроек,
- 45. Хромосомный микроматричный анализ Позволяет исследовать структуру всего генома в одном исследовании. Используется технология включающая полногеномную амплификацию
- 46. Хромосомный микроматричный анализ Прикрепление одного из компонентов реакции к подложке позволяет проводить множество реакций одновременно ,
- 47. Молекулярно-генетическая диагностика Используют с целью диагностики мутаций (диагностическое тестирование), выявление гетерозиготных носителей мутаций, проведение пренатальной и
- 48. Полимеразная цепная реакция Разработана в 1983 г Карри Муллисом( Нобелевская премия 1993 г). Суть метода- избирательное
- 49. Полимеразная цепная реакция Матричную ДНК переводят в однонитевую форму путем нагревания раствора > 95ᵒ в течение
- 50. Некоторые виды ПЦР 1.Мультиплексная ПЦР- одновременная амплифика-ция нескольких фрагментов ДНК. 2. Количественная ПЦР- введение в праймеры
- 52. Методы идентификации мутаций Прямые методы. Обнаружение нарушений в первичной нуклеотидной последовательности ДНК. Возможны только после идентификации
- 53. Методы идентификации мутаций Диагностика структурных внутригенных мутаций (делеций и инсерций). При них изменяется длина, а значит
- 54. Секвенирование Секвенирование ДНК – определение ее нуклеотидной последовательности . Методология секвенирования- из последовательности ДНК получить серию
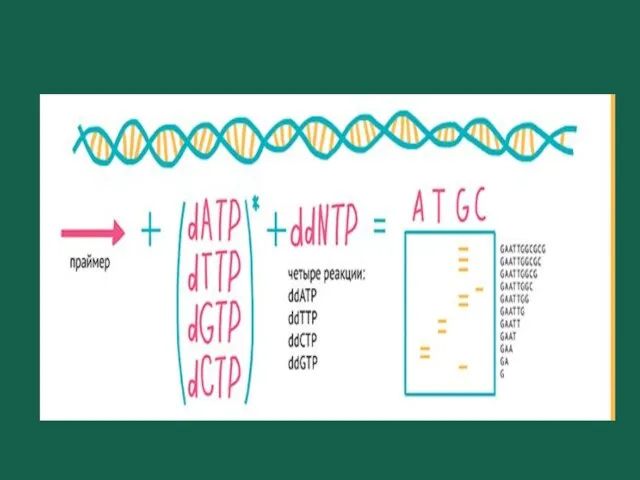
- 55. Секвенирование по Сэнгеру Метод терминатора (метод обрыва цепи). Используется для изучения фрагментов ДНК длиной до 1000
- 56. Секвенирование по Сэнгеру Полученные фрагменты визуализируются с помощью электрофореза в полиакриламидном геле и проводят его радиоавтографию.
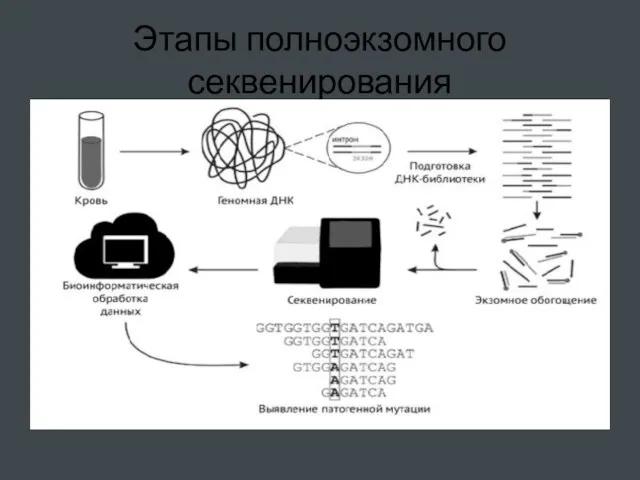
- 58. Полноэкзомное секвенирование Технология на платформе фирмы Illumina. 1. Подготовка библиотеки . ДНК фрагментируется на короткие кусочки
- 59. Полноэкзомное секвенирование Последующие этапы осуществляются в секвенаторе. 3.В него помещают стеклянный микрочип. На его поверхности фиксируются
- 60. Полноэкзомное секвенирование 5. Анализ результатов (биоинформационный конвейер). Полученный огромный набор небольших последовательнос-тей ( чтений) фильтруется –
- 61. Этапы полноэкзомного секвенирования
- 63. Скачать презентацию








































 Почему наши дети обманывают?
Почему наши дети обманывают? Проектирование и разработка автоматизированной информационной системы розничной торговли
Проектирование и разработка автоматизированной информационной системы розничной торговли Монтаж, наладка, эксплуатация и определение возможности оптимизации элементов автоматизированной системы управления
Монтаж, наладка, эксплуатация и определение возможности оптимизации элементов автоматизированной системы управления Урок №2
Урок №2 Лекция 12. Пространственные деревянные конструкции. Основные формы, области применения и основные расчёты
Лекция 12. Пространственные деревянные конструкции. Основные формы, области применения и основные расчёты Молоко і молочні продукти
Молоко і молочні продукти Обзор разработки Ярегского месторождения
Обзор разработки Ярегского месторождения Нарезание наружной и внутренней резьбы подготовила
Нарезание наружной и внутренней резьбы подготовила Первая Мировая Война (1914 - 1918)
Первая Мировая Война (1914 - 1918) кто хочет стать миллионером
кто хочет стать миллионером Three Bubble Steps
Three Bubble Steps Празднованию Пасхи
Празднованию Пасхи Элементы прямоугольного сечения с двойной арматурой
Элементы прямоугольного сечения с двойной арматурой Производство и эксплуатация транспортного средства повышенной проходимости трицикла-болотохода
Производство и эксплуатация транспортного средства повышенной проходимости трицикла-болотохода симфоническая музыка Свиридова — копия [Восстановленный]
симфоническая музыка Свиридова — копия [Восстановленный] Мобильное выставочное оборудование в среде
Мобильное выставочное оборудование в среде Проектирование вертолета
Проектирование вертолета Путешествие в LEGO страну
Путешествие в LEGO страну Современные методики и технологии обучения
Современные методики и технологии обучения Программа и методика испытаний цифрового мультиметра
Программа и методика испытаний цифрового мультиметра С днем рождения Кристина
С днем рождения Кристина История создания станков
История создания станков Совещание с руководителями управляющих организаций и ТСЖ
Совещание с руководителями управляющих организаций и ТСЖ Виртуальная экскурсия НАРОДОВ ДОНА ДРУЖНАЯ СЕМЬЯ
Виртуальная экскурсия НАРОДОВ ДОНА ДРУЖНАЯ СЕМЬЯ Требования к бетонным смесям при непрерывном безопалубочном формовании
Требования к бетонным смесям при непрерывном безопалубочном формовании Студенческие отряды как форма проявления социально-культурной активности современной молодежи
Студенческие отряды как форма проявления социально-культурной активности современной молодежи Неопалимая Купина
Неопалимая Купина Тема 2. Архаические представления и верования. Ранние формы религии. Магия, тотемизм, анимизм, фетишизм, шаманизм
Тема 2. Архаические представления и верования. Ранние формы религии. Магия, тотемизм, анимизм, фетишизм, шаманизм