Содержание
- 2. Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой
- 3. Аминокислоты Аминокислоты, в которых первичная аминогруппа находится в α-положении по отношению к карбоксильной, называются α-аминокислотами. Они
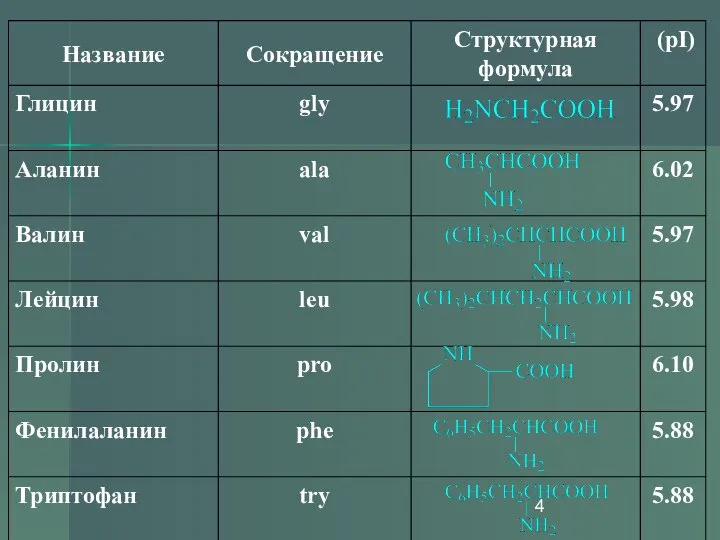
- 7. Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут быть синтезированы организмом из веществ, поступающих с пищей,
- 8. Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для организма человека: изолейцин, лейцин, лизин, метионин, фенилаланин, треонин,
- 9. . Кофигурация аминокислот Каждая α-аминокислота за исключением глицина, содержит асимметрический α-углеродный атом. Аминокислоты, получающиеся в результате
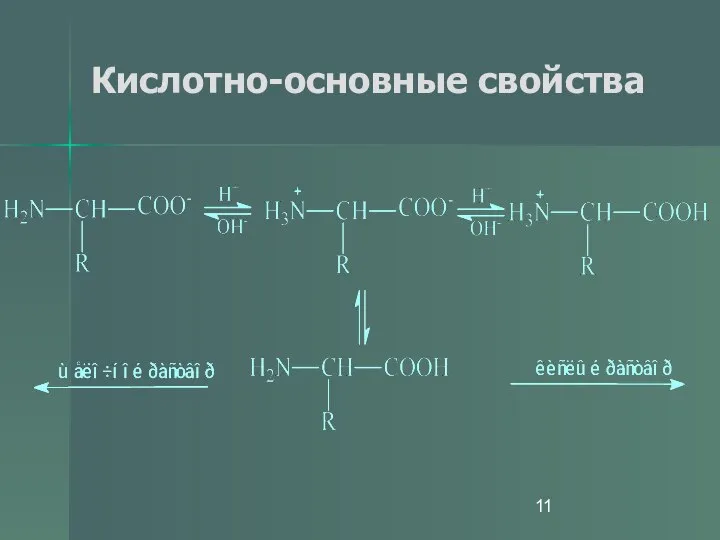
- 10. Кислотно-основные свойства Константы кислотности и основности для групп –СООН и –NH2 очень малы. Для большинства карбоновых
- 11. Кислотно-основные свойства
- 12. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии
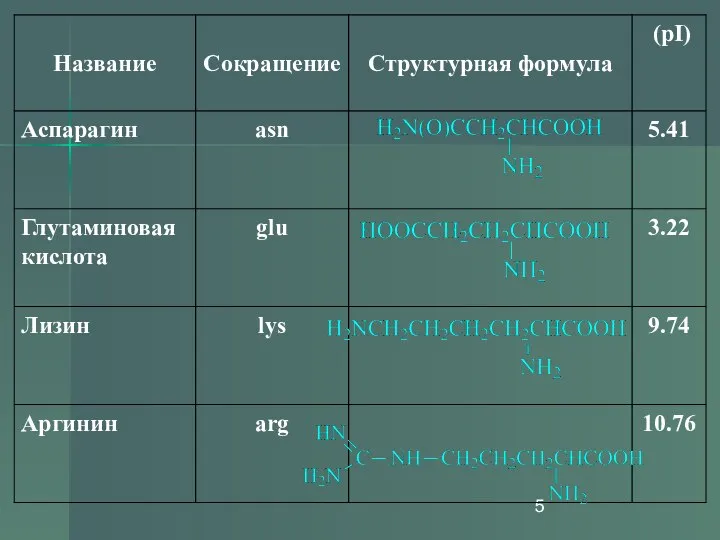
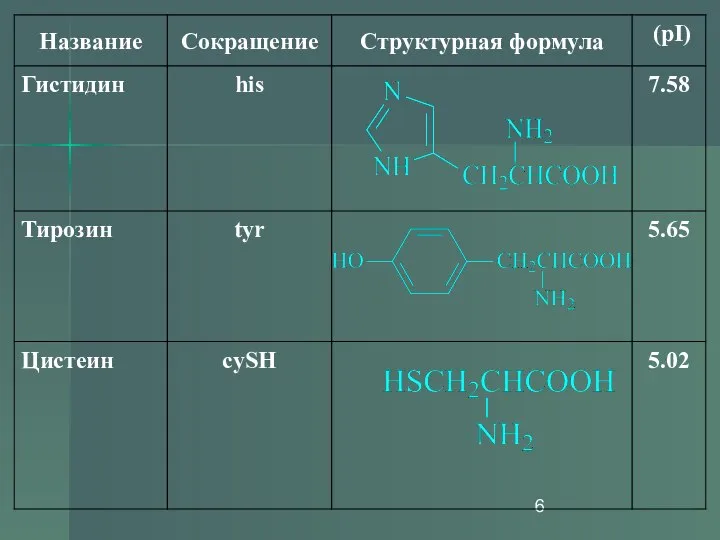
- 13. Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое значение pH, имеющее определенное значение для каждой аминокислоты, при
- 14. Способы получения аминокислот Аминирование α-галогензамещенных кислот
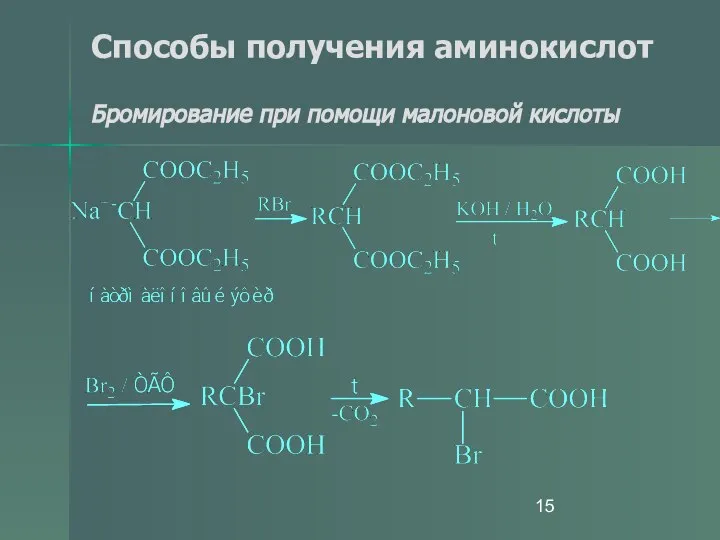
- 15. Способы получения аминокислот Бромирование при помощи малоновой кислоты
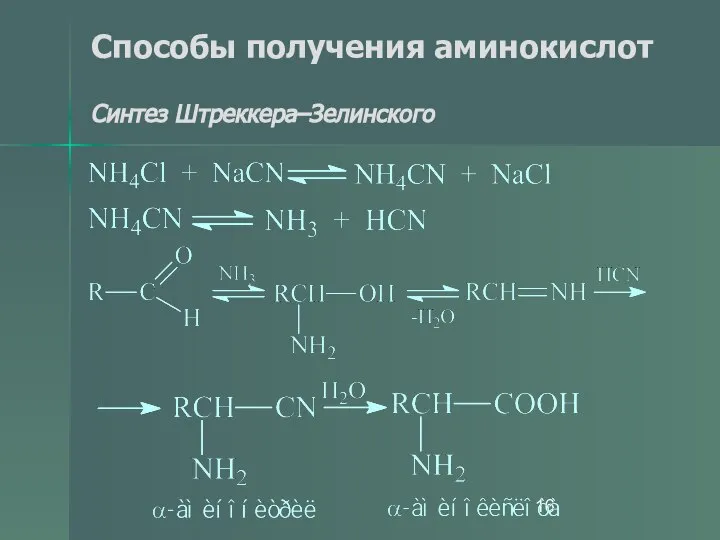
- 16. Способы получения аминокислот Синтез Штреккера–Зелинского
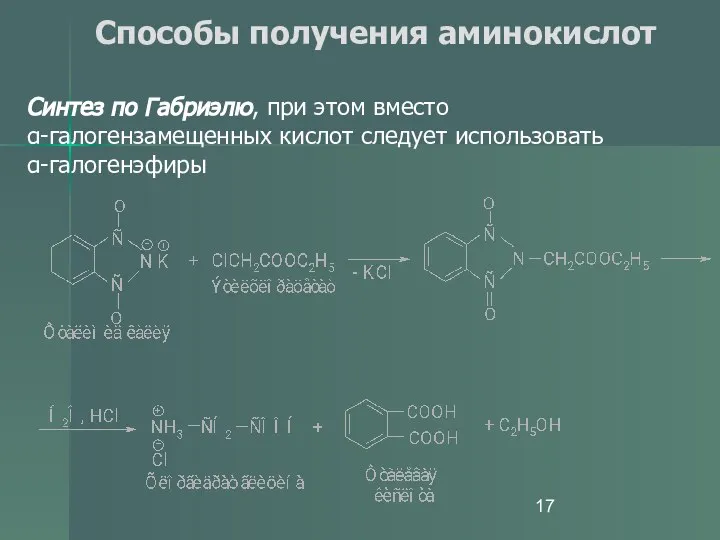
- 17. Способы получения аминокислот Синтез по Габриэлю, при этом вместо α-галогензамещенных кислот следует использовать α-галогенэфиры
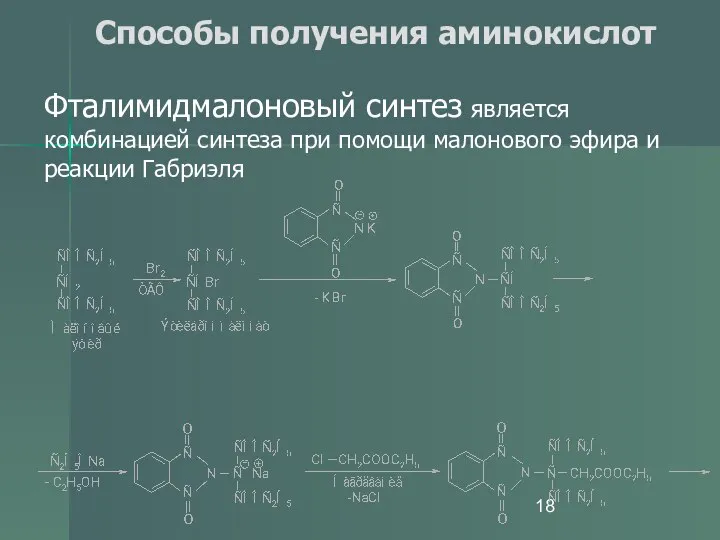
- 18. Способы получения аминокислот Фталимидмалоновый синтез является комбинацией синтеза при помощи малонового эфира и реакции Габриэля
- 19. Способы получения аминокислот Фталимидмалоновый синтез Все эти методы синтеза приводят к получению рацемической смеси энантиомеров α-аминокислот
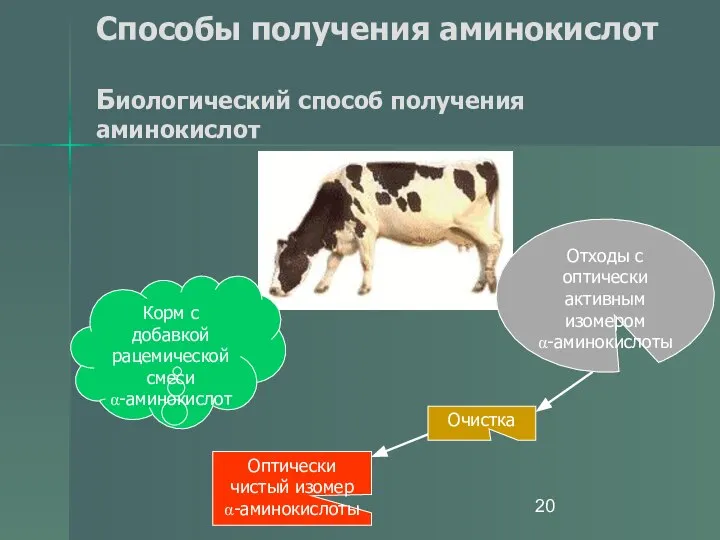
- 20. Способы получения аминокислот Биологический способ получения аминокислот Корм с добавкой рацемической смеси α-аминокислот Отходы с оптически
- 21. Химические свойства аминокислот Реакции по аминогруппе Метод Ван-Слайка
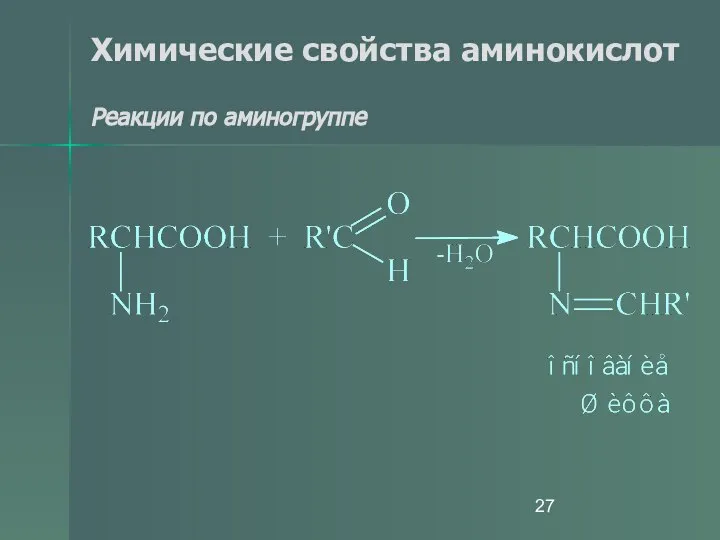
- 22. Химические свойства аминокислот Реакции по аминогруппе Аминокислоты могут быть проалкилированы по аминогруппе
- 23. Химические свойства аминокислот Реакции по аминогруппе Ацилирование аминокислот по аминогруппе протекает достаточно легко
- 24. Химические свойства аминокислот Реакции по аминогруппе Получение N-ацильных производных используют как метод защиты аминогруппы при проведении
- 25. Химические свойства аминокислот Реакции по аминогруппе После проведения реакции по карбоксильной группе блокирующую группу удаляют гидрированием
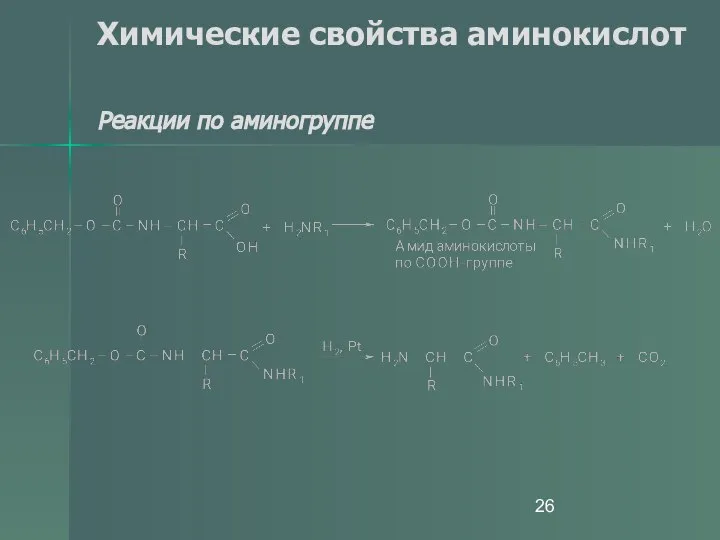
- 26. Химические свойства аминокислот Реакции по аминогруппе
- 27. Химические свойства аминокислот Реакции по аминогруппе
- 28. Химические свойства аминокислот Реакции карбоксильной группы
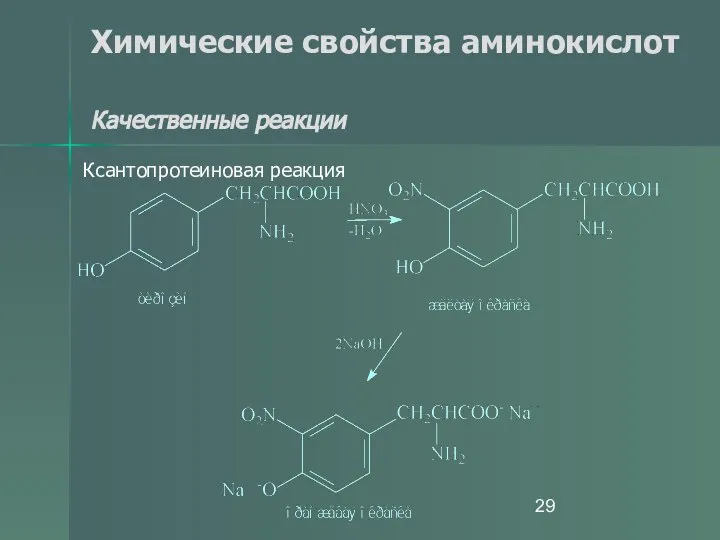
- 29. Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
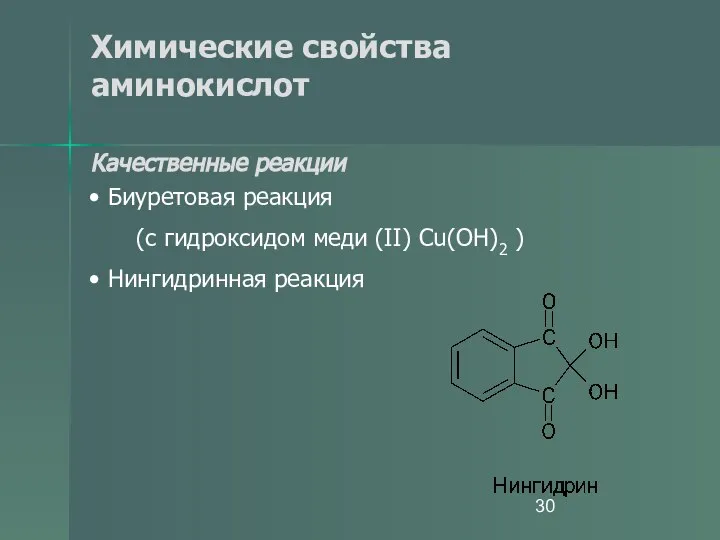
- 30. Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
- 31. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции α-аминокислот Поведение α-, β-аминокислот также аналогично поведению α-, β-оксикислот.
- 32. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции β-аминокислот
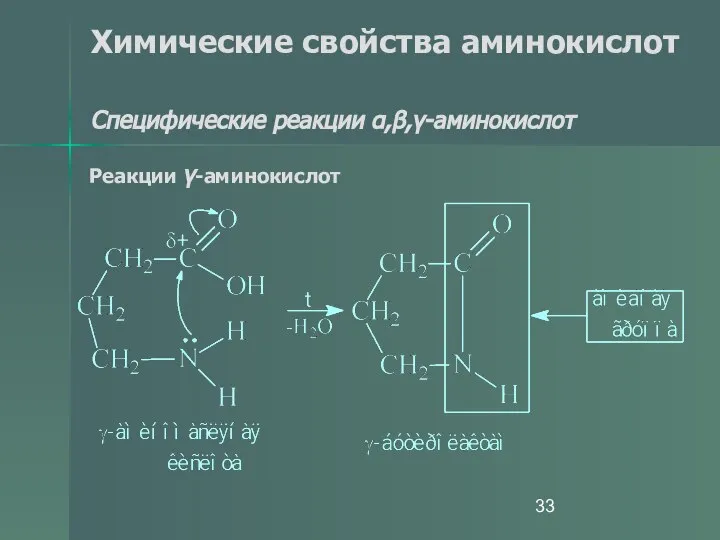
- 33. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции γ-аминокислот
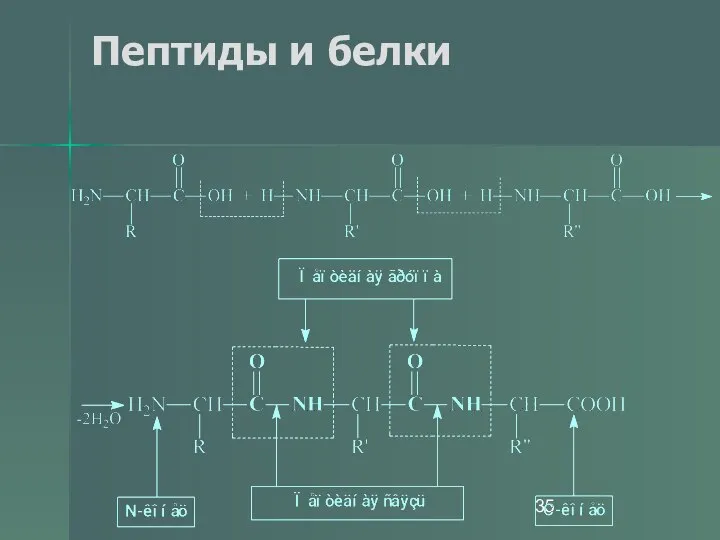
- 34. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
- 35. Пептиды и белки
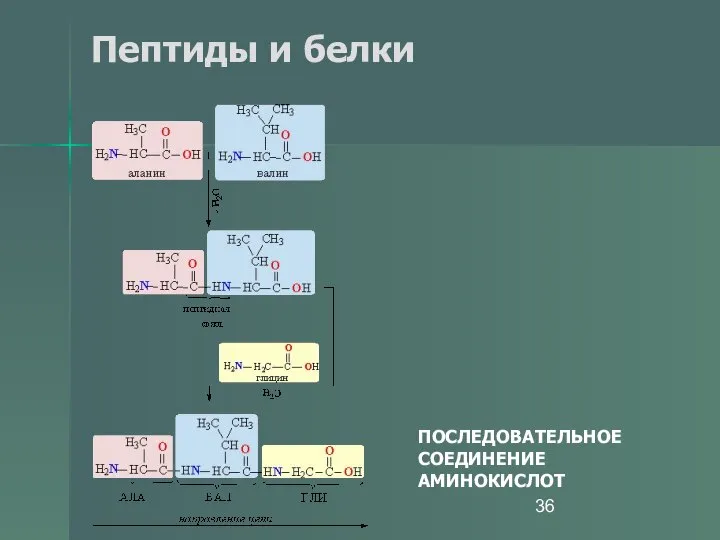
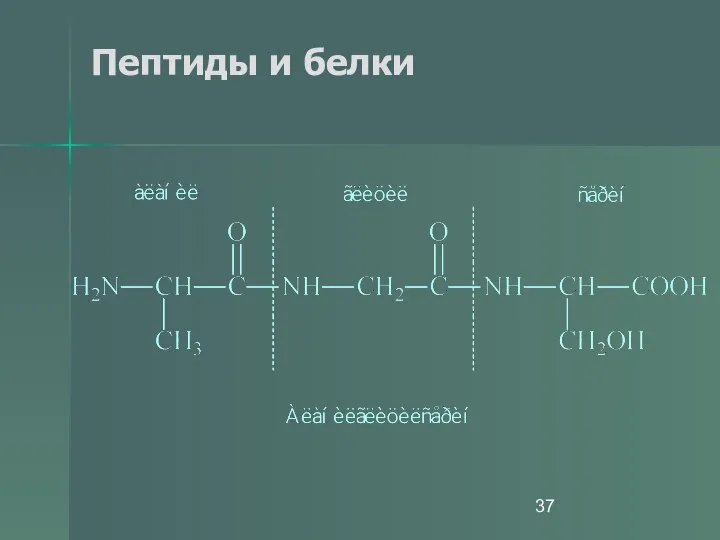
- 36. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
- 37. Пептиды и белки
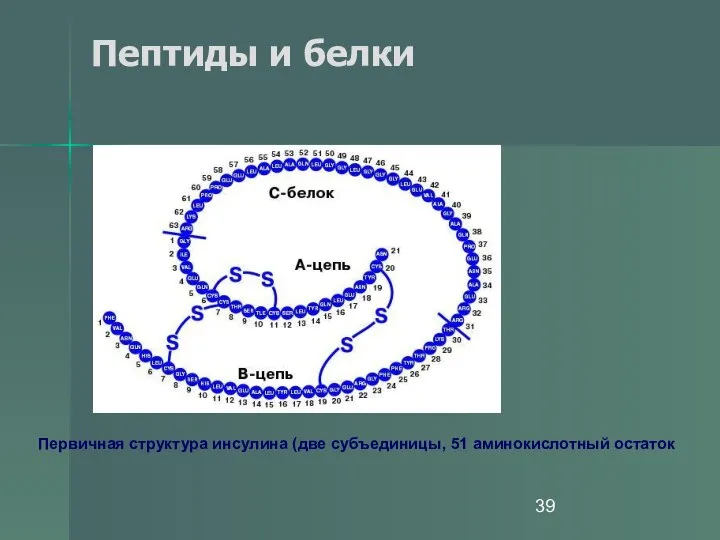
- 38. Пептиды и белки Первичная структура белка инсулина.
- 39. Пептиды и белки
- 40. Пептиды и белки Структура белков Первичная структура пептидов и белков — это последовательность аминокислотных остатков в
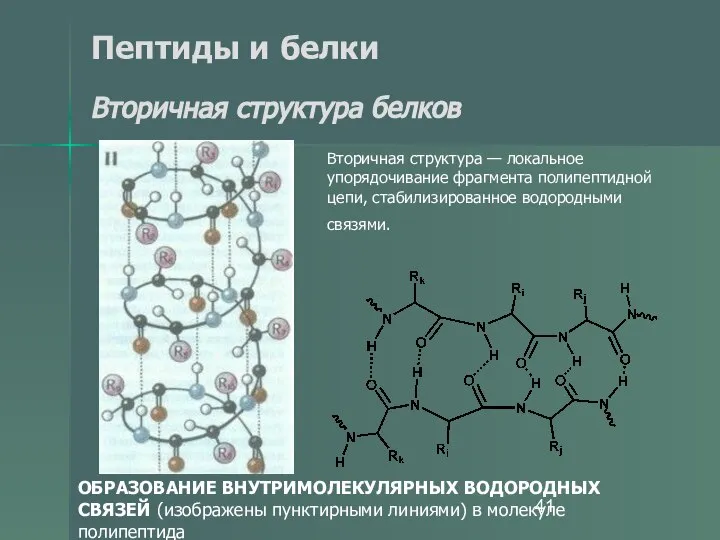
- 41. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
- 42. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
- 43. Пептиды и белки Вторичная структура белков Вторичная структура белка — это более высокий уровень структурной организации,
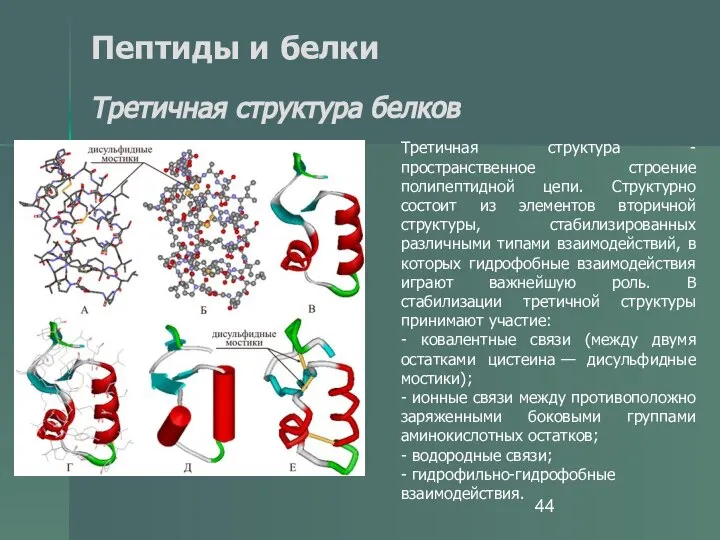
- 44. Пептиды и белки Третичная структура белков Третичная структура - пространственное строение полипептидной цепи. Структурно состоит из
- 45. Пептиды и белки Третичная структура белков
- 46. Пептиды и белки Глобулярные белки ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА (белок куриного яйца). В структуре помимо дисульфидных мостиков
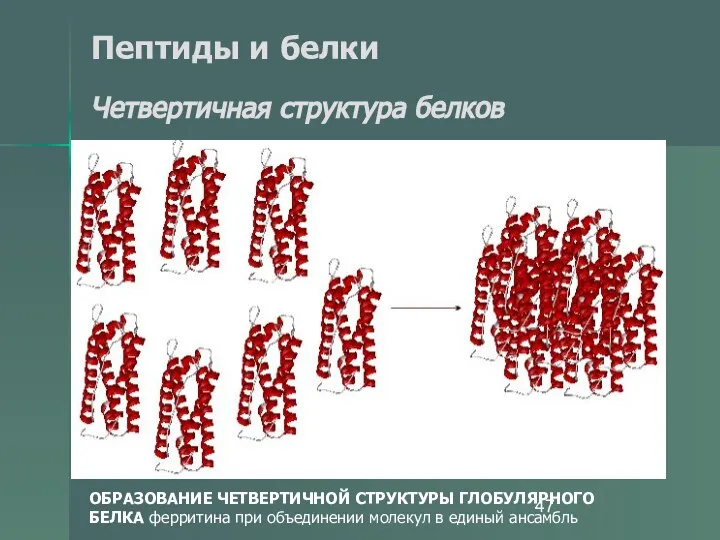
- 47. Пептиды и белки Четвертичная структура белков ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ферритина при объединении молекул в
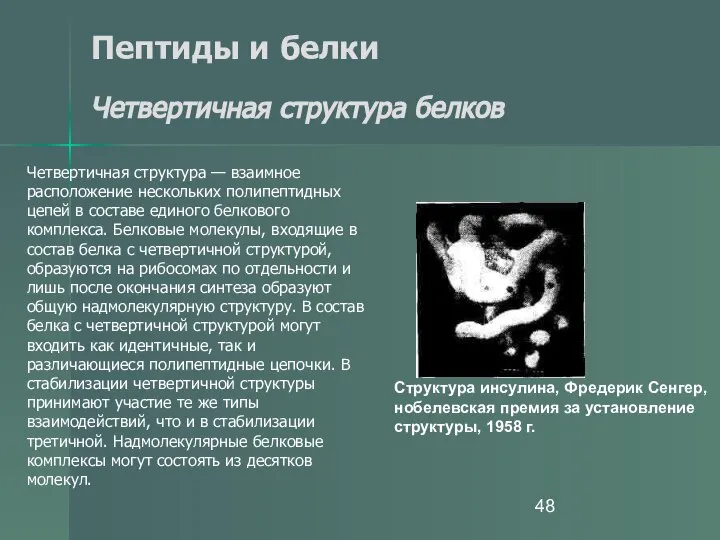
- 48. Пептиды и белки Четвертичная структура белков Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе
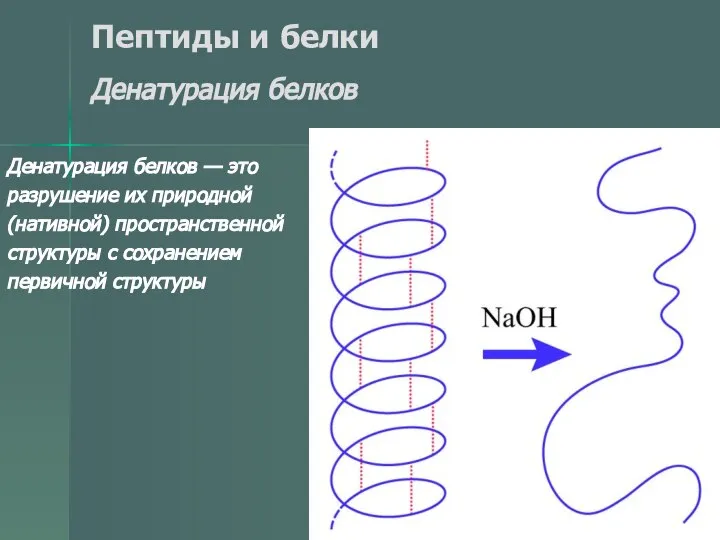
- 49. Пептиды и белки Денатурация белков Денатурация белков — это разрушение их природной (нативной) пространственной структуры с
- 51. Скачать презентацию

























 Программирование на языке Си. Переменные. Ввод и вывод. Ветвления. Сложные условия. Циклы с условием
Программирование на языке Си. Переменные. Ввод и вывод. Ветвления. Сложные условия. Циклы с условием СвОЯ ИГРА ЗЕМЛЯ и ЧЕЛОВЕЧЕСТВО Семенова Л.Г., учитель начальных классов, ГБОУ СОШ № 1176, Москва, 2013
СвОЯ ИГРА ЗЕМЛЯ и ЧЕЛОВЕЧЕСТВО Семенова Л.Г., учитель начальных классов, ГБОУ СОШ № 1176, Москва, 2013 Кто он, современный подросток? Отдел психолого-педагогического Сопровождения Центра «Созвездие» 2010г.
Кто он, современный подросток? Отдел психолого-педагогического Сопровождения Центра «Созвездие» 2010г. Безналичные расчеты
Безналичные расчеты Устройство компьютера
Устройство компьютера Презентация "Отелло" - скачать презентации по МХК
Презентация "Отелло" - скачать презентации по МХК fjtyjtyjty - презентация по Алгебре
fjtyjtyjty - презентация по Алгебре знай и люби природу родного края - презентация для начальной школы
знай и люби природу родного края - презентация для начальной школы Презентация "Портфолио" - скачать презентации по Педагогике
Презентация "Портфолио" - скачать презентации по Педагогике Координатная плоскость
Координатная плоскость Проблема війни та миру
Проблема війни та миру Благоустройство и озеленение сквера имени Дзержинского
Благоустройство и озеленение сквера имени Дзержинского Производные нафтохинона – витамины группы К. Синтетический аналог – викасол. Требования к качеству, методы анализа
Производные нафтохинона – витамины группы К. Синтетический аналог – викасол. Требования к качеству, методы анализа Принципы решения неструктурированных проблем
Принципы решения неструктурированных проблем WINK – новый интерфейс на STB
WINK – новый интерфейс на STB Фольклор городских праздничных зрелищ. Русская ярмарка
Фольклор городских праздничных зрелищ. Русская ярмарка Двухфакторный подход Бихевиористический подход и теории научающего бихевиоризма (социального научения)
Двухфакторный подход Бихевиористический подход и теории научающего бихевиоризма (социального научения) Уборка. Как быстро убраться в квартире\комнате
Уборка. Как быстро убраться в квартире\комнате Инструменты для обработки зубчатых колес
Инструменты для обработки зубчатых колес Микеланджело Буонарроти - краткая биография и картины
Микеланджело Буонарроти - краткая биография и картины Проект “Телемост” Россия и США
Проект “Телемост” Россия и США Логарифмические уравнения - презентация по Алгебре_
Логарифмические уравнения - презентация по Алгебре_ Ислам. Основные идеи ислама
Ислам. Основные идеи ислама Кроссворд по экономическому потенциалу таможенной территории России Выполнила студентка первого курса Группы Т-116 Хропина Ольг
Кроссворд по экономическому потенциалу таможенной территории России Выполнила студентка первого курса Группы Т-116 Хропина Ольг Системы счисления. Игра футбол
Системы счисления. Игра футбол Постановка, формализация и разработка алгоритма и программы определения соответствия данных в таблице Excel с данными в файлах
Постановка, формализация и разработка алгоритма и программы определения соответствия данных в таблице Excel с данными в файлах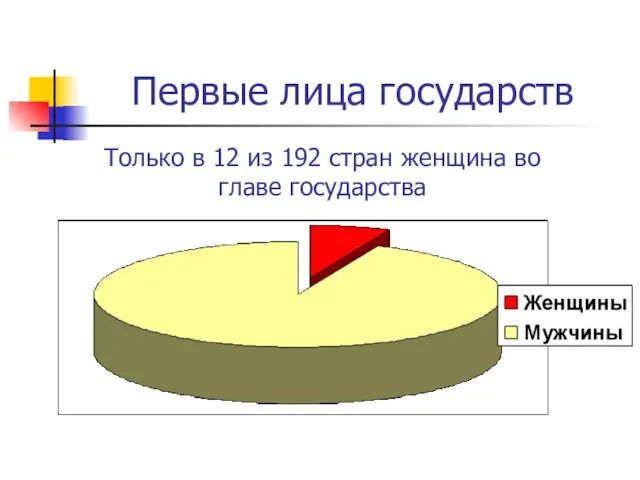 Первые лица государств
Первые лица государств Wien ist die Hauptstadt Österreichs
Wien ist die Hauptstadt Österreichs