Содержание
- 2. Рекомендуемая литература 1. Травень, В.Ф. Органическая химия: Учебник для вузов в 2-х томах. – М.: Академкнига,
- 3. Перечень пособий, методических указаний к проведению учебных занятий и самостоятельной работы студентов Углеводороды. Галогенпроизводные углеводородов. Учебное
- 4. Дополнительная литература Органикум (практикум по органической химии) т.1 и т.2 "Мир",1980 г. А.А.Терней, Современная органическая химия,
- 5. СТРУКТУРА КУРСА 2 семестр Лекции 26 ч Лабораторные занятия 58 ч Самостоятельная работа 96 Расчетно-графическое задание
- 6. Галогенпроизводные углеводородов
- 7. Галогенпроизводные углеводородов Галогенопроизводными называются производные углеводородов, в которых один или несколько атомов водорода заменены атомами галогена.
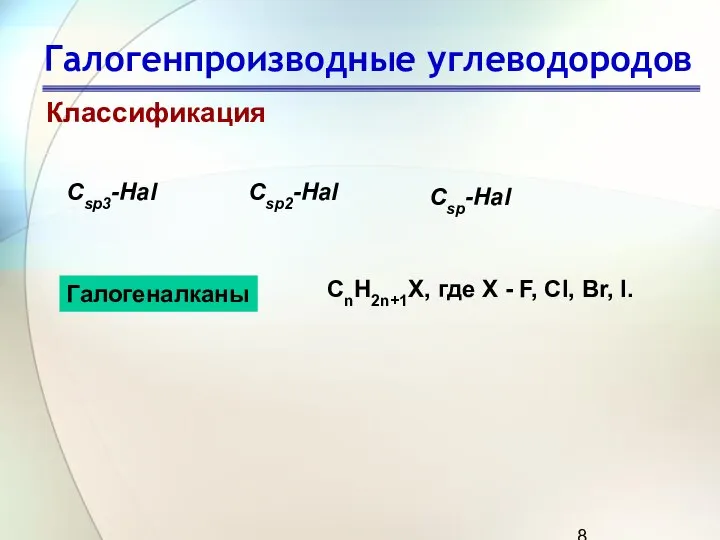
- 8. Галогенпроизводные углеводородов Классификация Сsp3-Hal Сsp2-Hal Сsp-Hal СnH2n+1Х, где X - F, Cl, Br, I. Галогеналканы
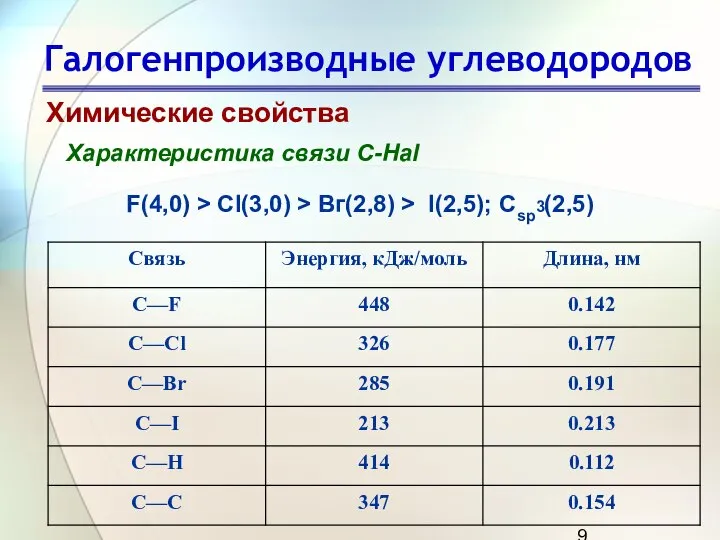
- 9. Галогенпроизводные углеводородов Химические свойства Характеристика связи C-Hal F(4,0) > Сl(3,0) > Вг(2,8) > I(2,5); Сsp3(2,5)
- 10. Галогенпроизводные углеводородов Химические свойства Характеристика связи C-Hal
- 11. Галогенпроизводные углеводородов Химические свойства Характеристика связи C-Hal Вследствие высокой электроотрицательности галогена связь галоген - углерод является
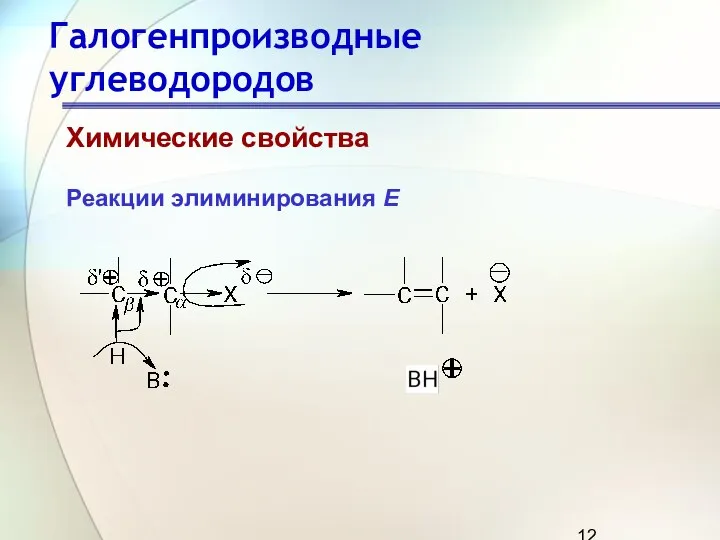
- 12. Галогенпроизводные углеводородов Химические свойства Реакции элиминирования Е
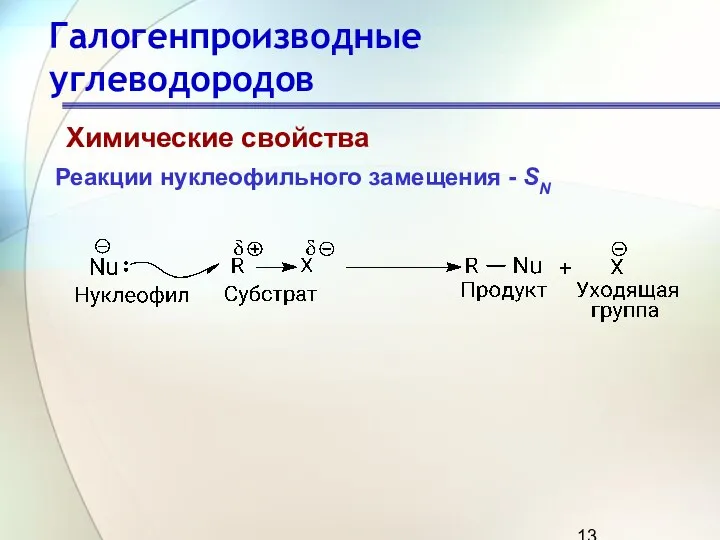
- 13. Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения - SN
- 14. Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения Реакции, в результате которых в молекуле исходного соединения происходит
- 15. Галогенпроизводные улеводородов Реакции нуклеофильного замещения
- 16. Галогенпроизводные улеводородов Реакции нуклеофильного замещения
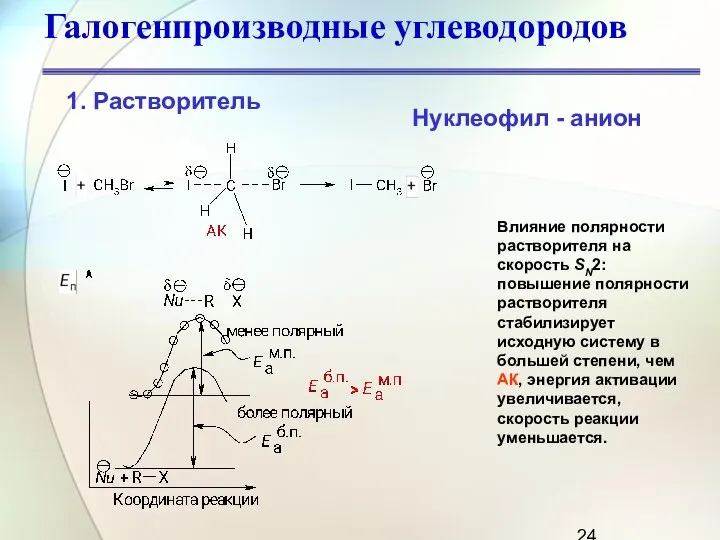
- 17. Бимолекулярное нуклеофильное замещение (SN2) Галогенпроизводные углеводородов Скорость реакции. v = k [R-Hal]·[Nu] Концентрация нуклеофильного реагента. Растворитель.
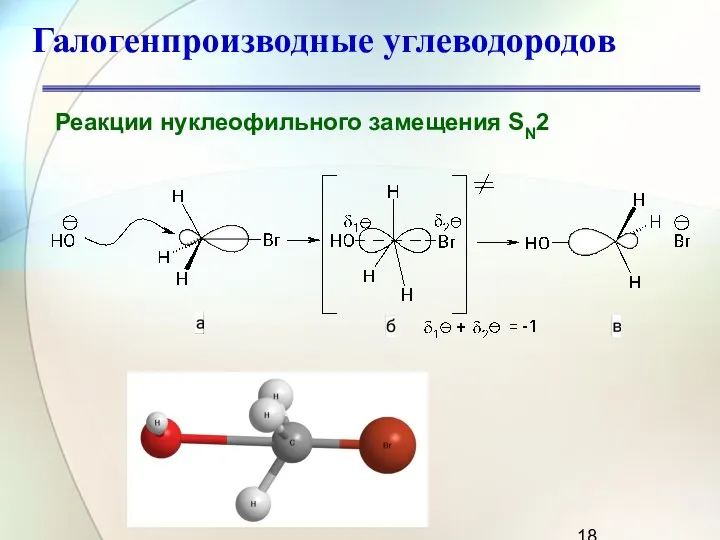
- 18. Галогенпроизводные углеводородов Реакции нуклеофильного замещения SN2
- 19. Галогенпроизводные углеводородов Реакции нуклеофильного замещения SN2 При столкновении реагирующих частиц начинает образовываться связь углерод-кислород, а связь
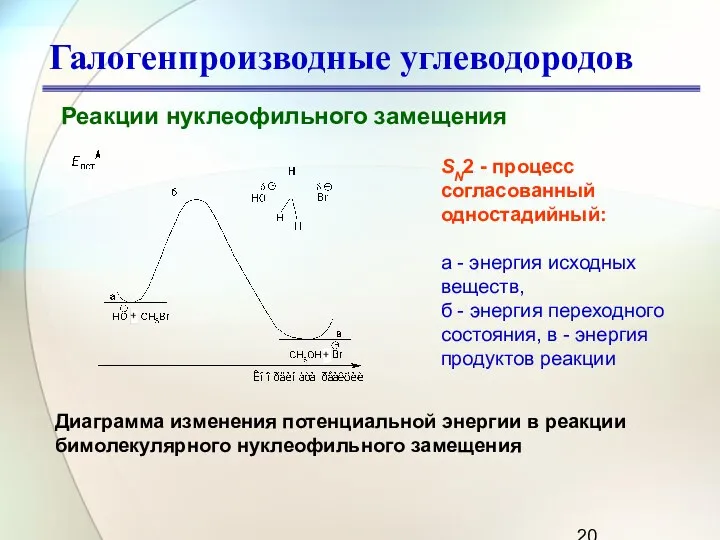
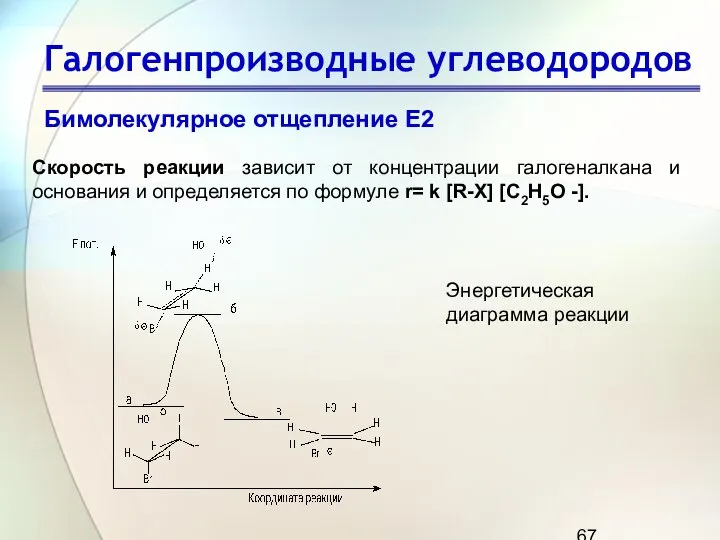
- 20. Галогенпроизводные углеводородов Реакции нуклеофильного замещения Диаграмма изменения потенциальной энергии в реакции бимолекулярного нуклеофильного замещения SN2 -
- 21. Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения Скорость реакции нуклеофильного замещения зависит от следующих факторов: -
- 22. Выбор растворителя диктуется следующими условиями: а) достаточно хорошая растворимость реагентов, б) лучшая сольватация переходного состояния по
- 23. Сольватация состоит в том, что молекула растворенного вещества оказывается окруженной сольватной оболочкой, состоящей из более или
- 24. Галогенпроизводные углеводородов Нуклеофил - анион Влияние полярности растворителя на скорость SN2: повышение полярности растворителя стабилизирует исходную
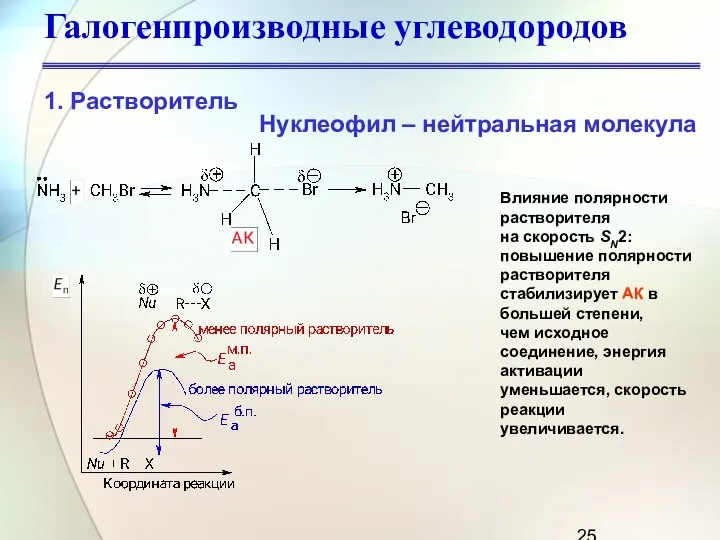
- 25. Галогенпроизводные углеводородов Нуклеофил – нейтральная молекула Влияние полярности растворителя на скорость SN2: повышение полярности растворителя стабилизирует
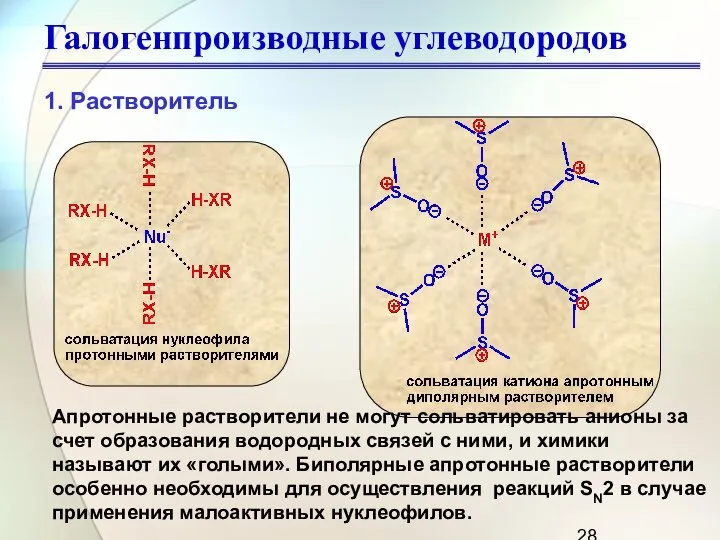
- 26. Апротонные биполярные растворители: растворители с высокой диэлектрической проницаемостью, но не способные к образованию водородных связей Галогенпроизводные
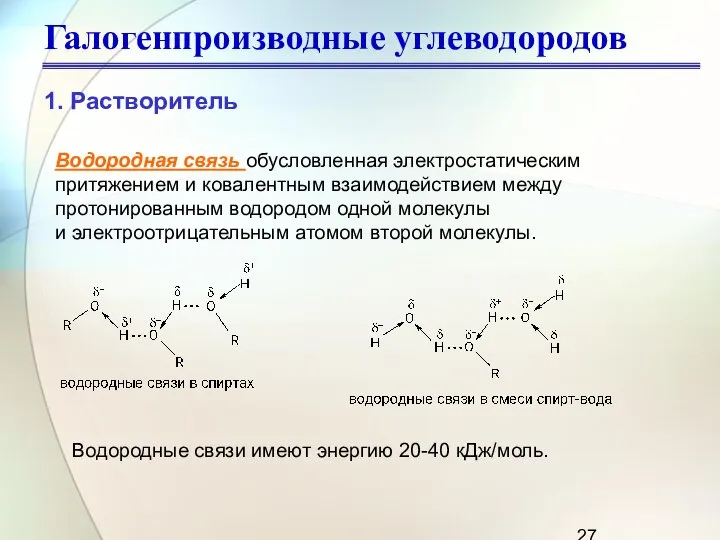
- 27. Водородная связь обусловленная электростатическим притяжением и ковалентным взаимодействием между протонированным водородом одной молекулы и электроотрицательным атомом
- 28. Апротонные растворители не могут сольватировать анионы за счет образования водородных связей с ними, и химики называют
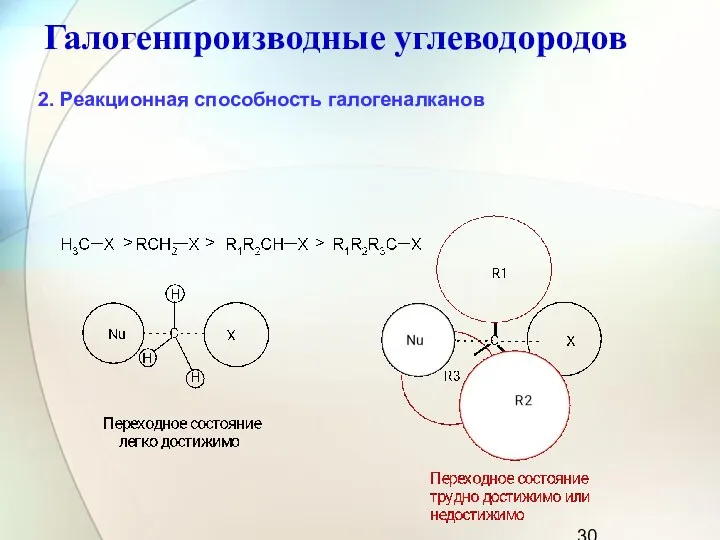
- 29. Галогенпроизводные углеводородов 2. Реакционная способность галогеналканов При рассмотрении реакционной способности галогеналканов в реакциях нуклеофильного замещения следует
- 30. Галогенпроизводные углеводородов 2. Реакционная способность галогеналканов
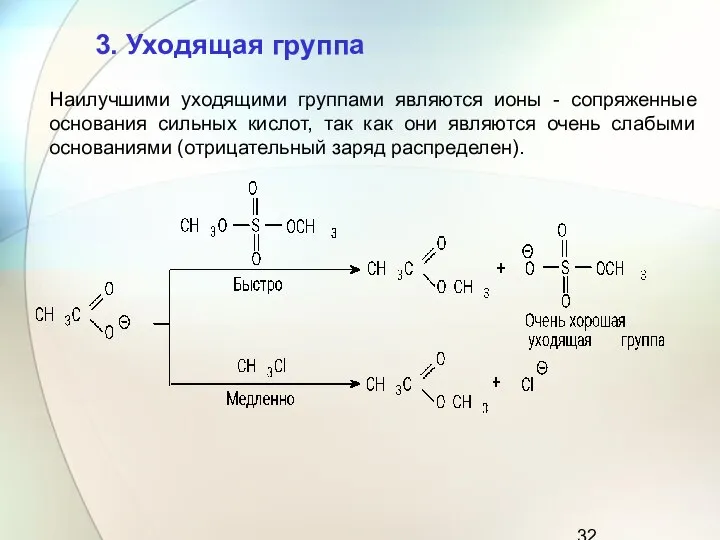
- 31. Сильные основания являются обычно «плохими» уходящими группами, слабые основания – «хорошими» уходящими группами. Наилучшими уходящими группами
- 32. Наилучшими уходящими группами являются ионы - сопряженные основания сильных кислот, так как они являются очень слабыми
- 33. Галогенпроизводные углеводородов Под нуклеофильной реакционной способностью (нуклеофильной силой) принято понимать способность реагента (аниона или нейтральной молекулы)
- 34. Под основностью понимают способность основания (нуклеофила) связываться с протоном, т.е. сродство нуклеофила к протону. Под нуклеофильностью
- 35. Обычно, чем выше основность, тем выше нуклеофильность. Так, нуклеофильность уменьшается с уменьшением основности в рядах 4.
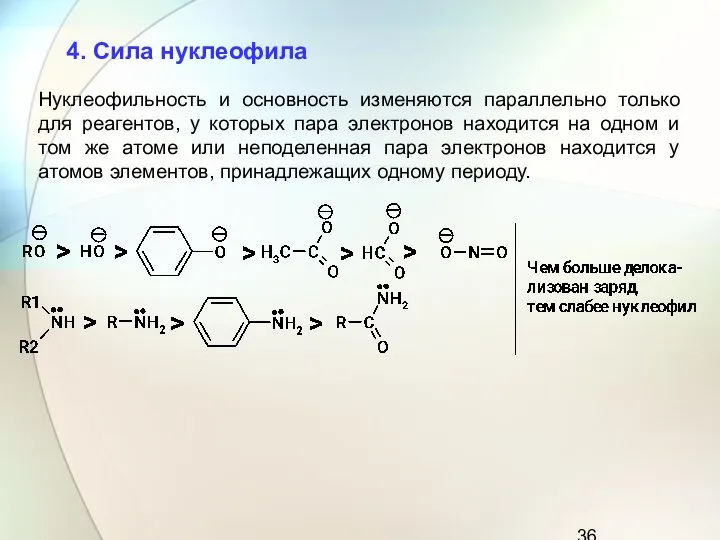
- 36. Нуклеофильность и основность изменяются параллельно только для реагентов, у которых пара электронов находится на одном и
- 37. Легкополяризуемые ионы, слабее удерживающие электроны на внешней электронной оболочке, обладают высокой нуклеофильностью и в ионизирующих протонных
- 38. Однако в протонных растворителях этот ряд инвертируется: нуклеофильность аниона тем выше, чем больше размер иона. Такой
- 39. Нуклеофильность некоторых реагентов 4. Сила нуклеофила
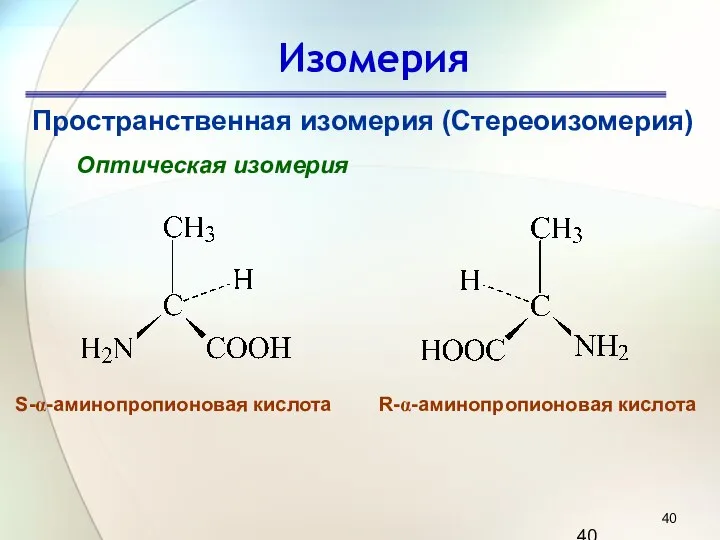
- 40. Изомерия Пространственная изомерия (Стереоизомерия) Оптическая изомерия S-α-аминопропионовая кислота R-α-аминопропионовая кислота
- 41. Изомерия Пространственная изомерия (Стереоизомерия) Оптическая изомерия S-α-аминопропионовая кислота R-α-аминопропионовая кислота Изомерия — одно из наиболее своеобразных
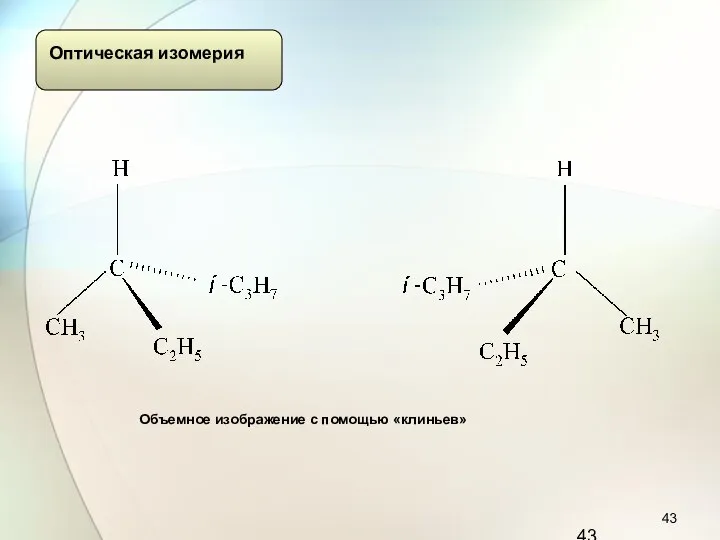
- 42. Изомерия Два соединения: предмет и его зеркальное изображение (I и II), несовместимые друг с другом, называются
- 43. Объемное изображение с помощью «клиньев»
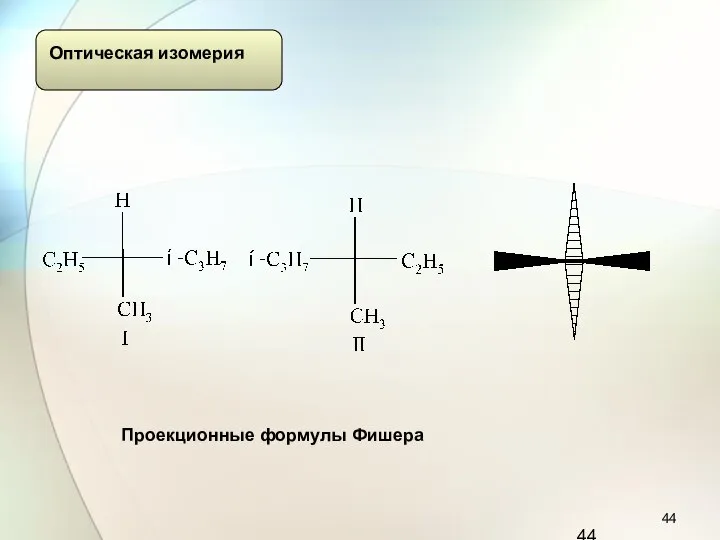
- 44. Проекционные формулы Фишера
- 45. Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного света. Энантиомеры вращают плоскость поляризованного света
- 46. 2. Атомная масса 3. Если у ближайшего атома показатели совпадают, то смотрят на следующий 4. Кратные
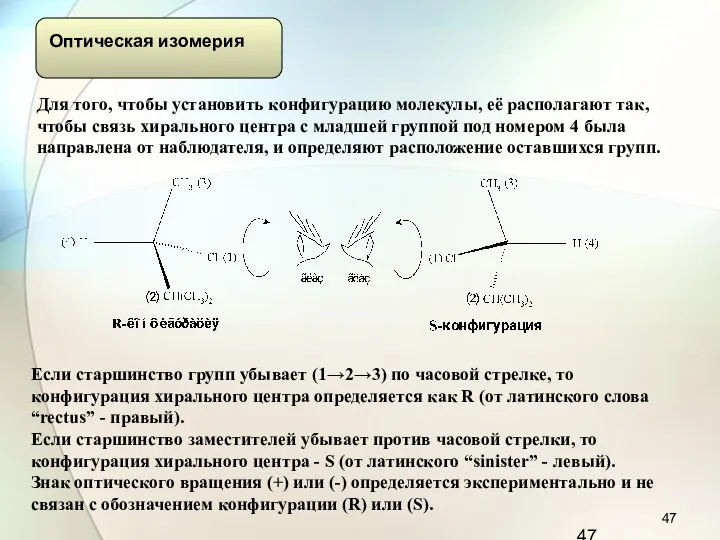
- 47. Для того, чтобы установить конфигурацию молекулы, её располагают так, чтобы связь хирального центра с младшей группой
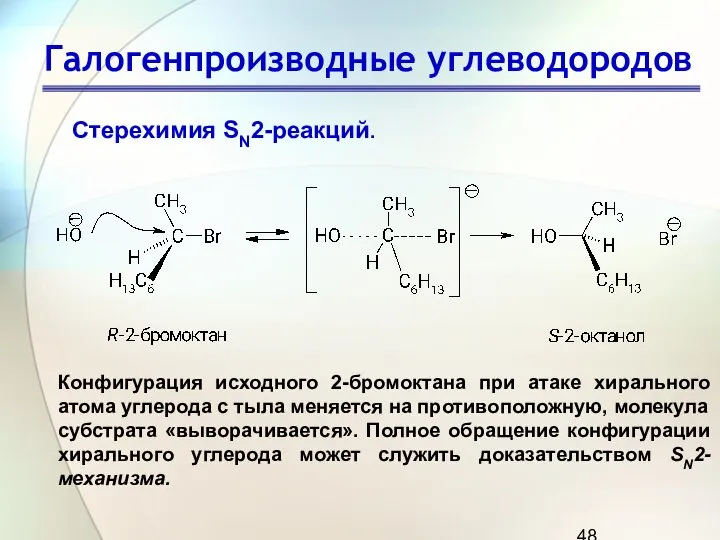
- 48. Галогенпроизводные углеводородов Конфигурация исходного 2-бромоктана при атаке хирального атома углерода с тыла меняется на противоположную, молекула
- 49. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Скорость реакции. В медленной стадии, определяющей скорость реакции, принимает участие
- 50. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Cтадии процесса. Реакция протекает в две стадии. Первая стадия -
- 51. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Вторая стадия - образовавшийся карбокатион практически мгновенно взаимодействует с нуклеофилом
- 52. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Энергетическая диаграмма реакции изображает изменение потенциальной энергии в ходе двух
- 53. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Перегруппировка. В медленной стадии реакции образуется карбокатион - частица, способная
- 54. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Растворитель. Переходное состояние SN1-реакции более полярно, чем исходное состояние. Увеличение
- 55. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Растворитель. При проведении SN1-реакции используют протонные растворители с высокой диэлектрической
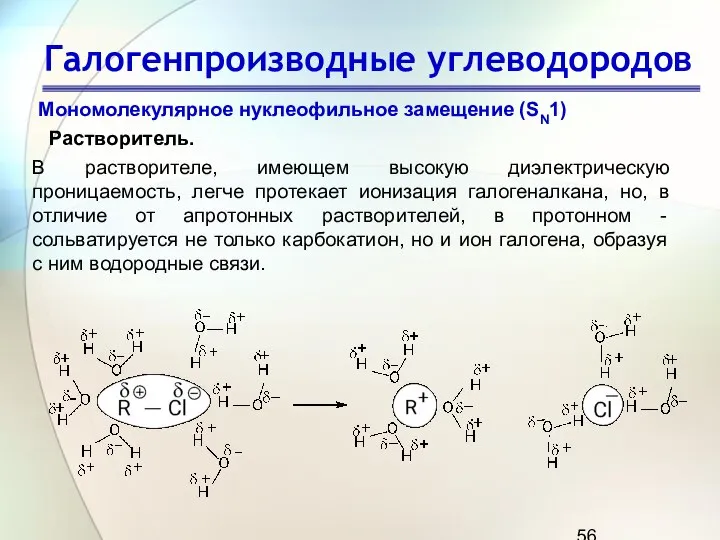
- 56. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Растворитель. В растворителе, имеющем высокую диэлектрическую проницаемость, легче протекает ионизация
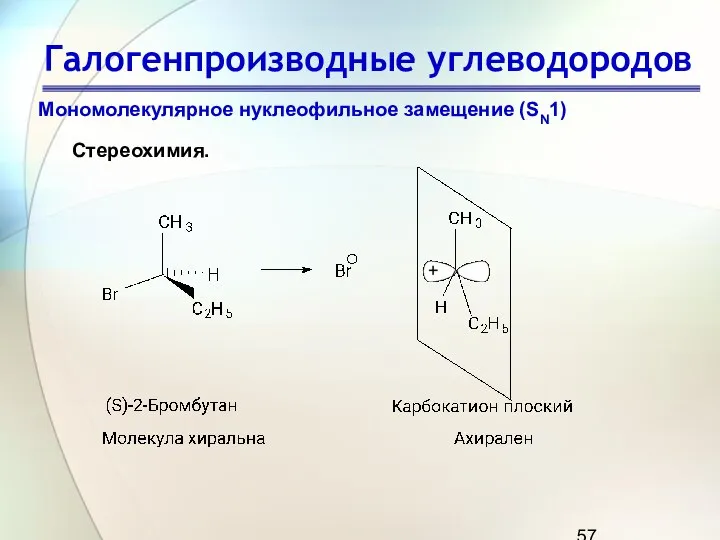
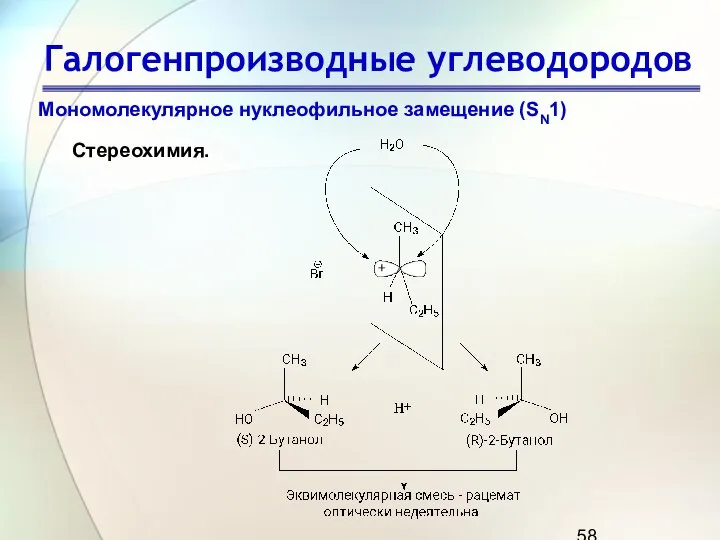
- 57. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Стереохимия.
- 58. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Стереохимия.
- 59. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Формирование карбокатиона в реакции SN1 происходит через образование нескольких форм
- 60. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Нуклеофил может взаимодействовать с любой из приведенных частиц. При взаимодейсивии
- 61. Галогенпроизводные углеводородов Мономолекулярное нуклеофильное замещение (SN1) Реакционная способность. Главным фактором, определяющим реакционную способность в SN1-реакции, является
- 62. Галогенпроизводные углеводородов Реакции нуклеофильного замещения
- 63. Галогенпроизводные углеводородов Реакции нуклеофильного замещения Влияние условий реакции на соотношение двух механизмов.
- 64. Галогенпроизводные углеводородов Химические свойства Реакции элиминирования Под влиянием электроотрицательного галогена связанный с ним атом углерода (Сα)
- 65. Галогенпроизводные углеводородов Реакции элиминирования В ходе реакции элиминирования от молекулы галогеналкана отщепляются два фрагмента: ион галогена(
- 66. Галогенпроизводные углеводородов Бимолекулярное отщепление Е2 Основание С2Н5О атакует атом водорода при Сβ, подает ему пару электронов
- 67. Галогенпроизводные углеводородов Бимолекулярное отщепление Е2 Cкорость реакции зависит от концентрации галогеналкана и основания и определяется по
- 68. Галогенпроизводные углеводородов Бимолекулярное отщепление Е2 Для проведения реакции Е2 требуются сильные основания. В ряду оснований их
- 69. Галогенпроизводные углеводородов Бимолекулярное отщепление Е2 В галогеналкане R-X cкорость отщепления возрастает в ряду: I ˉ >
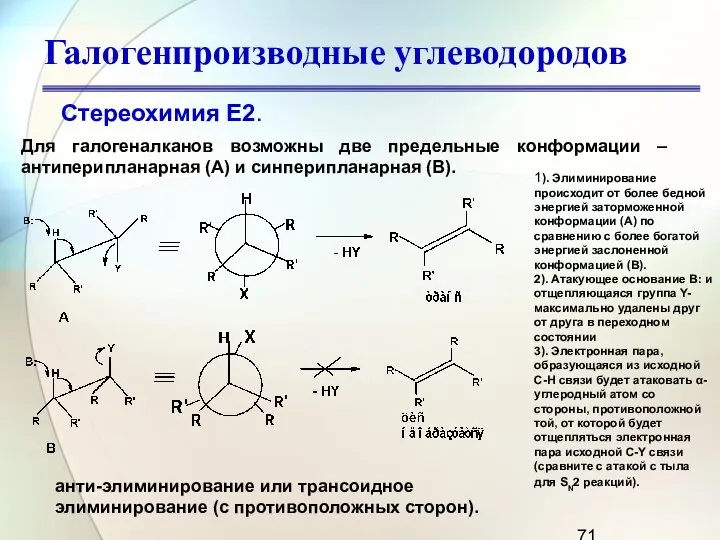
- 70. Галогенпроизводные углеводородов Стереохимия Е2. Связи, разрывающиеся в активированном комплексе реакций Е2, должны быть в транс положении
- 71. Галогенпроизводные углеводородов Стереохимия Е2. Для галогеналканов возможны две предельные конформации – антиперипланарная (А) и синперипланарная (В).
- 72. Галогенпроизводные углеводородов Стереохимия Е2. соотношение цис- и транс-изомеров 1:6
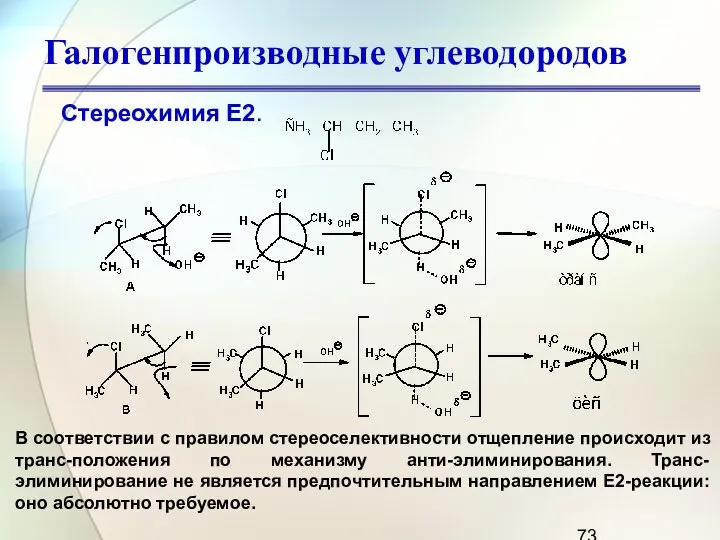
- 73. Галогенпроизводные углеводородов Стереохимия Е2. В соответствии с правилом стереоселективности отщепление происходит из транс-положения по механизму анти-элиминирования.
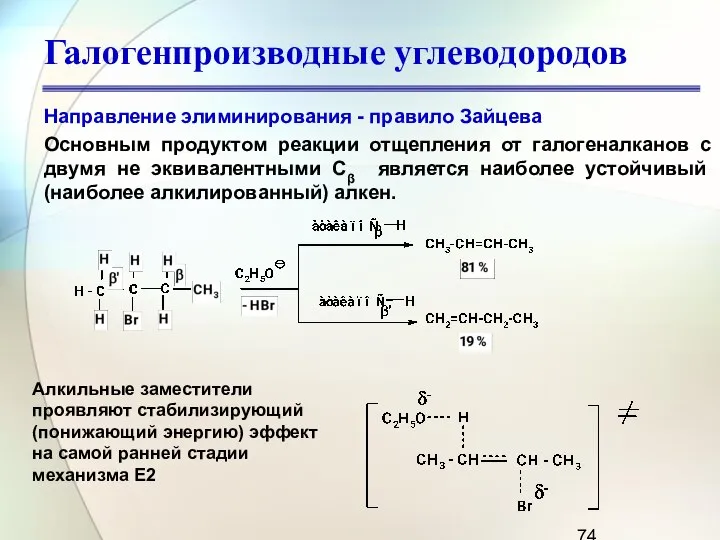
- 74. Галогенпроизводные углеводородов Направление элиминирования - правило Зайцева Основным продуктом реакции отщепления от галогеналканов с двумя не
- 75. Галогенпроизводные углеводородов Александр Михайлович Зайцев 1841 - 1910
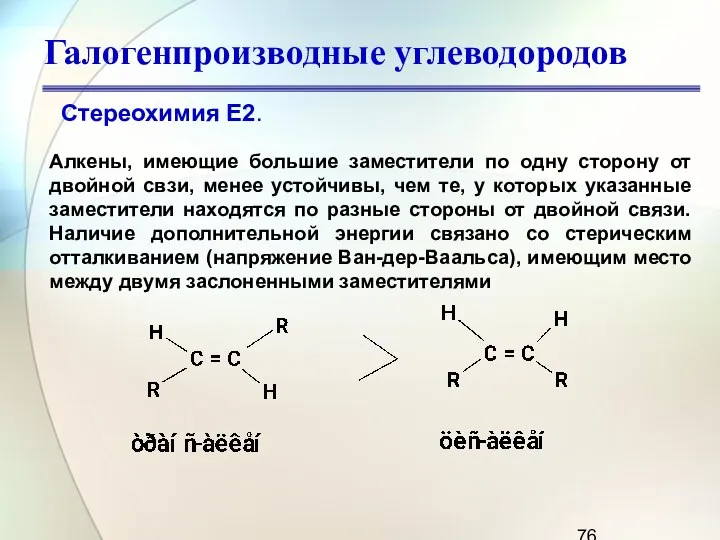
- 76. Галогенпроизводные углеводородов Алкены, имеющие большие заместители по одну сторону от двойной свзи, менее устойчивы, чем те,
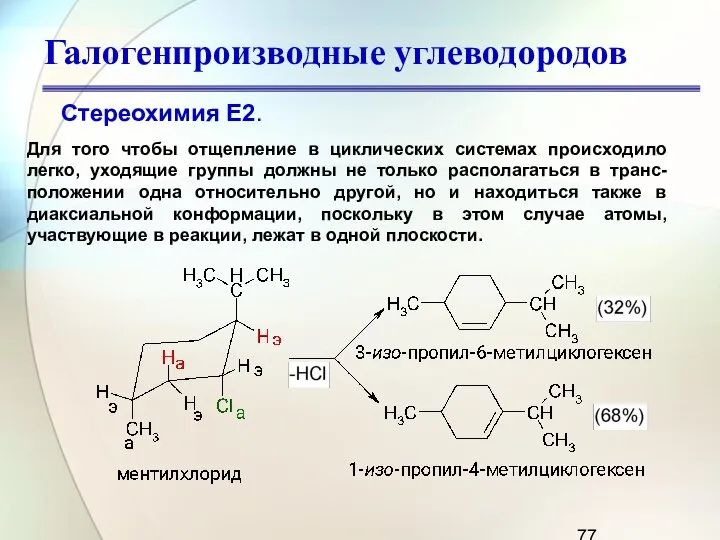
- 77. Галогенпроизводные углеводородов Стереохимия Е2. Для того чтобы отщепление в циклических системах происходило легко, уходящие группы должны
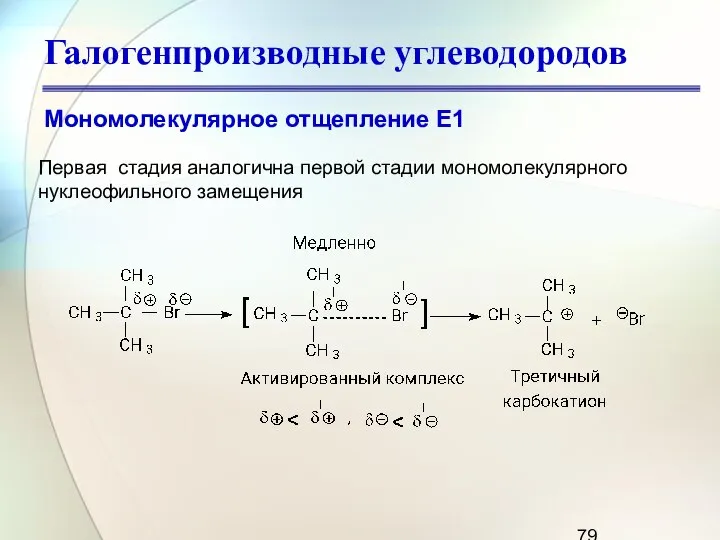
- 78. Галогенпроизводные углеводородов Мономолекулярное отщепление Е1 Третичные галогеналканы реагируют по мономолекулярному механизму.
- 79. Галогенпроизводные углеводородов Мономолекулярное отщепление Е1 Первая стадия аналогична первой стадии мономолекулярного нуклеофильного замещения
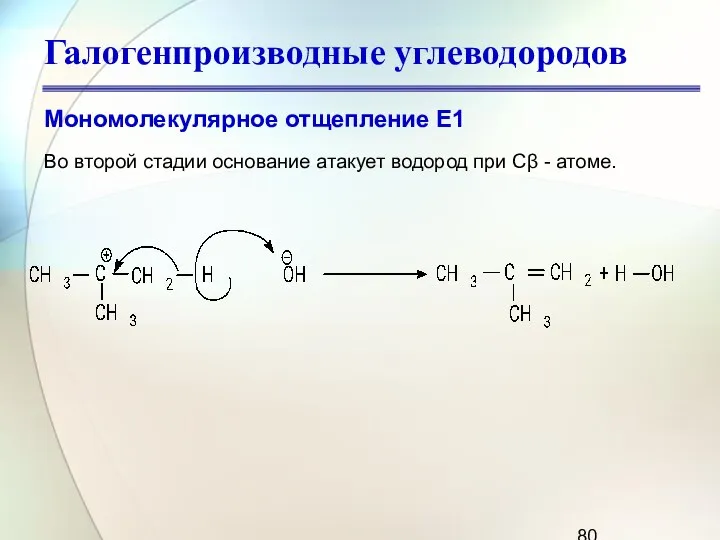
- 80. Галогенпроизводные углеводородов Мономолекулярное отщепление Е1 Во второй стадии основание атакует водород при Сβ - атоме.
- 81. Галогенпроизводные углеводородов Мономолекулярное отщепление Е1 Реакционная способность
- 82. Галогенпроизводные углеводородов Мономолекулярное отщепление Е1 Перегруппировки
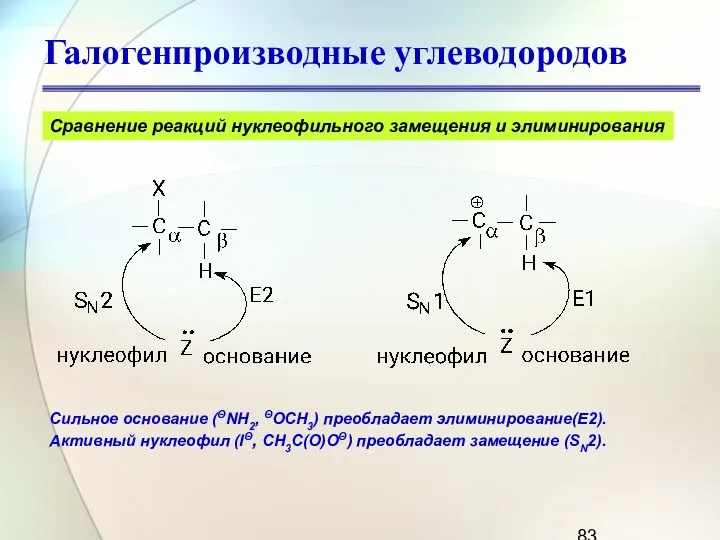
- 83. Галогенпроизводные углеводородов Сравнение реакций нуклеофильного замещения и элиминирования Сильное основание (ΘNH2, ΘOCH3) преобладает элиминирование(Е2). Активный нуклеофил
- 84. Галогенпроизводные углеводородов Сравнение реакций нуклеофильного замещения и элиминирования Реакции элиминирования и нуклеофильного замещения в этом случае
- 85. Галогенпроизводные углеводородов
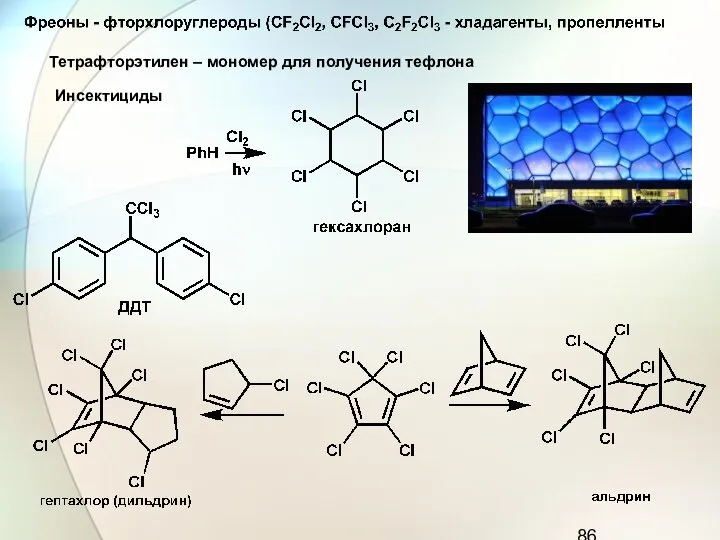
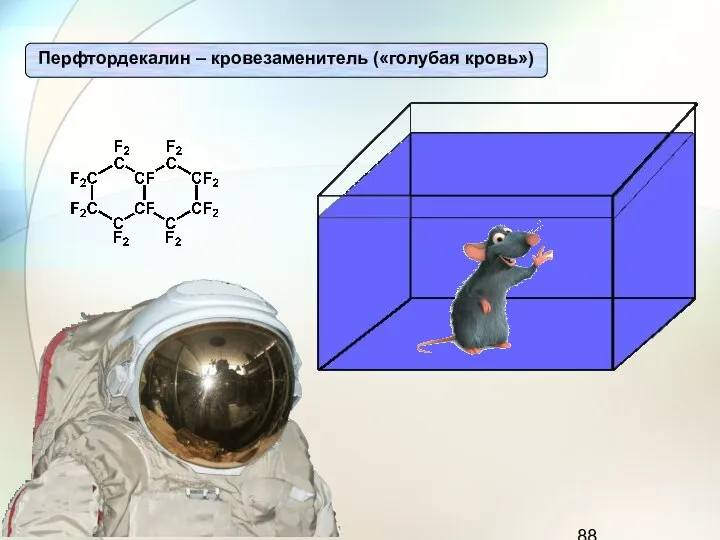
- 86. Тетрафторэтилен – мономер для получения тефлона Инсектициды
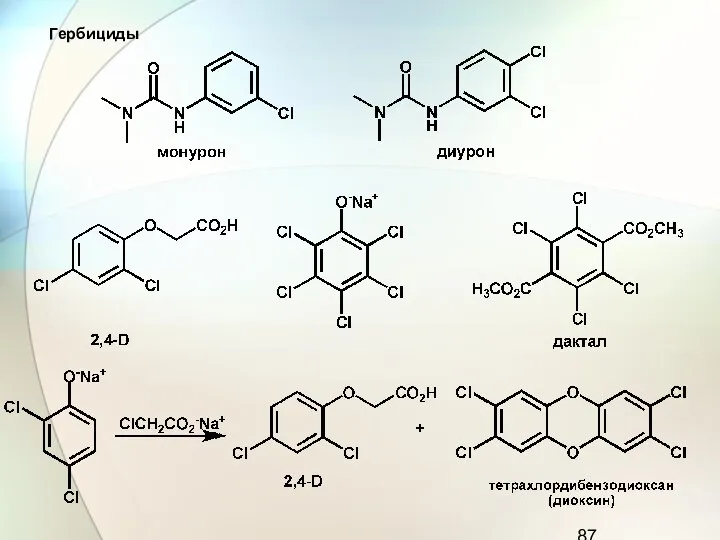
- 87. Гербициды
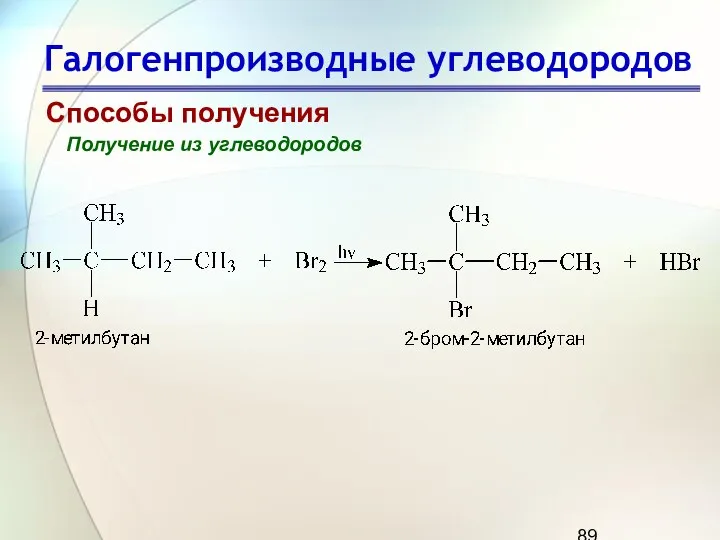
- 89. Галогенпроизводные углеводородов Способы получения Получение из углеводородов
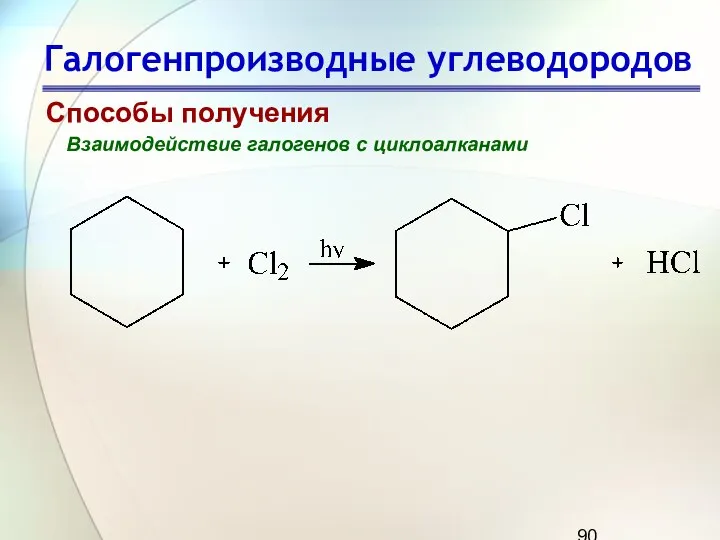
- 90. Галогенпроизводные углеводородов Способы получения Взаимодействие галогенов с циклоалканами
- 91. Галогенпроизводные углеводородов Способы получения Взаимодействие галогенов с алкенами и алкинами
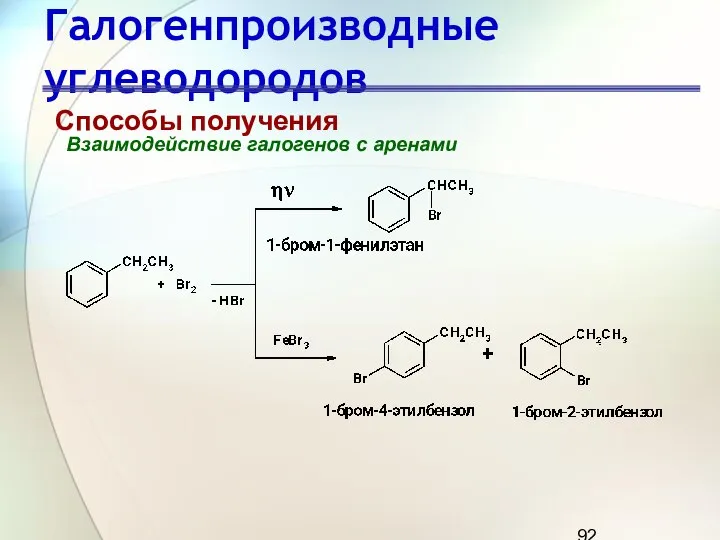
- 92. Галогенпроизводные углеводородов Способы получения Взаимодействие галогенов с аренами
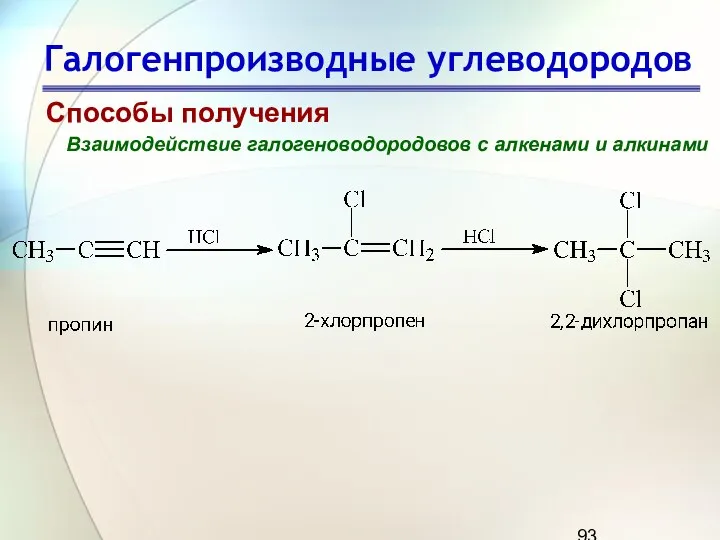
- 93. Галогенпроизводные углеводородов Способы получения Взаимодействие галогеноводородовов с алкенами и алкинами
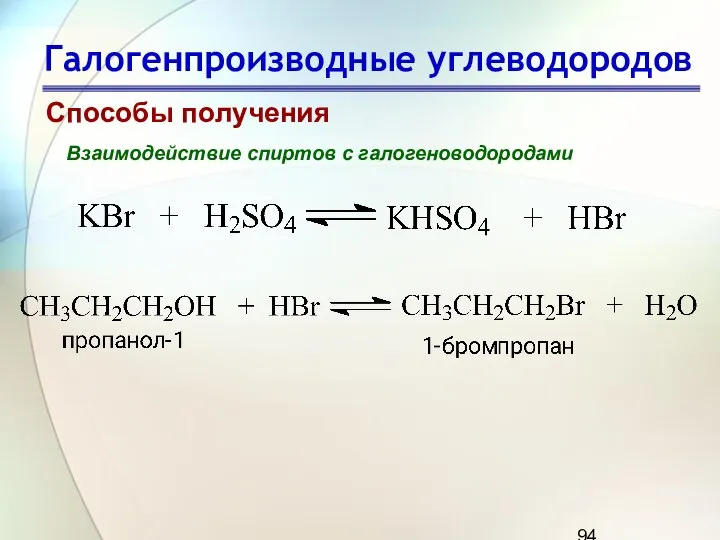
- 94. Галогенпроизводные углеводородов Способы получения Взаимодействие спиртов с галогеноводородами
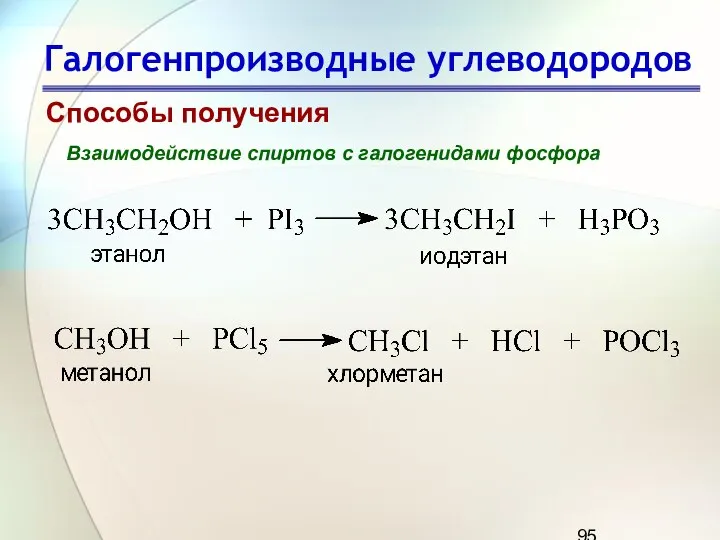
- 95. Галогенпроизводные углеводородов Способы получения Взаимодействие спиртов с галогенидами фосфора
- 96. Галогенпроизводные углеводородов Способы получения Взаимодействие спиртов с тионилхлоридом
- 98. Скачать презентацию
























































 Октябрьская революция
Октябрьская революция Инженерные решения активной и пассивной безопасности автомобильных дорог
Инженерные решения активной и пассивной безопасности автомобильных дорог Метрологические основы комплексного контроля в физической культуре и спорте
Метрологические основы комплексного контроля в физической культуре и спорте Презентация на тему: «Право собственности» Выполнил: студент 2 курса, ФТД очного отделения Лёвкина Елена
Презентация на тему: «Право собственности» Выполнил: студент 2 курса, ФТД очного отделения Лёвкина Елена Электрооборудование автомобиля
Электрооборудование автомобиля Пиратство в сфере интеллектуальной деятельности
Пиратство в сфере интеллектуальной деятельности Лидерство и стили руководства
Лидерство и стили руководства Réflexions politiques
Réflexions politiques Шесть пороков, разрушающих бхакти
Шесть пороков, разрушающих бхакти Люди с особой заботой социальная усадьба проект
Люди с особой заботой социальная усадьба проект Сантехнические изделия
Сантехнические изделия кэширование
кэширование Спортивный досуг 9-классника
Спортивный досуг 9-классника Критика просветительских иллюзий в культурологии Ницше. Проблема сверхчеловека
Критика просветительских иллюзий в культурологии Ницше. Проблема сверхчеловека Традиционные промыслы и занятия коренных малочисленных народов Томской области
Традиционные промыслы и занятия коренных малочисленных народов Томской области Округлости всех элементов продолговатой формы должны быть одинаковы. «Молочница – плохая подруга»
Округлости всех элементов продолговатой формы должны быть одинаковы. «Молочница – плохая подруга» Шевченко художник
Шевченко художник  Суть технологий
Суть технологий  История развития электроники
История развития электроники Муниципальная общеобразовательная школа – интернат «Общеобразовательная школа – интернат среднего (полного) общего образования
Муниципальная общеобразовательная школа – интернат «Общеобразовательная школа – интернат среднего (полного) общего образования Долг и совесть - презентация для начальной школы
Долг и совесть - презентация для начальной школы Bilgisayar ağları ve iletişim. Ağ cihazlarının görevleri ve kullanım yerleri. (6.Hafta)
Bilgisayar ağları ve iletişim. Ağ cihazlarının görevleri ve kullanım yerleri. (6.Hafta) Пирсинг и татуировки
Пирсинг и татуировки Способи охолоджування приміщень
Способи охолоджування приміщень Отсутствие нормативных документов - главный тормоз информатизации здравоохранения.
Отсутствие нормативных документов - главный тормоз информатизации здравоохранения. 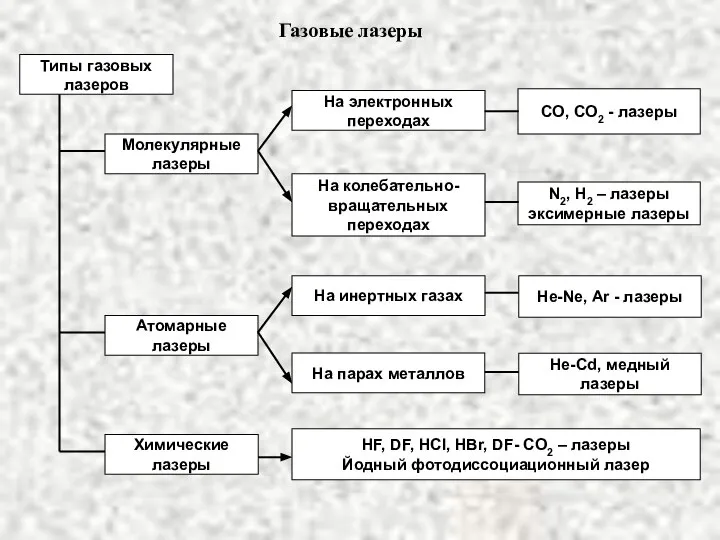 Газовые лазеры
Газовые лазеры Общие положения ремонта и реконструкции
Общие положения ремонта и реконструкции Ремонт зубчатых колес коробки подач токарных станков
Ремонт зубчатых колес коробки подач токарных станков