Содержание
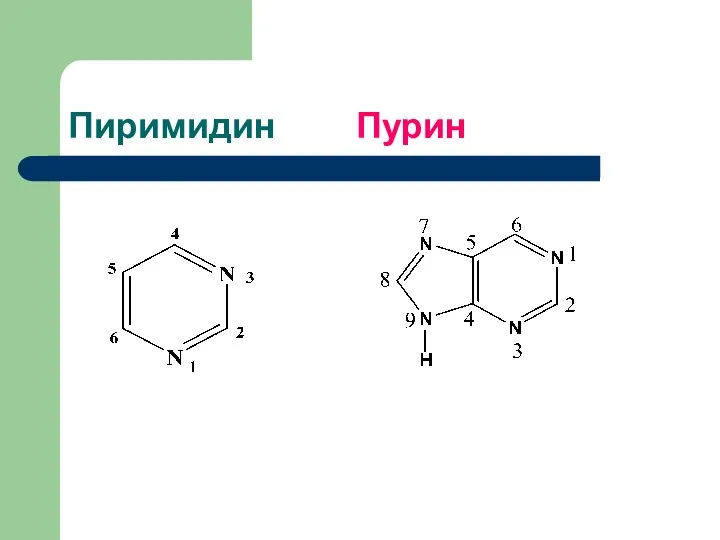
- 2. Пиримидин Пурин
- 3. Азотистые основания как органические соединения Азотистые основания – это ароматические гетероциклические соединения. рН их растворов щелочной.
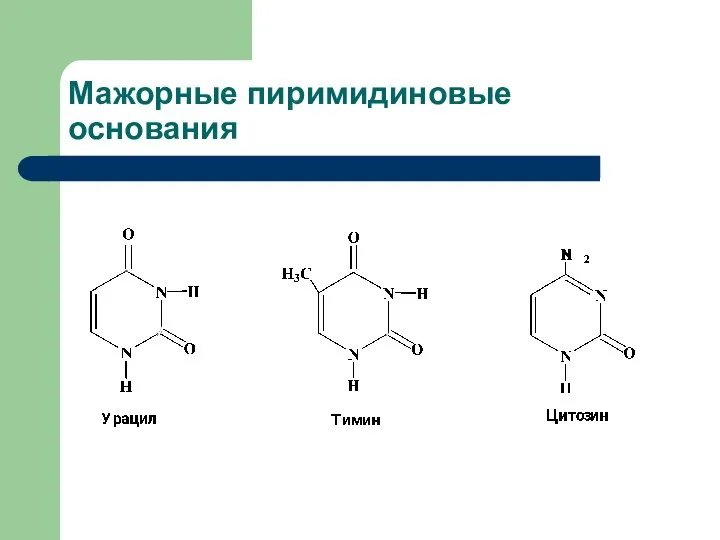
- 4. Мажорные пиримидиновые основания
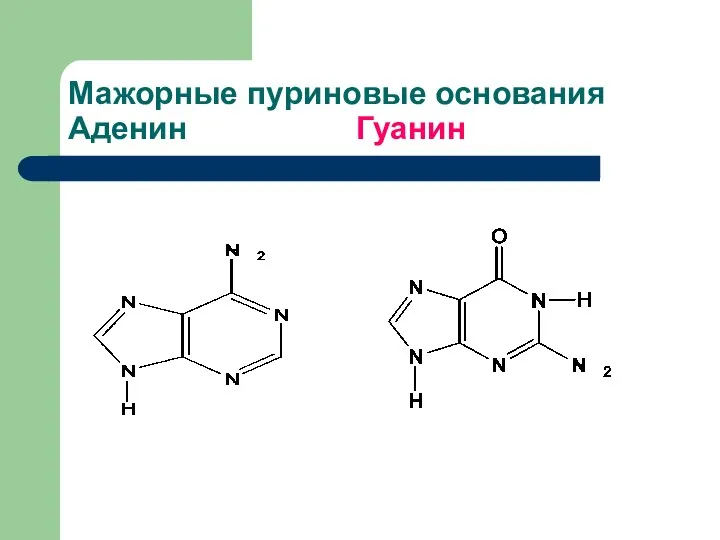
- 5. Мажорные пуриновые основания Аденин Гуанин
- 6. Использование пуринов и пиримидинов в организме 1. Входят в состав ДНК и РНК в виде нуклеотидов(формирование
- 8. Последствия нарушений синтеза азотистых оснований для человека 1. Прекращение процессов транскрипции генов и, следовательно, нарушение синтеза
- 9. Продолжение 3. Ухудшение медиаторного обмена в головном мозге, ускоренная гибель нейронов 4. Резкое снижение скорости ОВР,
- 10. Биосинтез пиримидинов (краткое описание) Для синтеза пиримидинового кольца необходимы: Аспартат – дает атомы N1, С4, С5,
- 11. Стадии синтеза пиримидина
- 12. Суммарное уравнение синтеза УМФ Карбамоилфосфат+аспартат+НАД+ +2АТФ+фосфорибозилдифосфат(ФРДФ) УМФ+СО2+2АДФ+2Pi+NADH+PPi
- 14. Биосинтез пурина (краткое описание) Для синтеза пуринов необходимы: Фосфорибозилдифосфат К нему присоединяется аминогруппа, источником которой обычно
- 15. Биосинтез пурина (краткое описание) До замыкания 5-членного цикла к С5 присоединяется азот N3 (аминогруппа глутамина) Углерод
- 17. Суммарное уравнение синтеза пуринов (ИМФ) CO2 (гидрокарбонат)+2 (С1-ТГФК)+глицин+2 глутамина+аспартат+4АТФ+фосфорибозилдифосфат (ФРДФ) ИМФ+2 глутамата+фумарат+4АДФ+4Pi
- 18. Ключевые продукты синтеза азотистых оснований Пиримидины Ключевым соединением является дигидроортат, который взаимодействует с фосфорибозилдифосфатом с образованием
- 19. Регуляция синтеза пуринов и пиримидинов Пиримидины Ключевой фермент - карбамоилфосфатсинтаза (поставщик карбамоилфосфата) Активность фермента тормозится УТФ
- 20. Атака на фолиевую кислоту как противоопухолевый прием Если нарушить перенос формильного фрагмента фолиевой кислотой, то синтез
- 21. Конкурентное ингибирование тимидилатсинтетазы как противоопухолевый прием УМФ(не входит в ДНК!) легко и быстро превращается в ТМФ
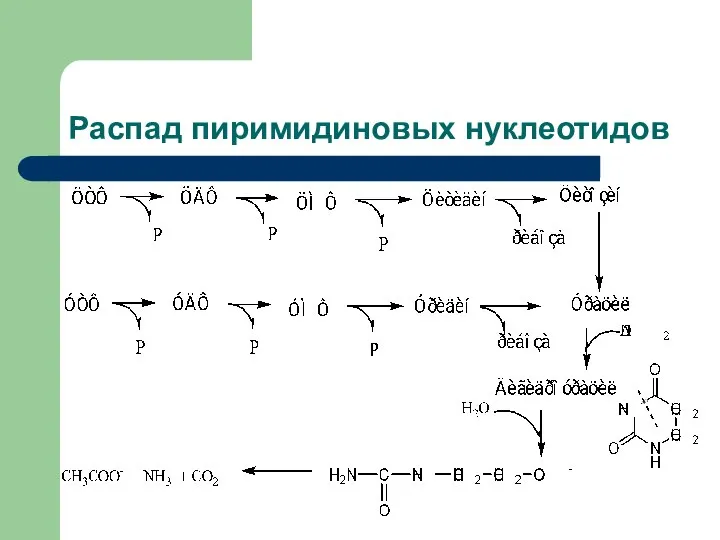
- 22. Распад пиримидиновых нуклеотидов
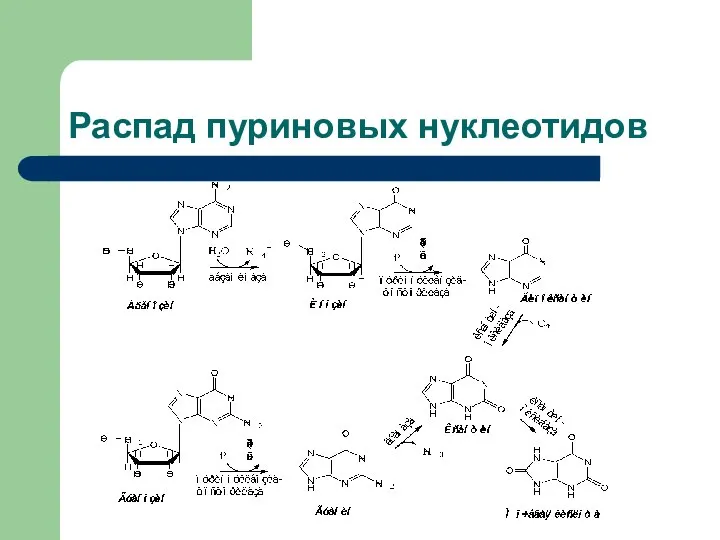
- 23. Распад пуриновых нуклеотидов
- 25. Распад пуриновых нуклеотидов заканчивается образованием плохорастворимого соединения - 2,6,8–тригидроксипурина, называемого мочевой кислотой. Усиленное образование мочевой кислоты
- 26. Последствия гиперурикемии Гиперурикемия сопровождается высоким уровнем мочевой кислоты в моче – гиперурикурия Соли мочевой кислоты (ураты)
- 27. «Путь спасения» пуриновых оснований Путь спасения позволяет превратить пуриновые основания в нуклеотиды, что снижает образование мочевой
- 28. «Путь спасения» пуринов (продолжение) С нарушениями «пути спасения» связаны 2 наследственных заболевания: А. Подагра (наследственная гиперурикемия)
- 29. Причины гиперурикемии 1.Нарушение выведения мочевой кислоты при заболеваниях почек 2.Повышенное образование мочевой кислоты А)при избыточном потреблении
- 30. Принципы коррекции гиперурикемии 1. Нормализация питания (уменьшить потребление пурин-богатых продуктов) 2. Исключение продуктов, снижающих рН мочи
- 32. Скачать презентацию
























 Аллергия
Аллергия Потоки произвольного вида
Потоки произвольного вида Обмен гемоглобина
Обмен гемоглобина  Рентгенологические синдромы заболеваний органов дыхания
Рентгенологические синдромы заболеваний органов дыхания Продуктовый магазин в “Esentai city”
Продуктовый магазин в “Esentai city” Нарушения углеводного обмена
Нарушения углеводного обмена Современные образовательные технологии
Современные образовательные технологии  Исследование роста сосновых насаждений ГКУ КО «Куйбышевское лесничество» и мероприятия по повышению их продуктивности
Исследование роста сосновых насаждений ГКУ КО «Куйбышевское лесничество» и мероприятия по повышению их продуктивности Понятие системы счисления Виды систем счисления
Понятие системы счисления Виды систем счисления Улуттук кийимдер жана жасалгалар
Улуттук кийимдер жана жасалгалар Развитие вычислительной техники
Развитие вычислительной техники Изобразительное искусство
Изобразительное искусство Реформа системы государственной власти и местного самоуправления в современной России
Реформа системы государственной власти и местного самоуправления в современной России Учебное Занятие по устройству автомобилей в гр.КТ-85, КТ-32 прошло на выставке SPB Transport Fest
Учебное Занятие по устройству автомобилей в гр.КТ-85, КТ-32 прошло на выставке SPB Transport Fest Современные избирательные технологии
Современные избирательные технологии Интоксикация пестицидами, применяемые в сельском хозяйстве.
Интоксикация пестицидами, применяемые в сельском хозяйстве.  Симонов Валентин Петрович Заслуженный работник высшей школы РФ, доктор педагогических наук, профессор www.vpsimonov.ru E-mail:valentin-simonov@yandex.ru ОЦЕНКА КАЧЕСТВА ОБУЧЕНИЯ НА ОСНОВЕ ХАРАКТЕРИСТИКИ СТЕПЕНИ ОБУЧЕННОСТИ ЛИЧНОСТИ
Симонов Валентин Петрович Заслуженный работник высшей школы РФ, доктор педагогических наук, профессор www.vpsimonov.ru E-mail:valentin-simonov@yandex.ru ОЦЕНКА КАЧЕСТВА ОБУЧЕНИЯ НА ОСНОВЕ ХАРАКТЕРИСТИКИ СТЕПЕНИ ОБУЧЕННОСТИ ЛИЧНОСТИ  Culture of Kazakhstan
Culture of Kazakhstan Петербругская мода во второй половине ХlХ века
Петербругская мода во второй половине ХlХ века Свобода и ответственность
Свобода и ответственность  Вводный учебный курс для новых дилеров Audi. Кузов
Вводный учебный курс для новых дилеров Audi. Кузов Государство Россия
Государство Россия Патология эндокринной системы Хатамов Холдор
Патология эндокринной системы Хатамов Холдор  Основные требования к электронным учебным курсам
Основные требования к электронным учебным курсам Областной конкурс «Туристический потенциал Пензенской области». Номинация: «Святые места». Храм «Рождества Христова»
Областной конкурс «Туристический потенциал Пензенской области». Номинация: «Святые места». Храм «Рождества Христова» Сетевое взаимодействие
Сетевое взаимодействие Л 9 Раздел 3. Интегралы и их свойства. Раздел 3. Интегралы и их свойства
Л 9 Раздел 3. Интегралы и их свойства. Раздел 3. Интегралы и их свойства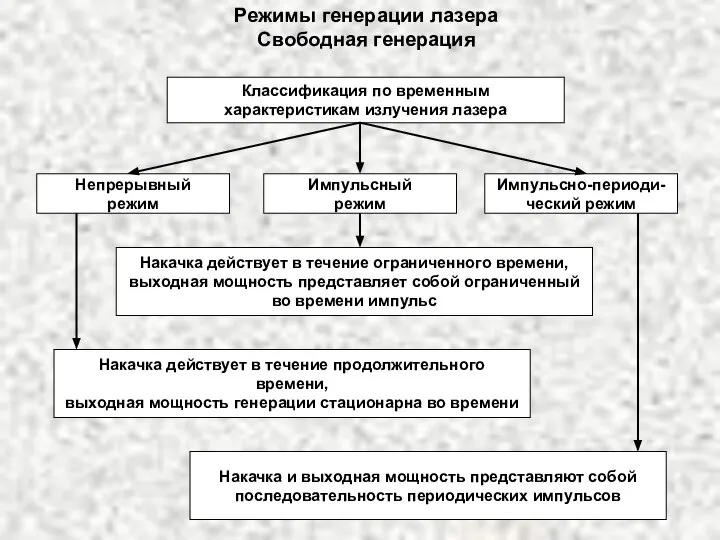 Режимы генерации лазера
Режимы генерации лазера