Содержание
- 2. Эритроциты у взрослых образуются (эритропоэз) преимущественно в костном мозге при активном участии специфического регулятора - эритропоэтина.
- 3. Эпо синтезируется главным образом почками и скорость его секреции в кровоток увеличивается при гипоксических состояниях. В
- 4. В процессе дифференцировки клетка приобретает способность синтезировать свой главный белок – гемоглобин, постепенно теряет ядро и
- 5. В норме у взрослых мужчина - 4.6-6.2 миллионов эритроцитов /мкл крови, а у женщин - 4.2-5.4
- 6. «Стареющие» эритроциты захватываются клетками РЭС( селезенка, костный мозг и печень), где разрушаются. Образующиеся при распаде порфириновых
- 7. Время жизни 120 дней (110-130). Поверхность всех эритроцитов 3800 м2. Общее количество 25XI012. Ежедневная потребность 208XI09.
- 8. Эритроцит По структуре эритроцит представляет собой безъядерный, двояковогнутый диск с диаметром 69 мкм, толщиной-1мкм по центру,
- 9. Эритроцит является осмометром, ,который набухает и сжимается при увеличении и снижении осмотического давления. В гипотоническом растворе
- 10. Эритроциты легко меняют свою форму. Архитектура мембраны эритроцитов определяет ее механические свойства. Благодаря высокой способности изменять
- 11. Состав мембраны эритроцитов Мембрана содержит 25% ХС, 60% фосфоглицеридов, и 5-10% гликолипидов. Из 60% ФГ- 15-16%
- 12. Белки эритроцита Эритроцит имеет как поверхностные так и интегральные белки. У человека в Э более обнаружено,
- 13. Метаболизм эритроцита В Э нет ЭПР, нет ядра и митохондрий. Основными метаболическими путями являются анаэробный гликолиз
- 14. Метаболические процессы в эритроцитах отличаются рядом особенностей Около 2% белка мембран эритроцитов составляет переносчик глюкозы. Он
- 15. Глюкоза в эритроцитах используется в основном в гликолизе и ПФП. Глюкоза основной источник энергии в эритроцитах.
- 18. Большинство белков мембраны являются гликопротеинами и являются интегральными белками мембраны.Что касается белков без углеводной части, то
- 19. Гемоглобин –главный белок цитозоля эритроцитов Одну треть клеточной массы эритроцитов составляет гемоглобин. Он же придает и
- 20. Спектрин главный белок цитоскелета является димером из двух длинных (100 нм в длину) полипептидных цепей (спектрин
- 22. При переносе кислорода возможно образование метгемоглобина -гемоглобина с окисленным Fe3+. За сутки в метгемоглобин окисляется около
- 23. Последние - особенно активны и могут вступать в реакции с белками, нуклеиновыми кислотами, липидами, и другими
- 24. Ферменты АОЗ в Эритроцитах - Это глютатионредуктаза, - метгемоглобин редуктаза - глутатионпероксидаза. GluSH защищает ферменты Э
- 25. Перекись водорода, образующаяся в этих реакциях, может разрушаться разными путями. В эритроцитах эту функцию выполняют фермент
- 26. ПФП окисления глюкозы в эритроцитах выполняет важную роль в поставке восстановительных эквивалентов системам, разрушающим активные формы
- 27. В Э есть рудименты ЦТК- ферменты- изоцитрат ДГ, малат ДГ, а также АсАТ, АлАТ, Mg++ и
- 28. Шунт Раппопорта конкурентно вытесняет О2 из HbO2 при состоянии гипоксии в ткани, а 2,3 ДФГ сдвигает
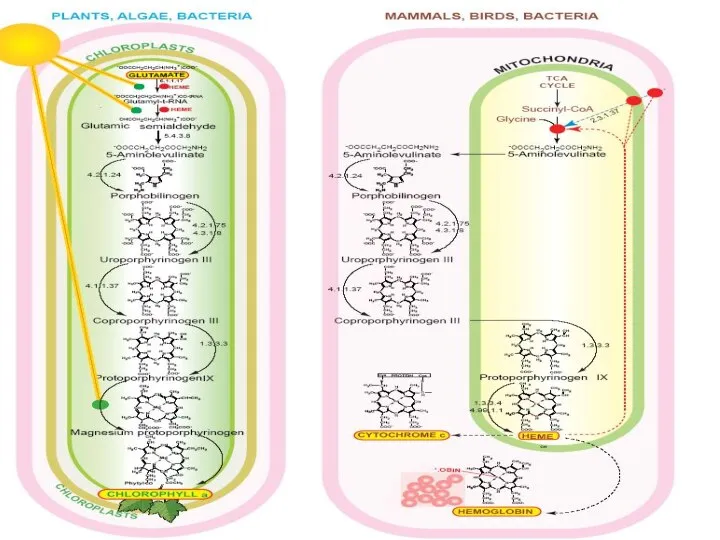
- 31. Гем – небелковая часть гемоглобина. Гем представляет собой производное порфирина, связанное с железом.
- 33. АЛК-дегидратазу называют также синтазой ПБГ. Этот фермент связывает восемь атомов Zn 2+, четыре из которых участвуют
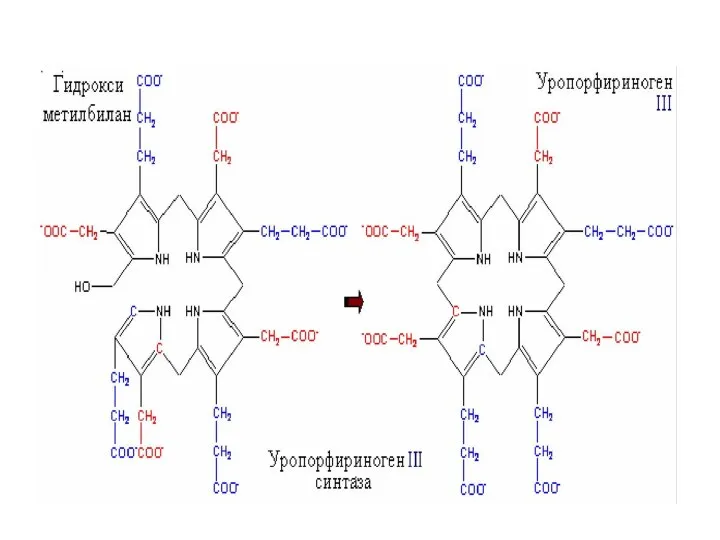
- 35. Следующий этап катализируется уропорфилиноген –I-синтазой или дезаминазой ПБГ. Дезаминаза ПБГ вначале из двух молекул ПБГ синтезирует
- 39. Причинами гемолитической анемии могут быть нарушения структурных белков мембран. Врожденный элиптоцитоз- гетерогенная группа заболеваний проявляющаяся морфологически
- 40. При отклонении значений ниже указанных говорят о гипохромной анемии ( недостаток железа) При отклонении значений выше
- 42. Гем – главный регулятор количества АЛК синтазы в клетке. АЛК-синтаза катализирует первую реакцию на пути образования
- 43. Температура, значение pН и парциальное давление CO2 влияют на кривые поглощения кислорода На кривую поглощения кислорода
- 44. Повышение отдачи 02 в кислой и богатой C02 областях ткани, биологически так же рационально как улучшение
- 45. 2.3-дифосфоглицерат сдвигает кривую насыщения гемоглобина кислородом вправо Эритроцит обладает системой механизмов направленных на поддержание обеспечения кислородом
- 46. Гипоксия ведет к повышению уровня 2,3 дифосфоглицерата в эритроцитах. Изменение рН в эритроцитах играет ключевую роль
- 48. Защелачивание внутри эритроцитов ведет к повышению активности ФФК и усилению образования 1,3-ДФГ, а следовательно, и 2,3-ДФГ
- 49. Эритроциты постоянно разрушаются, заменяясь новыми. Суточный распад- 20 мл Э, т.е. 0.85% всей массы Э. Каждый
- 50. Распад Э начинается в периферической крови и заканчивается в клетках РЭС, где образуется непрямой Билирубин. Клетками
- 51. Гем +О2 ---?биливердин + СО2 + Fe ++ Коферментом микросомальной гем- оксигеназы является NADF*H. Микросомальная гем-
- 52. Образующийся при распаде гемоглобина билирубин поступает в кровь и связывается альбуминами плазмы - это непрямой билирубином.
- 53. Клетками РЭС и кровью билирубин переносится к печени. Билирубин переносится в соотношении --1моль А на 2
- 55. Попадая в печень, билирубин ковалентно связывается с 2 молекулами УДФ -глюкуроновой кислоты, образуя диглюкуронид билирубина, который
- 56. Т.о. в клетках РЭС в частности в печени происходит распад : Эритроцит-Hb--> МетHb? биливердин+ 2Н+--> билирубин+6Н+—>
- 57. Часть уробилиногена 75-80% переходит в стеркобилиногенен--- ?стеркобилин. 20-25% уробилиногена всасывается в обл. тонкой кишки и через
- 58. Экспериментально доказано, что организм образует на 10-15% больше Б и соответственно Уробилина, чем ожидается при расщеплении
- 59. Определение содержания желчных пигментов в крови и моче играет решающую роль в дифференциальной диагностике различного вида
- 60. Неконьюгированный, непрямой Б –липофилен. Он имеет сродство к мембранам, легко растворяется в подкожной клетчатке, нервной ткани.
- 61. Т.о. в клетках РЭС в частности в печени происходит распад : Эритроцит- Hb-> МетHb-биливердин+ 2Н++-? билирубин+6Н—>уробилиноГЕН--+2Н+-----?
- 62. Этот конъюгат легко диссоциирует, он быстро фильтруются в почках, и появляется в моче, даже при незначительном
- 63. виды кровь моча кал желтух _______________________________________________________________________________ желчные прямой непрямой прямой непрямой стерко- уроби- стерко- пигменты билир.
- 64. Печеночная желтуха связана с патологическими состояниями, при которых нарушаются: 1. Все три стадии обезвреживания св.Б- элиминация
- 65. 2. Конъюгирование Б в связи с врожденным дефектом УДФ-глюкуронилтрансферазы. 3. Элиминация и транспорт Б гепатоцитом. 4.Выведение
- 67. Скачать презентацию






























































 Салическая правда
Салическая правда Нетрадиционные культы и секты
Нетрадиционные культы и секты Колосс Родосский
Колосс Родосский Экономические основы логистики и мониторинг логистических затрат Экономические особенности логистических систем Издер
Экономические основы логистики и мониторинг логистических затрат Экономические особенности логистических систем Издер Технические средства наноэлектроники. Методы получения тонких пленок. (Тема 3.2)
Технические средства наноэлектроники. Методы получения тонких пленок. (Тема 3.2) Аттестационная работа. Планирование развития проектной деятельности учащихся в рамках проекта «Детская Академия»
Аттестационная работа. Планирование развития проектной деятельности учащихся в рамках проекта «Детская Академия» УРОК Исскуство1
УРОК Исскуство1 Thanksgiving Day
Thanksgiving Day Primitive types and operations. Kamill Gusmanov @GusmanovKamill
Primitive types and operations. Kamill Gusmanov @GusmanovKamill Гусеничные тракторы
Гусеничные тракторы «Белая ночь» в Париже
«Белая ночь» в Париже Почему e-learning может не работать?. И как с этим бороться? - презентация
Почему e-learning может не работать?. И как с этим бороться? - презентация ГОРНЫЙ ХРУСТАЛЬ
ГОРНЫЙ ХРУСТАЛЬ Политическая культура, ее сущность и роль
Политическая культура, ее сущность и роль Ввод и передача данных. Работа с HTML формами (PHP, лекция 4)
Ввод и передача данных. Работа с HTML формами (PHP, лекция 4) Стартап без инвестора или ради чего вы это делаете?
Стартап без инвестора или ради чего вы это делаете?  Викторина. Рождество и новый год (для дошкольников)
Викторина. Рождество и новый год (для дошкольников) Драматический стиль женщины
Драматический стиль женщины Презентация Миграция населения
Презентация Миграция населения  Использование декоративно-прикладного искусства в детском саду
Использование декоративно-прикладного искусства в детском саду Тайм-менеджмент
Тайм-менеджмент Следственные и оперативно-розыскные ошибки: их профмлактика и устранение в состязательном процессе
Следственные и оперативно-розыскные ошибки: их профмлактика и устранение в состязательном процессе Публичные обсуждения результатов правоприменительной практики по итогам 2018 года
Публичные обсуждения результатов правоприменительной практики по итогам 2018 года Псков и Ганза. Из прошлого в настоящее
Псков и Ганза. Из прошлого в настоящее Эпоха иконоборчества
Эпоха иконоборчества Без названия
Без названия Стандартные функции языка CLIPS. Стандартные арифметические функции
Стандартные функции языка CLIPS. Стандартные арифметические функции Немецкие трудовые традиции
Немецкие трудовые традиции