Содержание
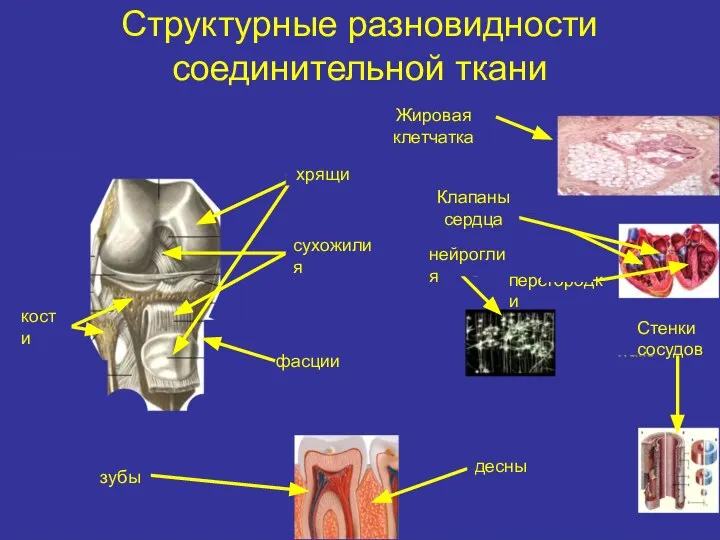
- 2. Структурные разновидности соединительной ткани Жировая клетчатка хрящи Клапаны сердца сухожилия кости фасции нейроглия зубы десны перегородки
- 3. ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ Структурная Универсальный биологический клей Обеспечение постоянства тканевой проницаемости Обеспечение водно-солевого равновесия Защитная функция
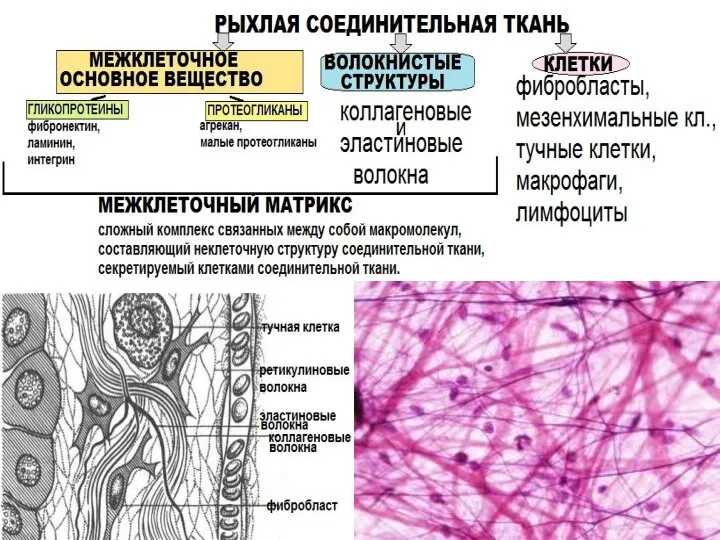
- 5. Основные белки соединительной ткани: -Коллаген, -Эластин, -Гликопротеины, -Протеогликаны.
- 6. Коллаген Самый распространенный белок (25-33% всех белков организма) Входит в состав коллагеновых волокон Самый прочный белок
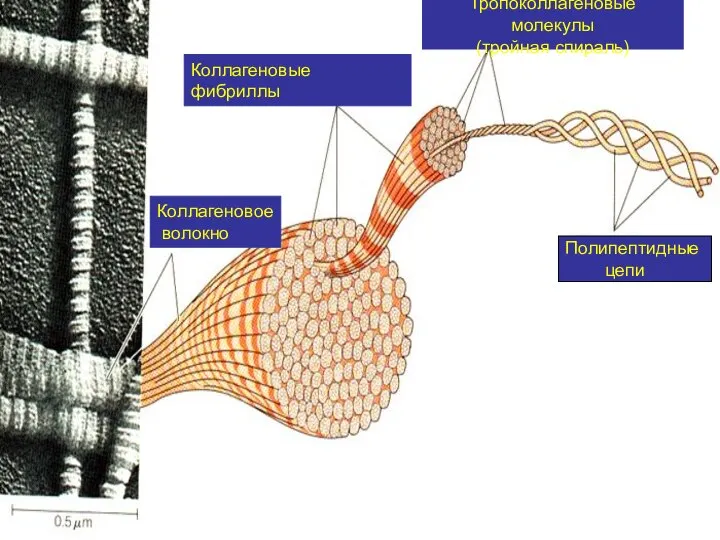
- 7. Полипептидные цепи Тропоколлагеновые молекулы (тройная спираль) Коллагеновые фибриллы Коллагеновое волокно
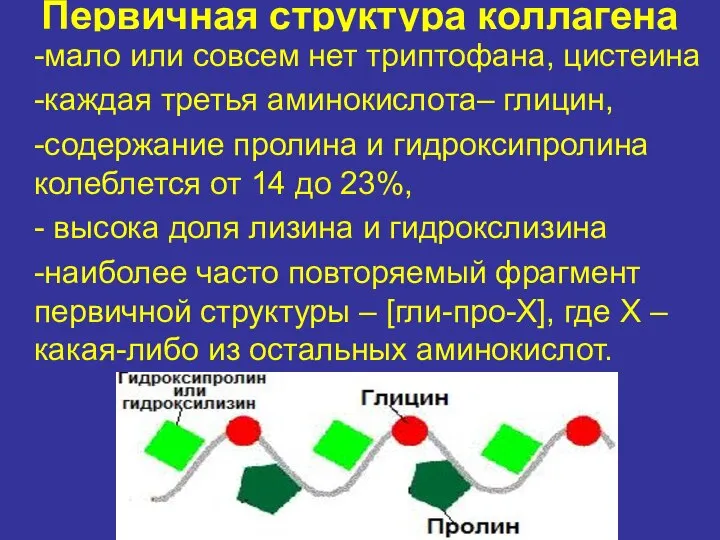
- 8. Первичная структура коллагена -мало или совсем нет триптофана, цистеина -каждая третья аминокислота– глицин, -содержание пролина и
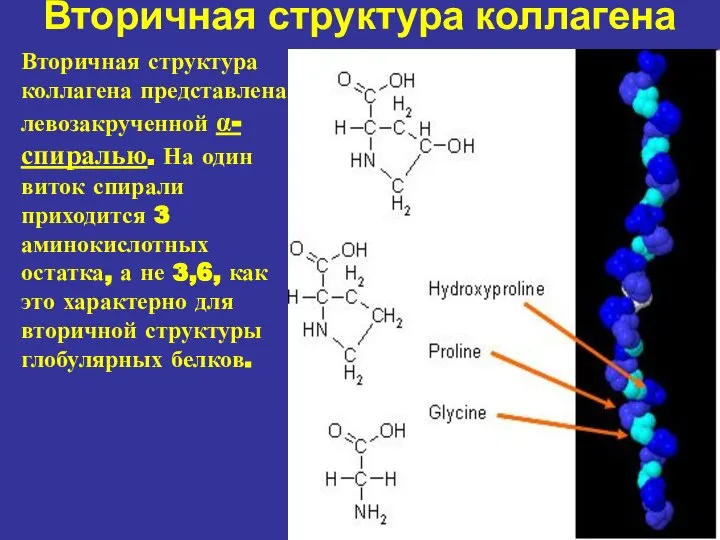
- 9. Вторичная структура коллагена Вторичная структура коллагена представлена левозакрученной α-спиралью. На один виток спирали приходится 3 аминокислотных
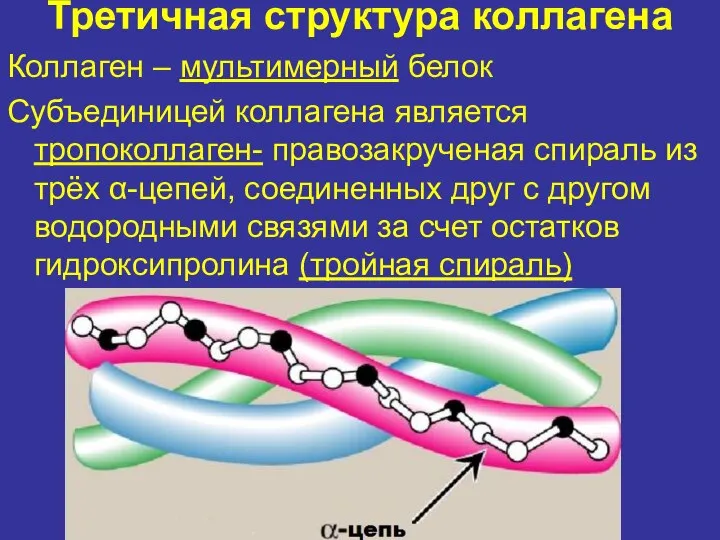
- 10. Третичная структура коллагена Коллаген – мультимерный белок Субъединицей коллагена является тропоколлаген- правозакрученая спираль из трёх α-цепей,
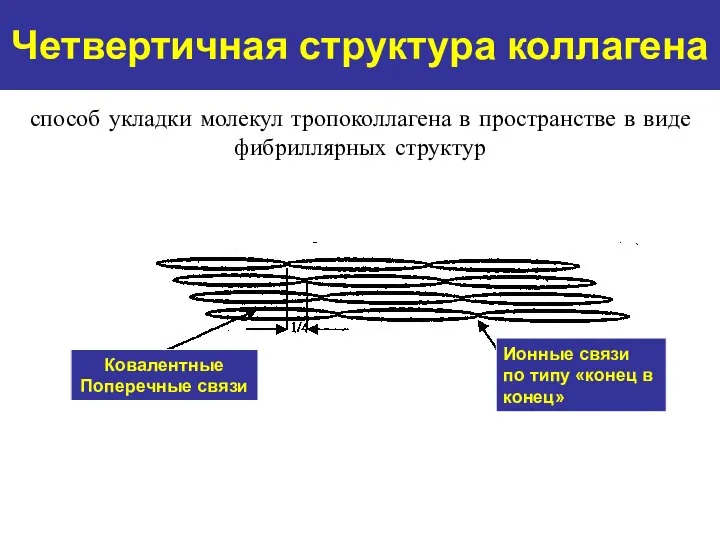
- 11. Четвертичная структура коллагена Ковалентные Поперечные связи Ионные связи по типу «конец в конец» способ укладки молекул
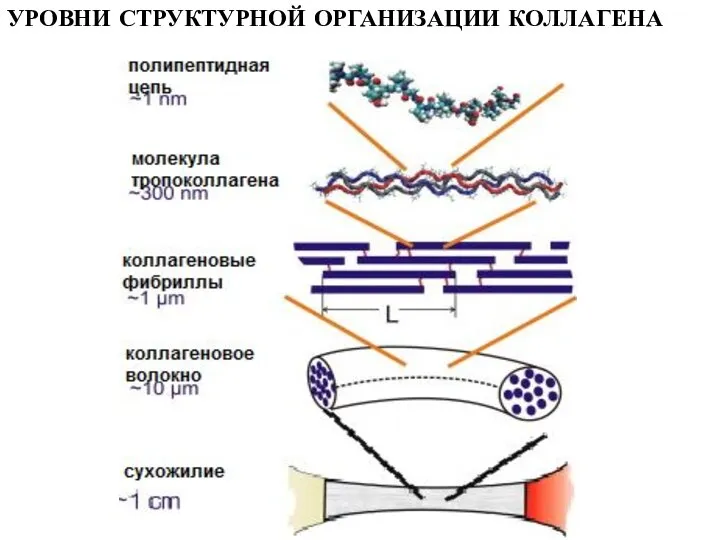
- 12. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ КОЛЛАГЕНА
- 13. Синтез и процессинг коллагена в фибробластах соединительной ткани
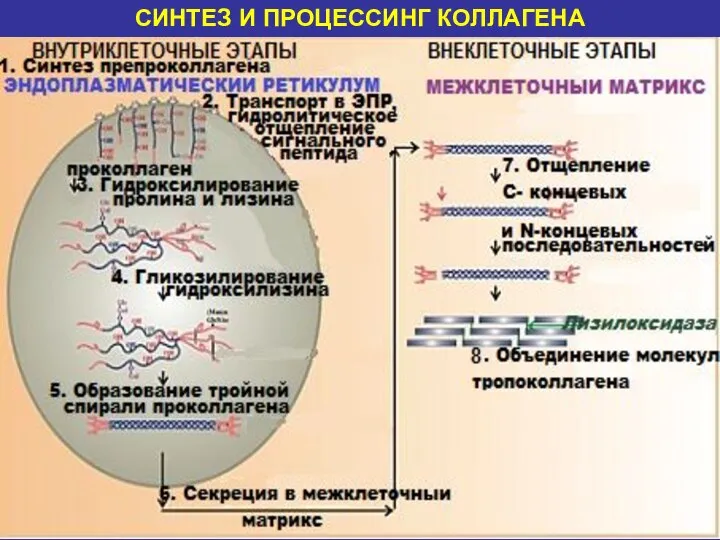
- 14. СИНТЕЗ И ПРОЦЕССИНГ КОЛЛАГЕНА
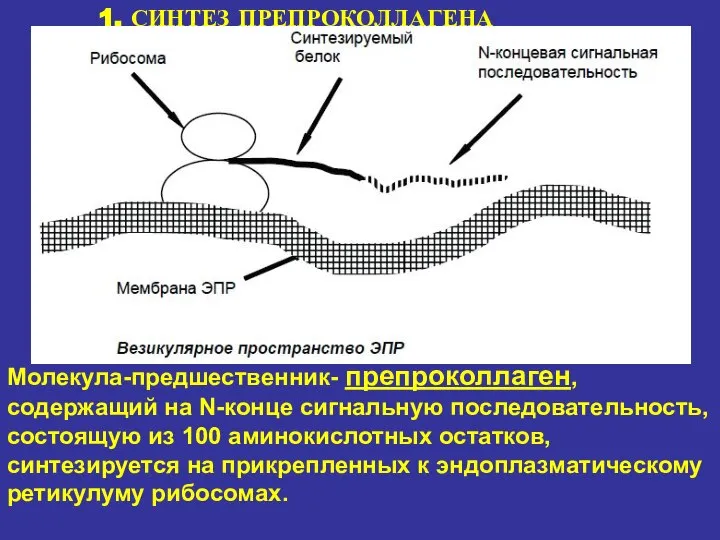
- 15. 1. СИНТЕЗ ПРЕПРОКОЛЛАГЕНА Молекула-предшественник- препроколлаген, содержащий на N-конце сигнальную последовательность, состоящую из 100 аминокислотных остатков, синтезируется
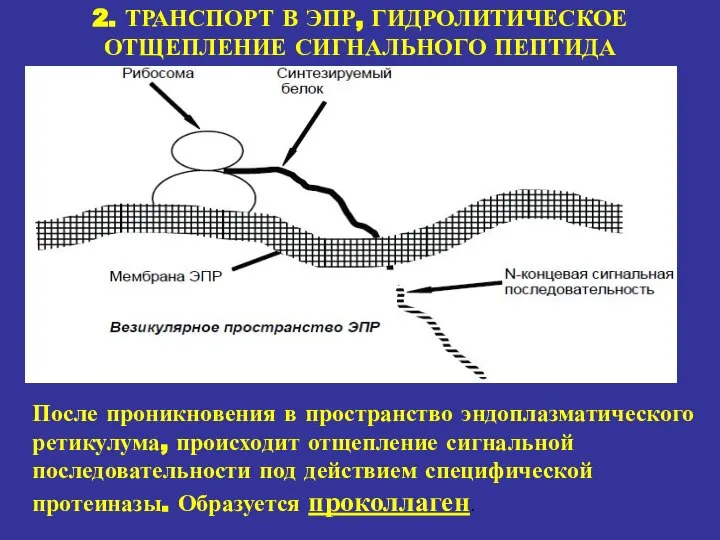
- 16. 2. ТРАНСПОРТ В ЭПР, ГИДРОЛИТИЧЕСКОЕ ОТЩЕПЛЕНИЕ СИГНАЛЬНОГО ПЕПТИДА После проникновения в пространство эндоплазматического ретикулума, происходит отщепление
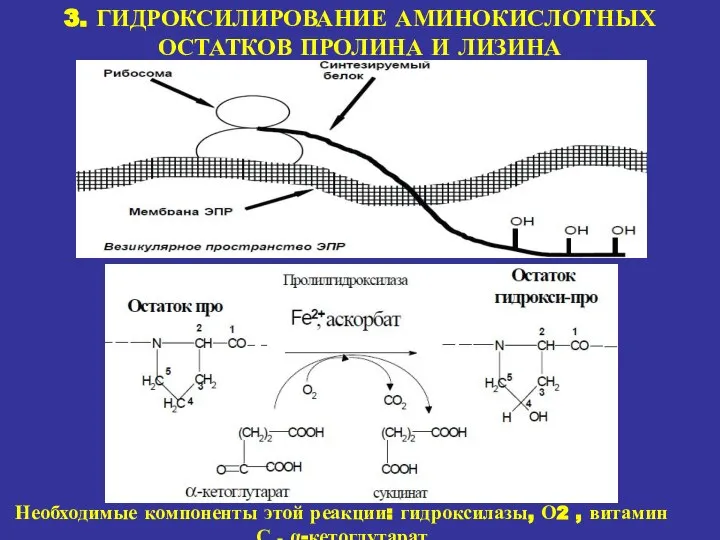
- 17. 3. ГИДРОКСИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ПРОЛИНА И ЛИЗИНА Необходимые компоненты этой реакции: гидроксилазы, О2 , витамин С
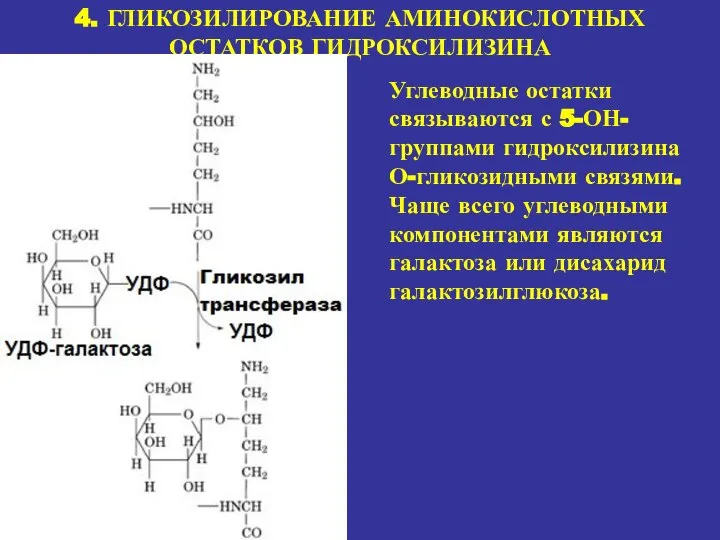
- 18. 4. ГЛИКОЗИЛИРОВАНИЕ АМИНОКИСЛОТНЫХ ОСТАТКОВ ГИДРОКСИЛИЗИНА Углеводные остатки связываются с 5-ОН-группами гидроксилизина О-гликозидными связями. Чаще всего углеводными
- 19. 5. ОБРАЗОВАНИЕ ТРОЙНОЙ СПИРАЛИ ПРОКОЛЛАГЕНА включает несколько процессов: а) Между С-концевыми последовательностями полипептидных цепей формируются межцепочечные
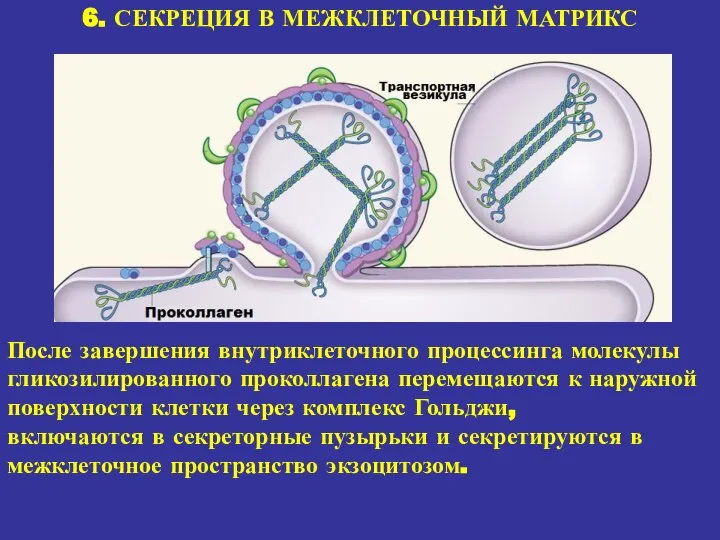
- 20. 6. СЕКРЕЦИЯ В МЕЖКЛЕТОЧНЫЙ МАТРИКС После завершения внутриклеточного процессинга молекулы гликозилированного проколлагена перемещаются к наружной поверхности
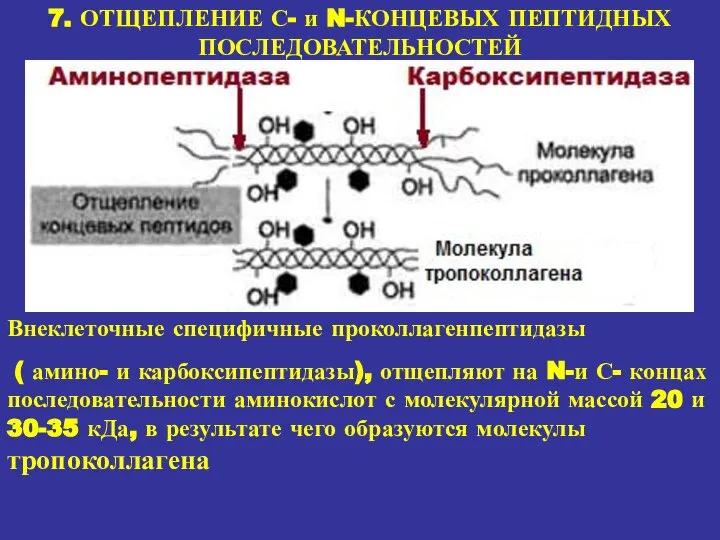
- 21. 7. ОТЩЕПЛЕНИЕ С- и N-КОНЦЕВЫХ ПЕПТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ Внеклеточные специфичные проколлагенпептидазы ( амино- и карбоксипептидазы), отщепляют на
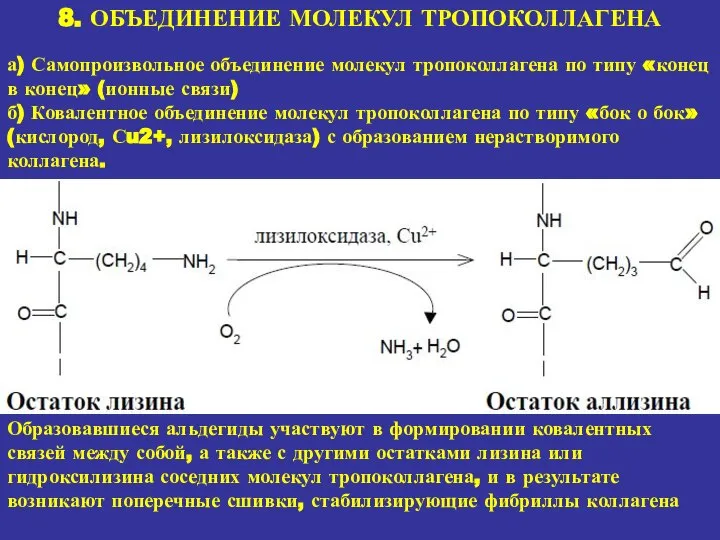
- 22. 8. ОБЪЕДИНЕНИЕ МОЛЕКУЛ ТРОПОКОЛЛАГЕНА а) Самопроизвольное объединение молекул тропоколлагена по типу «конец в конец» (ионные связи)
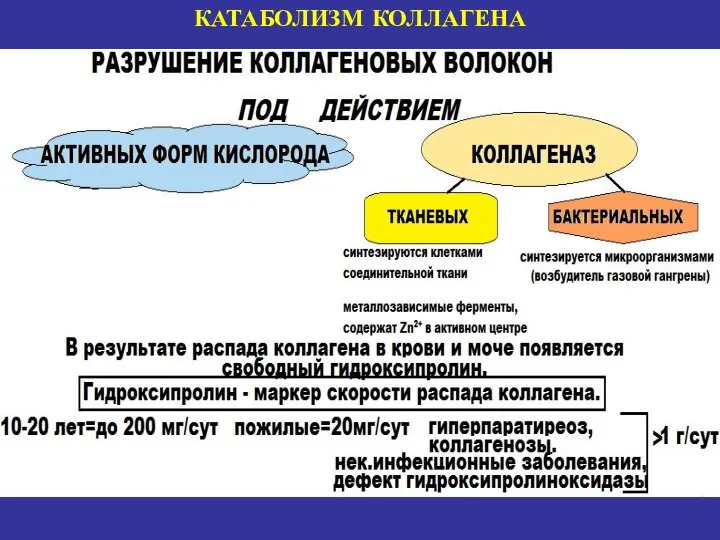
- 23. КАТАБОЛИЗМ КОЛЛАГЕНА
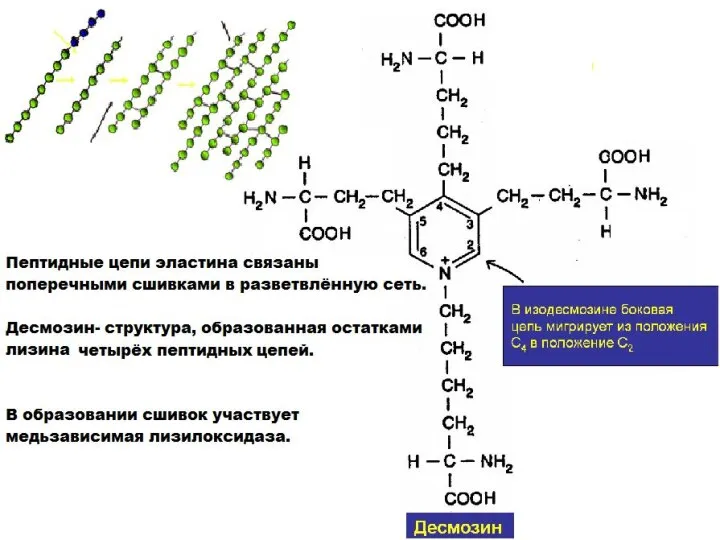
- 25. Эластин- основной белок эластических волокон, которые содержатся в межклеточном веществе кожи, стенок кровеносных сосудов, связок, лёгких,
- 27. Различия между коллагеном и эластином
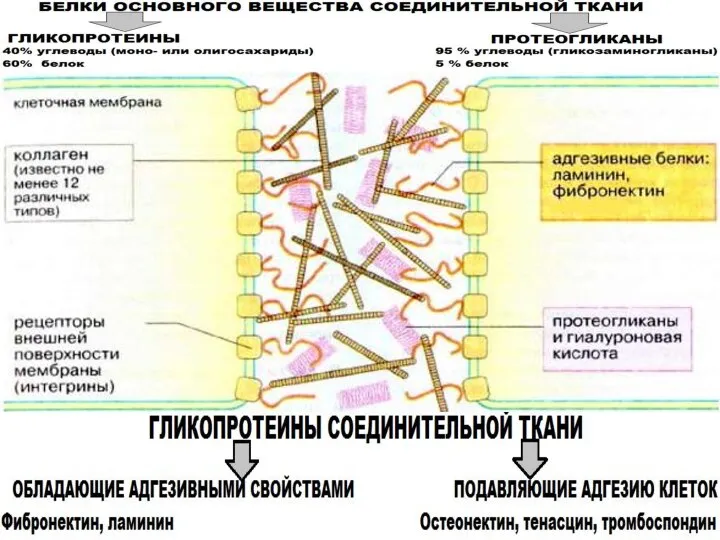
- 29. Основные гликопротеины соединительной ткани
- 30. Протеогликаны
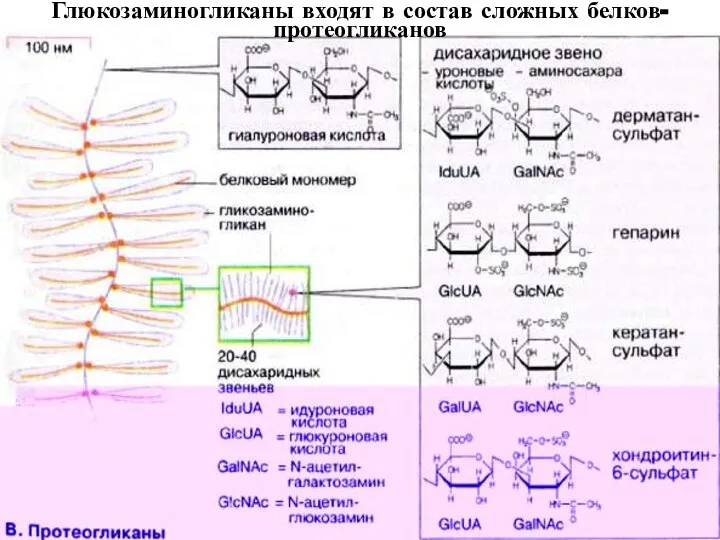
- 31. Структура мономера гликозамингликанов {Уроновая кислота или галактоза-O- Ацетилир. или (и) гликозилир. гексозамин}n
- 32. СОСТАВ ГЛЮКОЗАМИНГЛИКАНОВ Название глюкозамин- гликана Дисахаридный мономер
- 33. Глюкозаминогликаны входят в состав сложных белков- протеогликанов
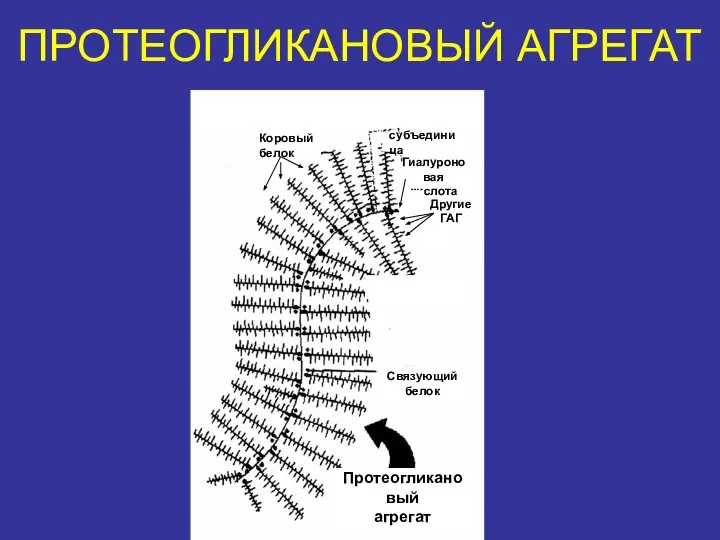
- 34. ПРОТЕОГЛИКАНОВЫЙ АГРЕГАТ Коровый белок субъединица Гиалуроновая кислота Другие ГАГ Связующий белок Протеогликановый агрегат
- 35. Функции протеогликанов Депонирование воды, Депонирование жира (адипоциты) Депонирование осмотически активных ионов (Na+, Cl-), Формирование тургора ткани,
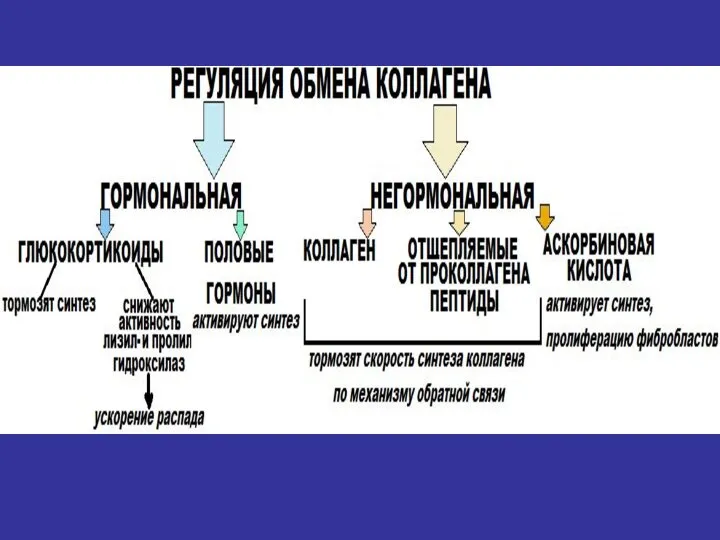
- 36. Особенности метаболизма соединительной ткани 1. Низкая скорость обновления всех молекул (более длительный период полураспада по сравнению
- 37. Особенности метаболизма соединительной ткани 2. Возрастные изменения метаболизма соединительной ткани: -снижение количества ГАГ, -снижение отношения ХС/KС
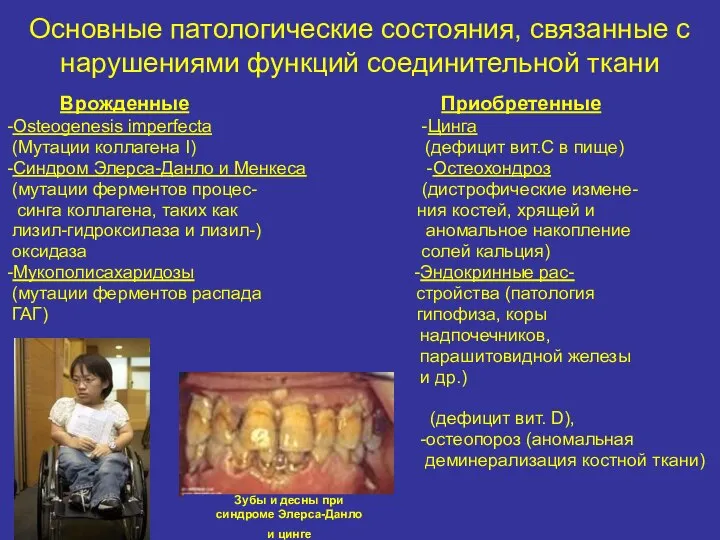
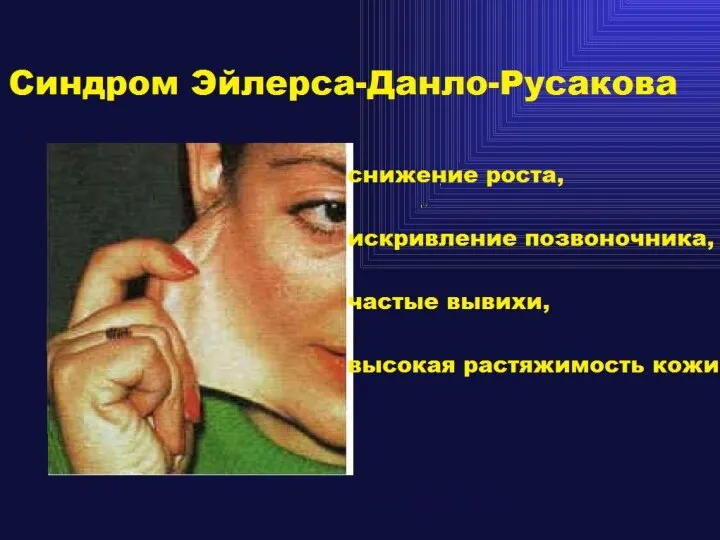
- 38. Основные патологические состояния, связанные с нарушениями функций соединительной ткани Врожденные Приобретенные -Osteogenesis imperfecta -Цинга (Мутации коллагена
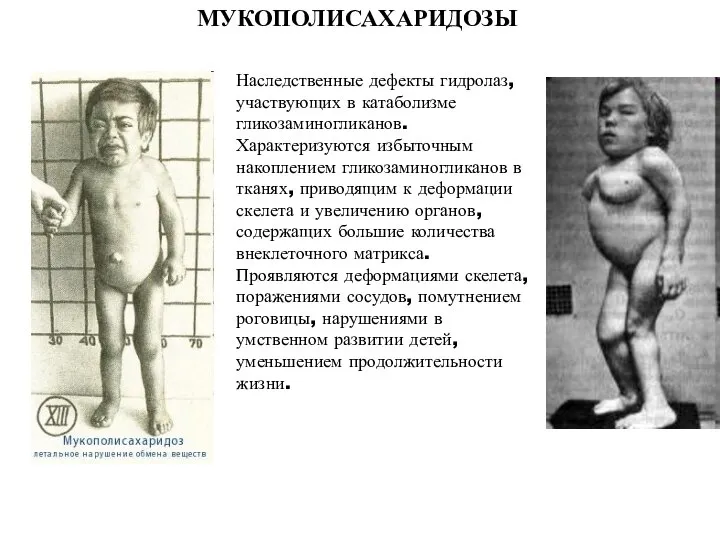
- 39. МУКОПОЛИСАХАРИДОЗЫ Наследственные дефекты гидролаз, участвующих в катаболизме гликозаминогликанов. Характеризуются избыточным накоплением гликозаминогликанов в тканях, приводящим к
- 42. Скачать презентацию














 Створення системи деплойменту ігрових серверів
Створення системи деплойменту ігрових серверів Спортивная экипировка лыжника
Спортивная экипировка лыжника Биология
Биология Динамические структуры данных и их организация с помощью указателей
Динамические структуры данных и их организация с помощью указателей Українське декоративне мистецтво як засіб патріотичного виховання
Українське декоративне мистецтво як засіб патріотичного виховання Тема № 4.Регуляторы напряжения авиационных генераторов. Занятие № 4. Блок регулирования напряжения БРН-7М
Тема № 4.Регуляторы напряжения авиационных генераторов. Занятие № 4. Блок регулирования напряжения БРН-7М Презентация урока русского языка в 3 классе по теме «Правописание гласных и согласных в корне слова»
Презентация урока русского языка в 3 классе по теме «Правописание гласных и согласных в корне слова» Школы искусства и дизайна в США Университеты Западного Побережья штаты Вашингон, Орегон, Невада, Калифорния
Школы искусства и дизайна в США Университеты Западного Побережья штаты Вашингон, Орегон, Невада, Калифорния Нанесение размеров. Масштабы
Нанесение размеров. Масштабы Хранение машин
Хранение машин Московская семантическая школа
Московская семантическая школа Эволюция нидерландского женского костюма сквозь призму европейской культуры
Эволюция нидерландского женского костюма сквозь призму европейской культуры Функціональні системи вертольота Ми-2. Допоміжні системи
Функціональні системи вертольота Ми-2. Допоміжні системи Мурманский государственный гуманитарный университет Факультет естествознания физической культуры и безопасности жизнедеятельн
Мурманский государственный гуманитарный университет Факультет естествознания физической культуры и безопасности жизнедеятельн Программирование автоматики
Программирование автоматики Климактерический синдром Климактерический синдром
Климактерический синдром Климактерический синдром  Коллизионные нормы в международном частном праве. (Тема 3)
Коллизионные нормы в международном частном праве. (Тема 3) Презентация на тему "Лекарственные средства" - скачать презентации по Медицине
Презентация на тему "Лекарственные средства" - скачать презентации по Медицине Как стать учителем английского языка в Китае и зарабатывать от 2500$
Как стать учителем английского языка в Китае и зарабатывать от 2500$ Л.Н. Толстой
Л.Н. Толстой Работу подготовила Кириакова Диана Учитель Маркова Юлия Викторовна
Работу подготовила Кириакова Диана Учитель Маркова Юлия Викторовна  ИМИДЖ
ИМИДЖ Презентация М.М.Пришвин
Презентация М.М.Пришвин Притча о неверном управителе, притча о богаче и Лазаре. Исцеление десяти прокаженных
Притча о неверном управителе, притча о богаче и Лазаре. Исцеление десяти прокаженных Проект «Новое мышление» РМ Рейл 2018 год
Проект «Новое мышление» РМ Рейл 2018 год Реклама и маркетинг санатория и отеля – отбросить ненужное
Реклама и маркетинг санатория и отеля – отбросить ненужное Презентация Христианство-стержень средневековой культуры
Презентация Христианство-стержень средневековой культуры Презентация "ВИДЫ И СПОСОБЫ ТОРГОВЛИ" - скачать презентации по Экономике_
Презентация "ВИДЫ И СПОСОБЫ ТОРГОВЛИ" - скачать презентации по Экономике_