Содержание
- 2. План лекції Квантові постулати Бора. Випромінювання і поглинання світла атомами. Спектри та їх види. Спектральний аналіз.
- 3. Перший постулат (положення) Бора у стійкому атомі електрон може рухатися лише по особливих, стаціонарних орбітах, не
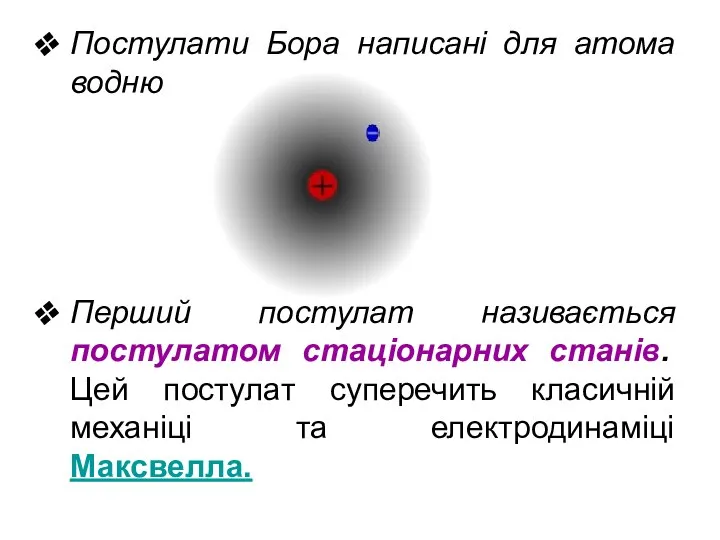
- 4. Постулати Бора написані для атома водню Перший постулат називається постулатом стаціонарних станів. Цей постулат суперечить класичній
- 5. Другий постулат атом може, переходити із одного стаціонарного стану до іншого. Під час переходу атома зі
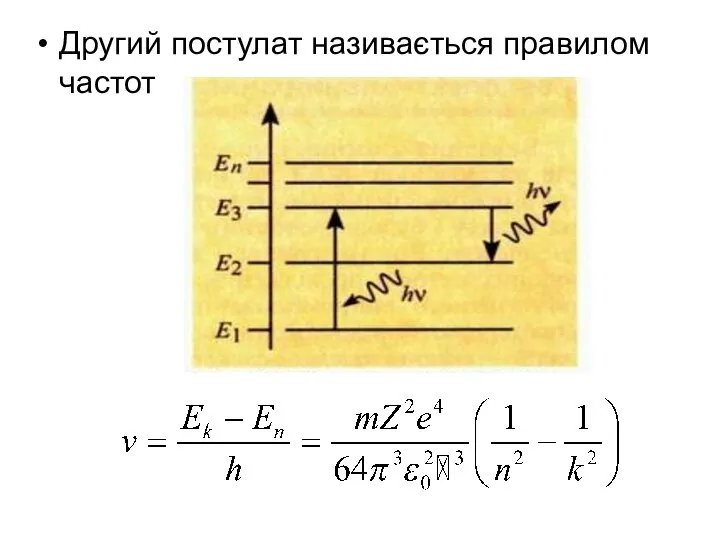
- 6. Другий постулат називається правилом частот
- 7. Третій постулат у стаціонарному стані атома електрон, рухаючись по коловій орбіті, повинен мати дискретні, квантові значення
- 8. Третій постулат називається правилом квантування орбіт. Виявилося, що можна одержати низку дискретних розділених стаціонарних станів тільки
- 9. Спектральні серії
- 11. Недоліки теорії Бора: 1. Внутрішня суперечливість, непослідовність (поєднання класичної фізики та квантово-механічних постулатів). 2. Ніяк не
- 13. Спектральним аналізом називається метод вивчення хімічного складу речовини, заснований на дослідженні його спектрів.
- 14. Найбільш прості спектральні прилади — призма та дифракційна решітка. Більш точні — спектроскоп і спектрограф.
- 15. У 1860 році німецькі вчені Г. Кірхгоф і Р. Бунзен, вивчаючи спектри металів, установили такі факти:
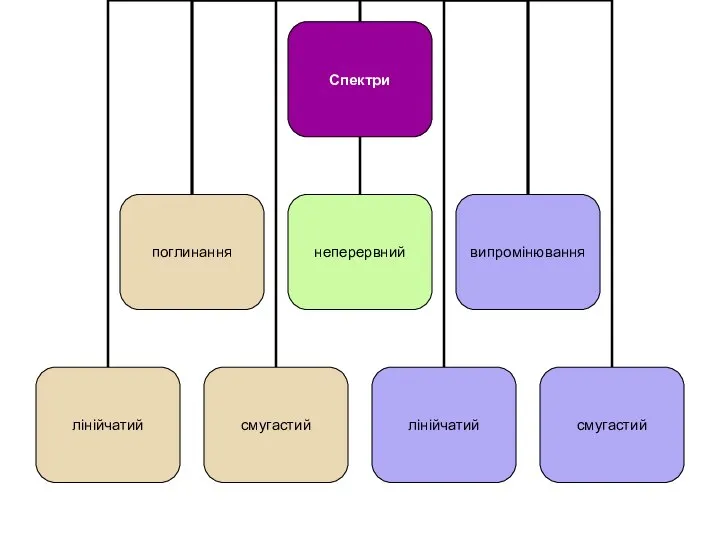
- 16. Спектр — послідовність монохроматичних випромінювань, кожному з яких відповідає певна довжина хвилі електромагнітного коливання Безперервні (або
- 17. Лінійчатий спектр випромінювання - водень Лінійчаті спектри дають всі речовини в газоподібному атомарному (але не молекулярному)
- 18. Смугастий спектр смугасті спектри створюються не атомами, а молекулами, не зв'язаними або слабко зв'язаними один з
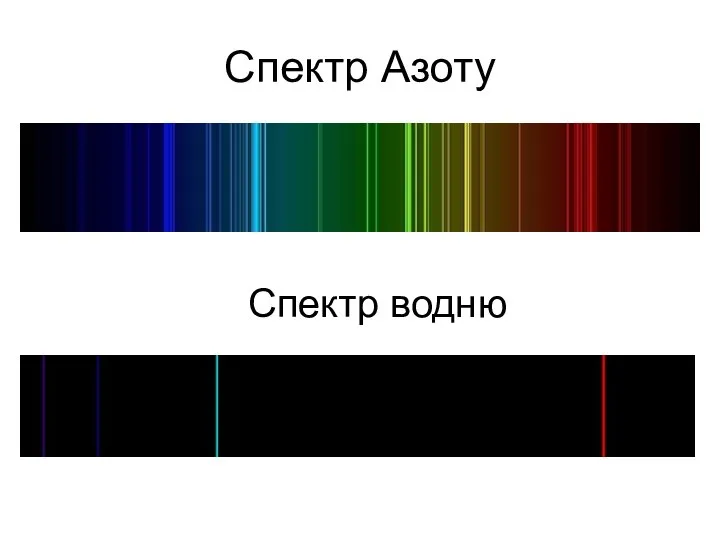
- 20. Спектр Азоту Спектр водню
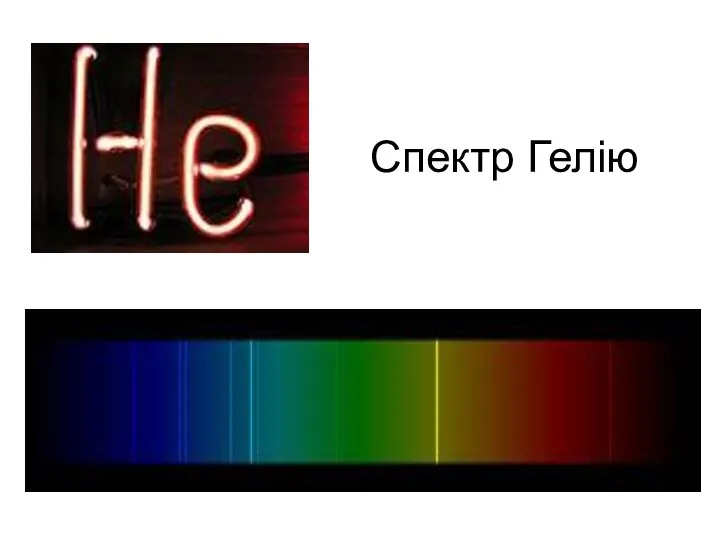
- 21. Спектр Гелію
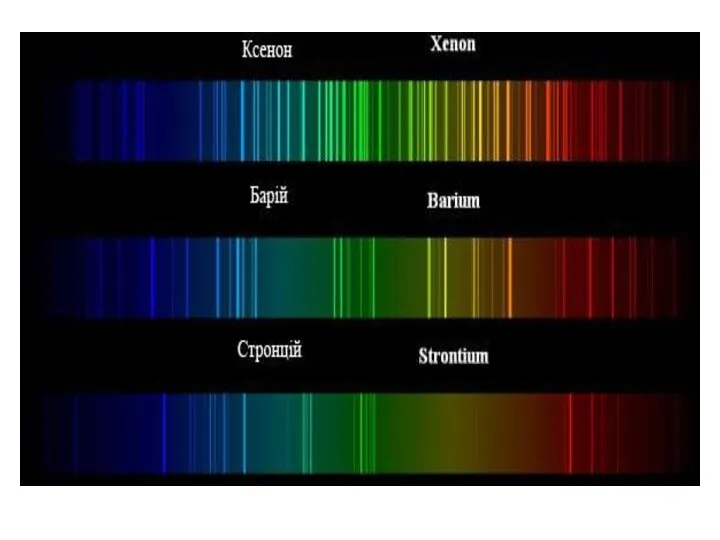
- 22. Спектр Неону
- 28. Скачать презентацию



















 Строки в С++
Строки в С++ Кадровый потенциал организации
Кадровый потенциал организации Как собрать команду начинающему интернет-бизнесу Как собрать команду начинающему интернет-бизнесу
Как собрать команду начинающему интернет-бизнесу Как собрать команду начинающему интернет-бизнесу Lionel Messi
Lionel Messi Особые условия труда и психические качества человека
Особые условия труда и психические качества человека  Математика - презентация для начальной школы_
Математика - презентация для начальной школы_ Я и мое имя (3 класс) - презентация для начальной школы_
Я и мое имя (3 класс) - презентация для начальной школы_ Семейное воспитание как психолого-педагогическая проблема Подготовили: Студентки группы Т-104 Куликова Юлия, Сазонова Юлия
Семейное воспитание как психолого-педагогическая проблема Подготовили: Студентки группы Т-104 Куликова Юлия, Сазонова Юлия Борьба с «отмыванием грязных» денег Подготовили студентки 2-го курса группы Э101 Овсянникова Надежда Орлова Любовь
Борьба с «отмыванием грязных» денег Подготовили студентки 2-го курса группы Э101 Овсянникова Надежда Орлова Любовь Дискретные системы и сигналы
Дискретные системы и сигналы Обучение решению текстовых задач Учитель высшей категории: Сотникова Ирина Николаевна МБОУ – Средняя общеобразовательная школа
Обучение решению текстовых задач Учитель высшей категории: Сотникова Ирина Николаевна МБОУ – Средняя общеобразовательная школа Рынок капитала Петрова
Рынок капитала Петрова Презентация на тему "подготовка к ЕНТ" - скачать презентации по Педагогике
Презентация на тему "подготовка к ЕНТ" - скачать презентации по Педагогике Смесительные и детекторные диоды
Смесительные и детекторные диоды Найди правильное утверждение
Найди правильное утверждение Развитие территории: тренды, идеи, практики
Развитие территории: тренды, идеи, практики Олжас Сулейманов
Олжас Сулейманов  Работа с дисками
Работа с дисками Использование INTERNET для повышения для повышения информационной культуры учителя учителя Михалева Татьяна Борисовна учитель матем
Использование INTERNET для повышения для повышения информационной культуры учителя учителя Михалева Татьяна Борисовна учитель матем Дидактический материал по русскому языку «Найди предложения» 1 класс
Дидактический материал по русскому языку «Найди предложения» 1 класс  Тема «Cудебный контроль за законностью осуществления исполнительной власти» Выполнил: студент 2-ого курса экономического факульт
Тема «Cудебный контроль за законностью осуществления исполнительной власти» Выполнил: студент 2-ого курса экономического факульт Содержание: 1. Определение термина «телеконференция». Определение термина «телеконференция» 2. АудиоконференцияАудиоконференция
Содержание: 1. Определение термина «телеконференция». Определение термина «телеконференция» 2. АудиоконференцияАудиоконференция  Исковое требование о защите прав потребителя. Пример
Исковое требование о защите прав потребителя. Пример М. Портер и его роль в развитии теории конкурентоспособности Подготовил: Безнощук Богдан, студент 4 курса, ДС-01
М. Портер и его роль в развитии теории конкурентоспособности Подготовил: Безнощук Богдан, студент 4 курса, ДС-01 Royal shakespeare theatre
Royal shakespeare theatre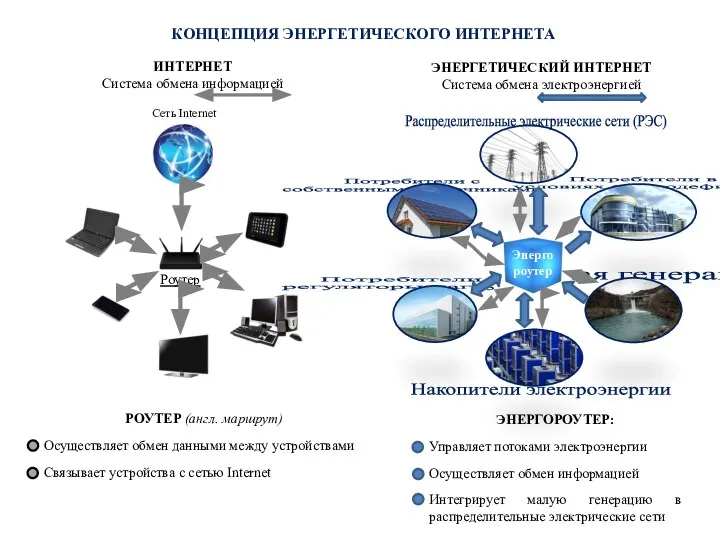 Концепция энергетического интернета
Концепция энергетического интернета Духовная культура
Духовная культура Локальные компьютерные сети. 8 класс
Локальные компьютерные сети. 8 класс