Содержание
- 2. Обеспечение высоких показателей качества и эффективности лекарственных средств во многом определяется процедурой регистрации, которую обязаны проходить
- 3. CTD – Common Technical Document – общий технический формат документа представляющего международное европейское регистрационное досье.
- 4. Главная цель разработки CTD Гармонизация требований к представлению регистрационных документов, что позволяет направлять их в органы
- 5. Гармонизация – это… Согласование различий и несоответствий между разными инструментами, методами, процедурами, перечнями, спецификациями или системами
- 6. Основой регистрационной документации является CTD (Common Technical Document) – (ОТД) Общий технический документ , перечень регистрационных
- 7. ICH – международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для медицинского применения
- 8. Область применения CTD CTD, первоначально применимый исключительно к новым химическим соединениям и биотехнологическим препаратам, в дальнейшем
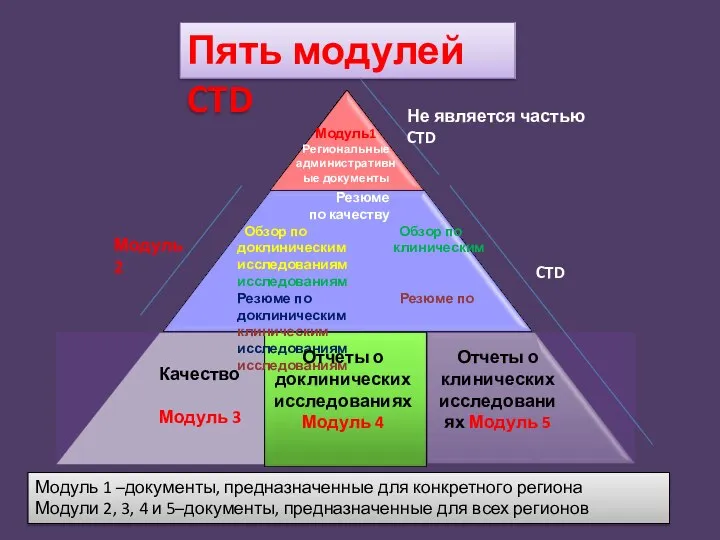
- 9. Оно содержит пять модулей описания продукта: Модуль 1 - административная информация Модуль 2 – резюме Модуль
- 10. Модуль1 Региональные административные документы Резюме по качеству Обзор по Обзор по доклиническим клиническим исследованиям исследованиям Резюме
- 12. Скачать презентацию








 Основные вехи жизни и деятельности свт. Филарета, характеристика личности, богословское наследие, особенности стиля
Основные вехи жизни и деятельности свт. Филарета, характеристика личности, богословское наследие, особенности стиля Олимпийские игры
Олимпийские игры Презентация Кожевенно-обувные товары
Презентация Кожевенно-обувные товары Програмування
Програмування Південь України
Південь України rannaje siaredniawecza
rannaje siaredniawecza  Параллельные архитектуры на основе общей разделяемой памяти: особенности организации, примеры SMP-симметричные многопроцессорные
Параллельные архитектуры на основе общей разделяемой памяти: особенности организации, примеры SMP-симметричные многопроцессорные  JavaScript First steps
JavaScript First steps Иерархия потребностей по Маслоу
Иерархия потребностей по Маслоу Понятие международного частного права. (Тема 1)
Понятие международного частного права. (Тема 1) Растяжение и сжатие
Растяжение и сжатие Презентация "Музеи мира" - скачать презентации по МХК
Презентация "Музеи мира" - скачать презентации по МХК Презентация на тему "Здоровый образ жизн" - скачать презентации по Медицине
Презентация на тему "Здоровый образ жизн" - скачать презентации по Медицине Золотые травы Хохломы.
Золотые травы Хохломы. Задание В4.
Задание В4. Самые известные православные храмы России
Самые известные православные храмы России Практические инструменты работы с мотивацией сотрудников Александр Орлов, Happy-PM.com
Практические инструменты работы с мотивацией сотрудников Александр Орлов, Happy-PM.com Лекция 1
Лекция 1 Новогодний калейдоскоп - презентация для начальной школы
Новогодний калейдоскоп - презентация для начальной школы психологический климат
психологический климат Основы алгоритмизации
Основы алгоритмизации Презентация на тему "Структура органа ученического самоуправления ГОРОД «ДОБРОГРАД»" - скачать презентации по Педагогике
Презентация на тему "Структура органа ученического самоуправления ГОРОД «ДОБРОГРАД»" - скачать презентации по Педагогике Дайджест по расходам ОПБОТ и ОС
Дайджест по расходам ОПБОТ и ОС Презентация на тему "Спортивно-оздоровительное направление" - скачать презентации по Педагогике
Презентация на тему "Спортивно-оздоровительное направление" - скачать презентации по Педагогике Индивидуальная олимпиада по информатике и программированию. Очный тур
Индивидуальная олимпиада по информатике и программированию. Очный тур Урок окружающего мира в 4 классе «Америка» (программа Л.В.Занкова ) Из опыта работы учителя начальных классов МОУ СОШ № 20 г.Орех
Урок окружающего мира в 4 классе «Америка» (программа Л.В.Занкова ) Из опыта работы учителя начальных классов МОУ СОШ № 20 г.Орех лекция 2 ИТ в лингв
лекция 2 ИТ в лингв http://www.kit-sibstu.ru Программа развития кафедры информационных технологий на 2012 – 2016 годы Г.М. Рудакова
http://www.kit-sibstu.ru Программа развития кафедры информационных технологий на 2012 – 2016 годы Г.М. Рудакова