Содержание
- 2. Процессы, заключающиеся в превращении одной фазы данного вещества в другую фазу того же вещества и, следовательно,
- 3. Фаза - однородная часть гетерогенной системы, которая имеет границу раздела и может быть отделена от общей
- 4. Правило фаз Гиббса Компонентом называют независимую часть физической системы, имеющую свою химическую формулу. Компоненты образуют всю
- 5. Примеры применения правила фаз Гиббса 1. Имеется однокомпонентная система (чистый металл) (К=1), находящаяся в одной фазе
- 6. Плавление, кристаллизация Отрицательные температуры: Т (водород, кислород, азот) Легкоплавкие (0-500°С) (вода, висмут, олово, индий, свинец) Средние
- 7. Виды измерителей Термопара, термометр, биметаллический термометр, пирометр
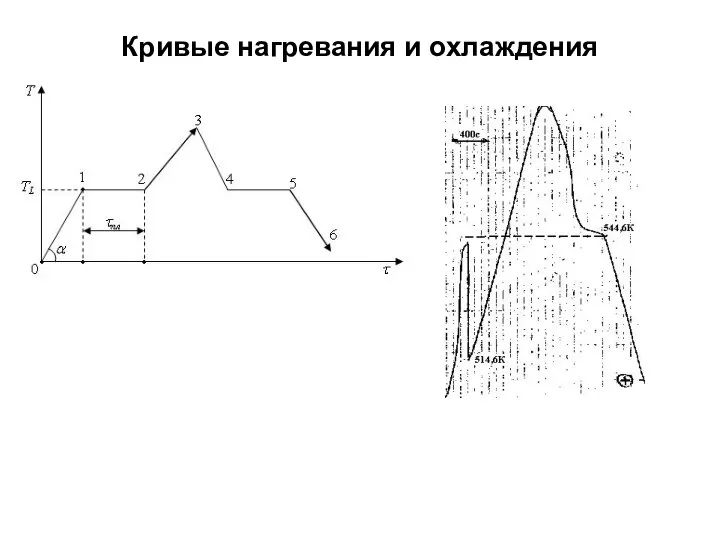
- 8. Кривые нагревания и охлаждения
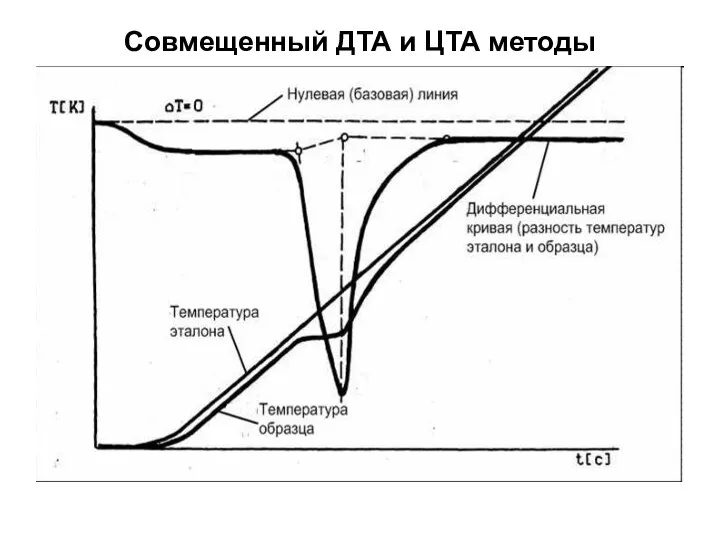
- 9. Совмещенный ДТА и ЦТА методы
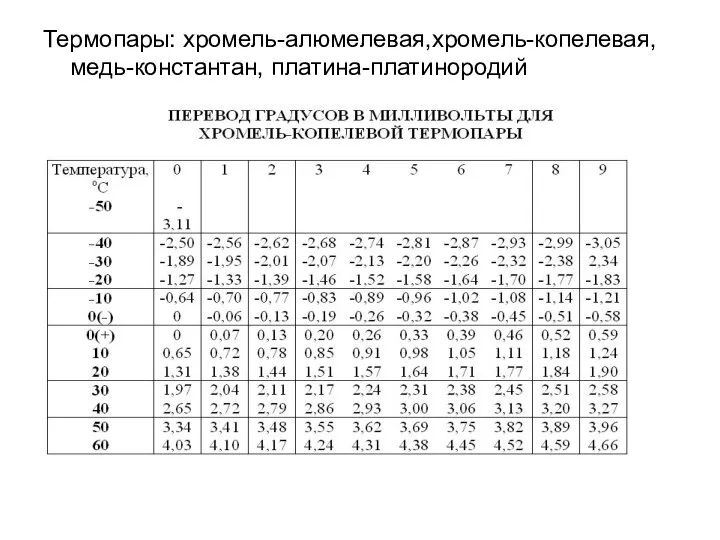
- 10. Термопары: хромель-алюмелевая,хромель-копелевая, медь-константан, платина-платинородий
- 11. Фазовые превращения в твердом состоянии Изоморфизм - полное подобие атомно-кристаллического строения и внешней огранки кристаллов у
- 13. Скачать презентацию







 Анализ кадровой политики ОАО «РУСАЛ-ИркАЗ»
Анализ кадровой политики ОАО «РУСАЛ-ИркАЗ» Герман Гельмгольц
Герман Гельмгольц  Йога. Позы йоги
Йога. Позы йоги Александр Иванов
Александр Иванов Институт налоговой ответственности
Институт налоговой ответственности Брендбук вашего личного бренда
Брендбук вашего личного бренда Система визуального объектно-ориентированного программирования Delphi. Компонент MainMenu. (Лекция 35)
Система визуального объектно-ориентированного программирования Delphi. Компонент MainMenu. (Лекция 35) Борьба с коррупцией в Казахстане
Борьба с коррупцией в Казахстане Разработка GUI на Java
Разработка GUI на Java Презентация Сохранение качества и количества товаров
Презентация Сохранение качества и количества товаров Теоретические основы построения системы технической эксплуатации линейных сооружений связи
Теоретические основы построения системы технической эксплуатации линейных сооружений связи Поверхность и контактные явления. Диод Шоттки
Поверхность и контактные явления. Диод Шоттки «Труд: право или обязанность (трудовые права несовершеннолетних)»
«Труд: право или обязанность (трудовые права несовершеннолетних)»  Двумерные массивы
Двумерные массивы Кодирование графической информации
Кодирование графической информации Опыты Франка-Герца
Опыты Франка-Герца  ЕГЭ по истории. Часть C
ЕГЭ по истории. Часть C  Останкинская телебашня
Останкинская телебашня Сумма бесконечной геометрической прогрессии
Сумма бесконечной геометрической прогрессии Юридический смысл понятия брака
Юридический смысл понятия брака Масленица
Масленица Управление качеством в строительстве. Часть III. Некоторые аспекты развития методов управления качеством
Управление качеством в строительстве. Часть III. Некоторые аспекты развития методов управления качеством Системы массового обслуживания (СМО)
Системы массового обслуживания (СМО) Языки и цепочки символов
Языки и цепочки символов Платформа «Центр управления M2M»
Платформа «Центр управления M2M» Процесс обучения сетевого и системного администратора
Процесс обучения сетевого и системного администратора Телевизор
Телевизор Классификация зданий. Требования, предъявляемые к зданиям
Классификация зданий. Требования, предъявляемые к зданиям