Содержание
- 2. Гидрогеохимия (геохимия подземных вод) - это раздел гидрогеологии, который изучает химический состав гидросферы и протекающие в
- 3. Формы подземной воды в недрах: 1. Свободные воды. Наиболее изученные формы подземных вод. Они занимают пустоты,
- 4. Формы подземной воды в недрах: 2. Поровые воды. Под поровыми водами (растворами) понимаются воды, насыщающие поры
- 5. Три типа взаимоотношения между поровыми и пластовыми водами: 1. Поровые воды более концентрированы, чем пластовые, принимают
- 6. Формы подземной воды в недрах: 3. Связанные воды. Взаимодействие твердых минеральных частиц с водой или водными
- 7. 1. Молекулярная адсорбция. 2. Полимолекулярная адсорбция. 3. Поверхностно-осмотический переток воды. 4. Капиллярное впитывание.
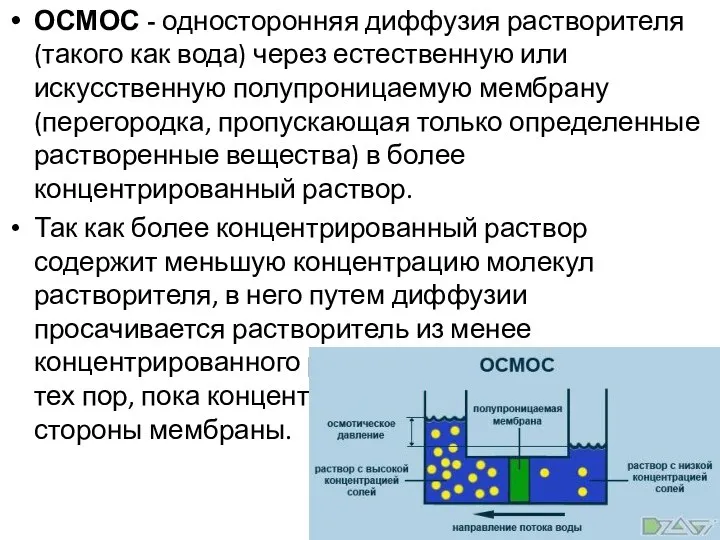
- 8. ОСМОС - односторонняя диффузия растворителя (такого как вода) через естественную или искусственную полупроницаемую мембрану (перегородка, пропускающая
- 9. Классификация форм связанной воды в породах: 1. Вода, связанная в кристаллической структуре минералов. 2. Вода, адсорбционно-связанная
- 10. Состав подземных вод Природные воды – сложные водные растворы (В.И.Вернадский). В их составе выделяются: макро- и
- 12. Природные воды по величине минерализации (г/кг) делят на следующие группы: 1. Пресные ( 2. Солоноватые (1-25).
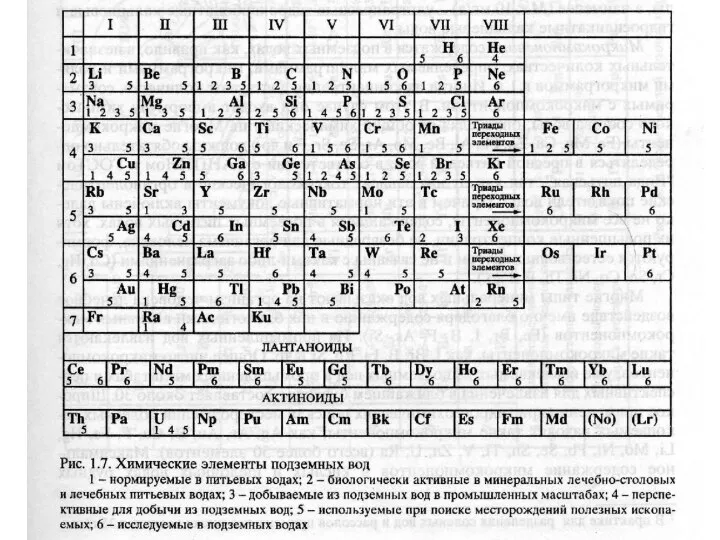
- 13. Состав растворенных в подземных водах природных соединений определяется прежде всего составом литосферы и распространенностью отдельных составляющих
- 14. Микрокомпоненты – содержатся в подземных водах, как правило, в незначительных количествах, определяемых мг, мкг и долями
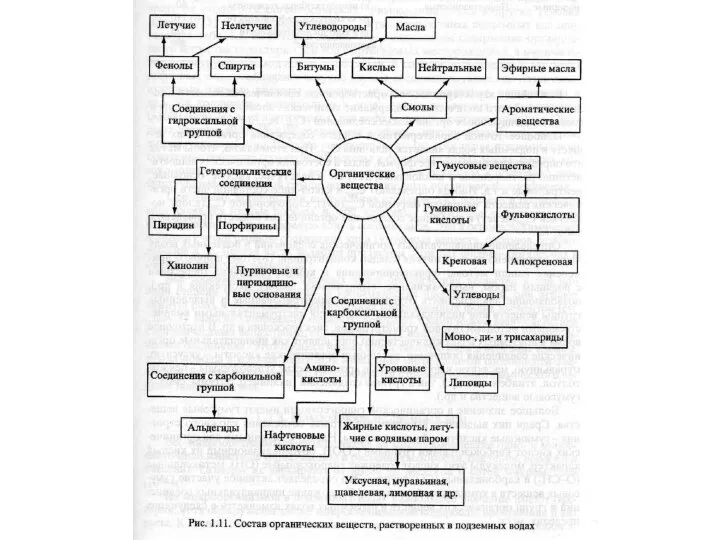
- 15. Органические вещества В подземных водах содержится широкая гамма органических соединений. Компонентами органических веществ являются представители всех
- 18. Микрофлора подземных вод Все микроорганизмы подразделяются на микроскопические одно- и многоклеточные животные (простейшие) и растения (водоросли,
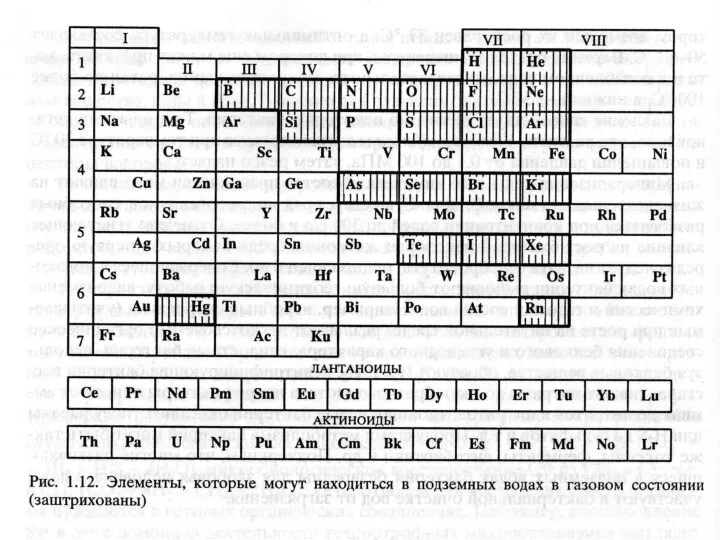
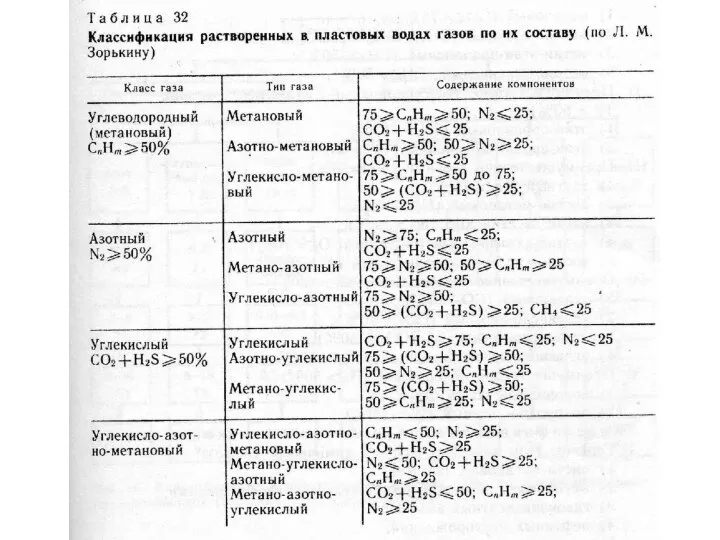
- 19. Газы Газы и вода находятся в постоянном обмене. Различают сорбированные, растворенные и свободные газы. Основными газами
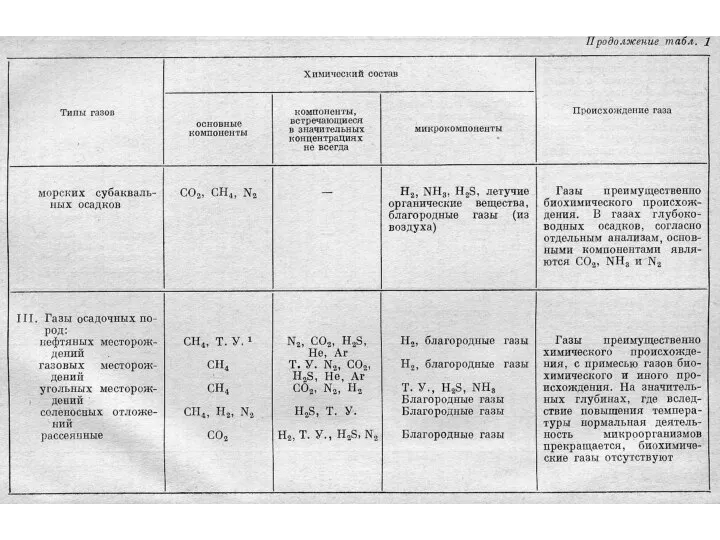
- 21. Происхождение газов в подземной воде воздушные (N2, O2, CO2, Ne, Ar), проникающие в литосферу из атмосферного
- 22. Выражение химического состава воды Формула М.Г. Курлова (1921г.), «Опыт классификации сибирских целебных минеральных вод» вариант И.Ю.
- 23. Выражение химического состава воды в псевдодробь записываются в нисходящем порядке все катионы (в знаменателе) и анионы
- 24. Выражение химического состава воды Грамм-эквивалент - масса вещества в граммах, умноженную на молярную массу вещества. Процент-эквивалент
- 25. Формула солевого состава - формула Курлова, где указываются ионы, содержание которых более 5-10 %-экв. S -
- 26. ГЕОХИМИЯ АТМОСФЕРЫ 1966 1990
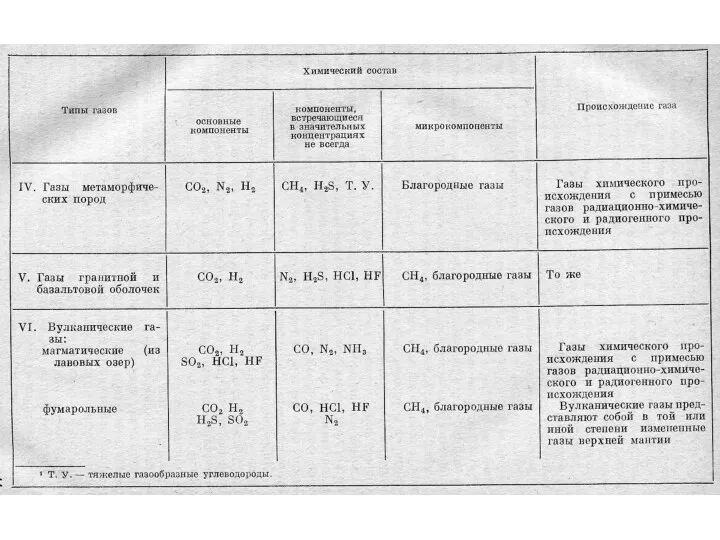
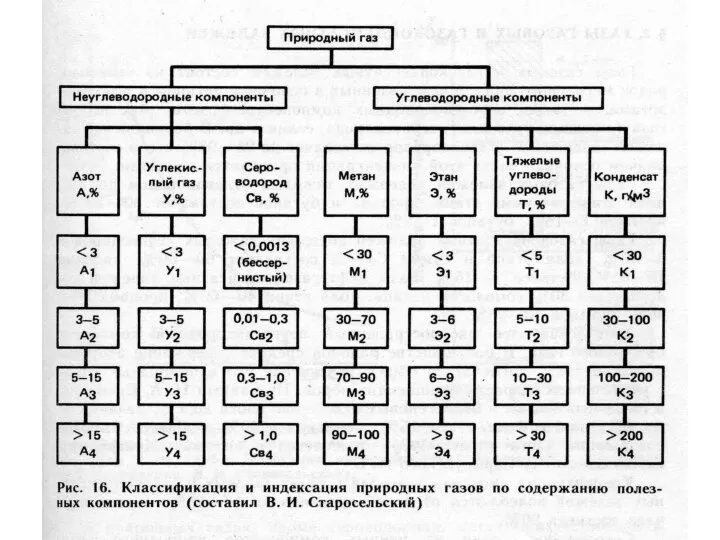
- 27. Классификации природных газов Газы атмосферы Газы гидросферы Газы литосферы (растворенные в воде и свободные, сорбированные минералами
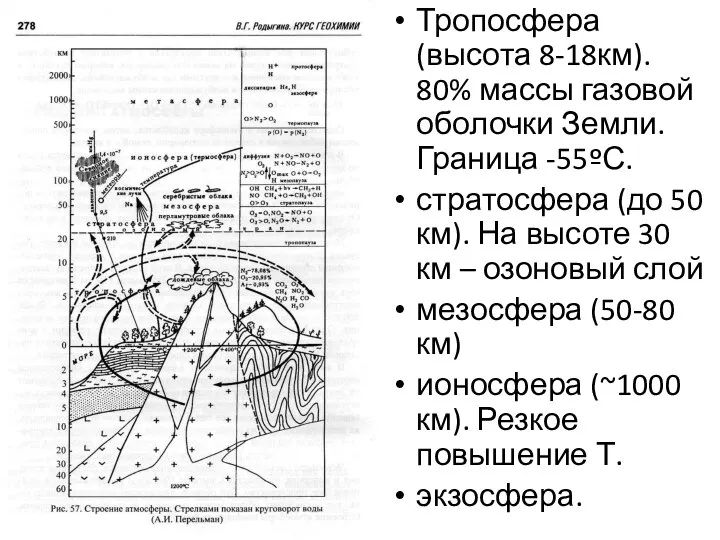
- 28. Атмосфера – газовая оболочка Земли мощностью 20 тыс. км и массой около 1015 т. Азот –
- 29. Тропосфера (высота 8-18км). 80% массы газовой оболочки Земли. Граница -55ºС. стратосфера (до 50 км). На высоте
- 30. Древняя газовая оболочка Земли была маломощной и состояла из CO2, H2O, возможно CH4 и др. газов.
- 31. Источником CO2 (а также следов HF, HCl и др.) являются тоже вулканы. На содержание в атмосфере
- 32. Азот фиксируется синезелёными водорослями и некоторыми др. растениями. После их гибели в результате метаморфизма их остатков
- 33. По составу более 20 схем классификации
- 39. Газовые проявления Вулканические газы по качеств. составу и Т условно подразделяются на: галогенокислотные (высоко-Т фумаролы); сернистые
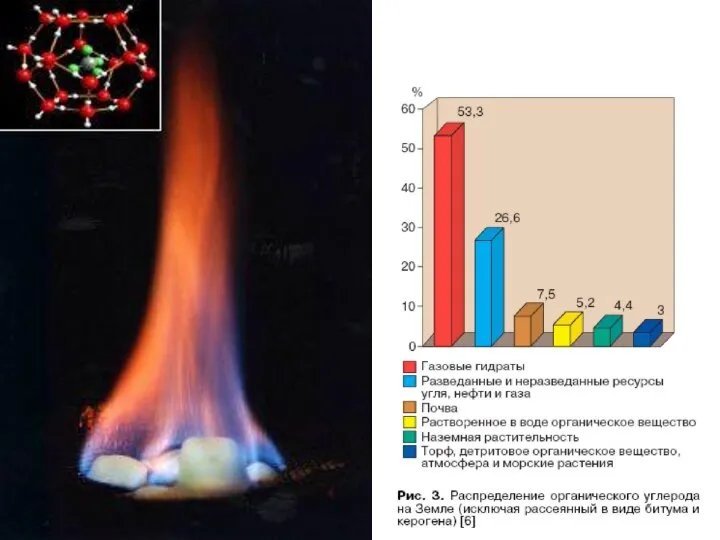
- 41. ГАЗОВЫЕ ГИДРАТЫ Гидраты природных газов — газовые гидраты или клатраты — кристаллические соединения, образующиеся при определённых
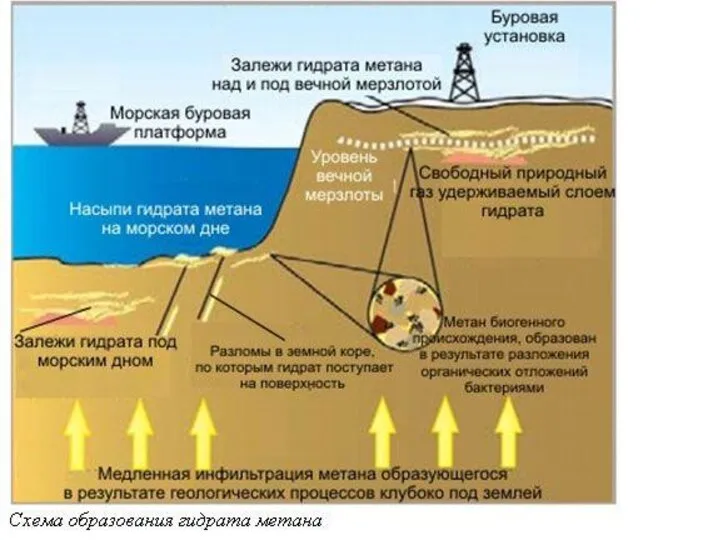
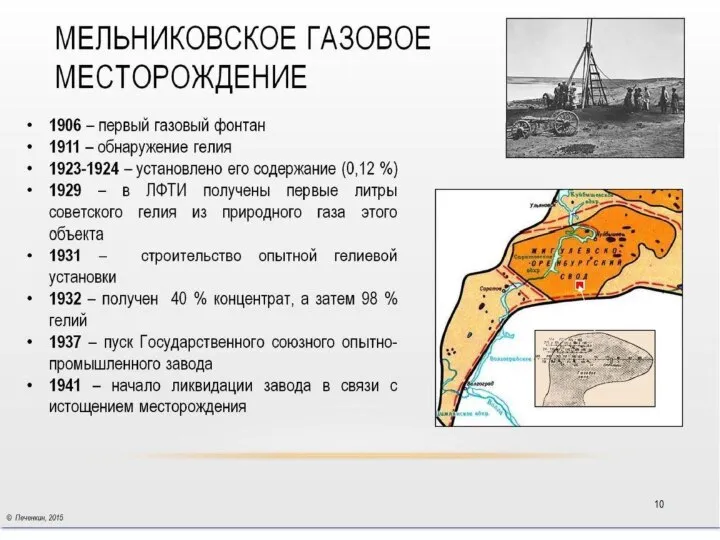
- 42. В 1940-е годы советские учёные высказывают гипотезу о наличии залежей газовых гидратов в зоне вечной мерзлоты.
- 45. Гидрат метана – газовое топливо будущего По прогнозам экспертов ExxonMobil, потребление энергоресурсов в ближайшие 30 лет
- 46. Во-первых, технологии добычи нефти и газа развиваются. Сегодня в Мексиканском заливе, например, нефть добывают с глубины
- 47. Третье направление поддержания уровня добычи углеводородов связано с поиском путей использования нетрадиционных их видов. Среди перспективных
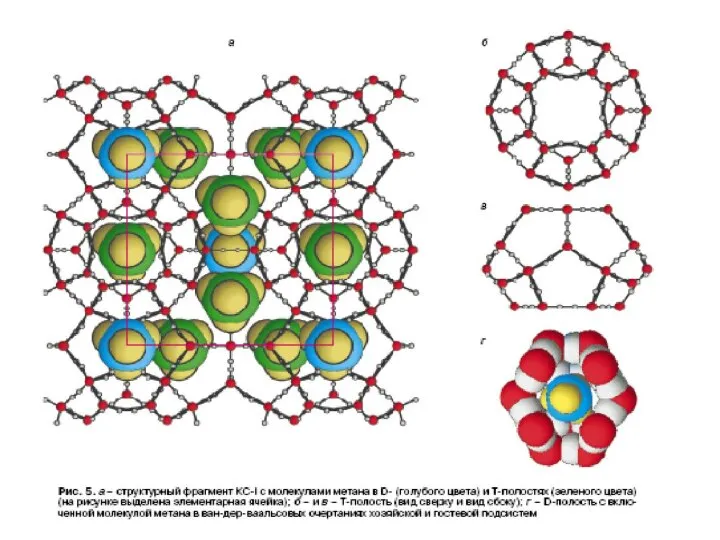
- 48. Гидрат метана это супрамолекулярное соединение метана с водой. Вокруг молекулы метана образуется решетка молекул воды (льда).
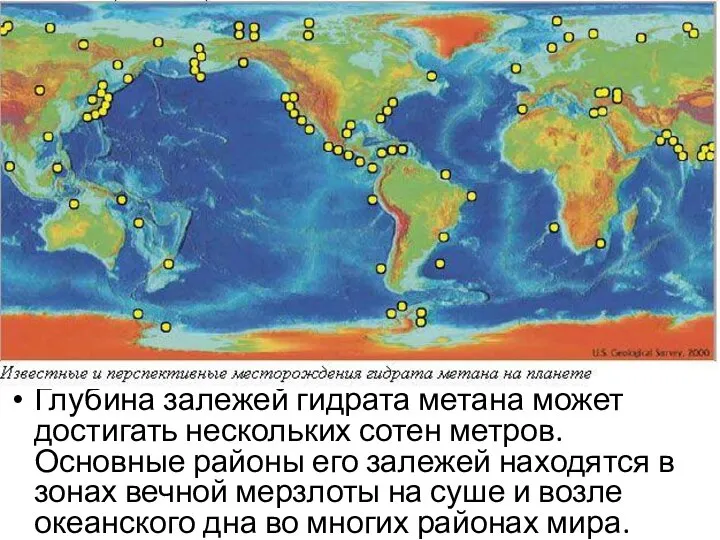
- 50. Глубина залежей гидрата метана может достигать нескольких сотен метров. Основные районы его залежей находятся в зонах
- 77. Скачать презентацию



























































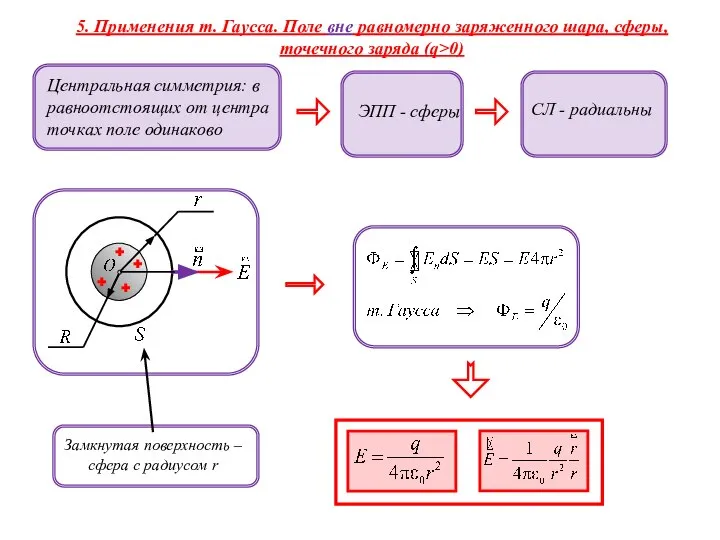 Применения т. Гаусса
Применения т. Гаусса Нормативное регулирование аудиторской деятельности в РФ
Нормативное регулирование аудиторской деятельности в РФ  Уголовно-процессуальное право в системе РФ
Уголовно-процессуальное право в системе РФ Красота в архитектуре
Красота в архитектуре CSS-трансформации
CSS-трансформации  Принципи побудови автоматизованих систем контролю та діагностики
Принципи побудови автоматизованих систем контролю та діагностики Празднование масленицы
Празднование масленицы Биографические сведения о Франце Боппе, выдающемся германисте, европеисте
Биографические сведения о Франце Боппе, выдающемся германисте, европеисте ПРИЕМЫ АВТОЗАПОЛНЕНИЕ, АВТОСУММИРОВАНИЕ
ПРИЕМЫ АВТОЗАПОЛНЕНИЕ, АВТОСУММИРОВАНИЕ Развитие двигательных способностей
Развитие двигательных способностей  Типы композиции. Средства композиции
Типы композиции. Средства композиции Сборная Бразилии
Сборная Бразилии Международное разделение труда как основа мирового хозяйства
Международное разделение труда как основа мирового хозяйства Курсовой проект. Жилой дом на две семьи
Курсовой проект. Жилой дом на две семьи Проблемы связанные с оценкой и реализацией ИННОВАЦИОННЫХ ПРОЕКТОВ
Проблемы связанные с оценкой и реализацией ИННОВАЦИОННЫХ ПРОЕКТОВ ФОРМИРОВАНИЕ И СОХРАНЕНИЕ ПОТРЕБИТЕЛЬСКИХ СВОЙСТВ МЕДИЦИНСКИХ И ФАРМАЦЕВТИЧЕСКИХ ТОВАРОВ
ФОРМИРОВАНИЕ И СОХРАНЕНИЕ ПОТРЕБИТЕЛЬСКИХ СВОЙСТВ МЕДИЦИНСКИХ И ФАРМАЦЕВТИЧЕСКИХ ТОВАРОВ Многофункциональные биомолекулы
Многофункциональные биомолекулы ВЕЩЕСТВО, НЕОБХОДИМОЕ ДЛЯ ЖИЗНИ. ВОЗДУХ.
ВЕЩЕСТВО, НЕОБХОДИМОЕ ДЛЯ ЖИЗНИ. ВОЗДУХ. Игровое занятие по теме: «Калейдоскоп»
Игровое занятие по теме: «Калейдоскоп» Возникновение физической культуры
Возникновение физической культуры Работа с базой PHP MYSQL
Работа с базой PHP MYSQL Совместное макроэкономическое равновесие товарного и денежного рынков
Совместное макроэкономическое равновесие товарного и денежного рынков Сагаан hараар. С праздником белого месяца
Сагаан hараар. С праздником белого месяца ИСКУССТВО ХОХЛОМЫ
ИСКУССТВО ХОХЛОМЫ Некоторые сходства и различия лексики английского и немецкого языков
Некоторые сходства и различия лексики английского и немецкого языков - Понятие, система и значение принципов уголовного процесса. - Подготовил студент 3 курса Юридического факультета Группы ю-123б
- Понятие, система и значение принципов уголовного процесса. - Подготовил студент 3 курса Юридического факультета Группы ю-123б  Технологические машины - гексаподы
Технологические машины - гексаподы Урок_1
Урок_1