Содержание
- 2. 1993 2004
- 3. 1989 2006
- 4. 1977 1973
- 5. Гидросферу как геосферу принято понимать в узком и широком смысле слова. Гидросфера (в узком смысле слова)
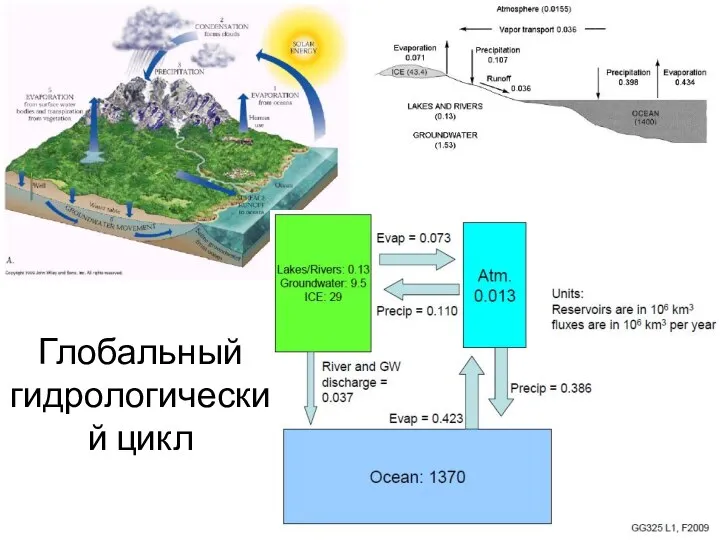
- 7. Глобальный гидрологический цикл
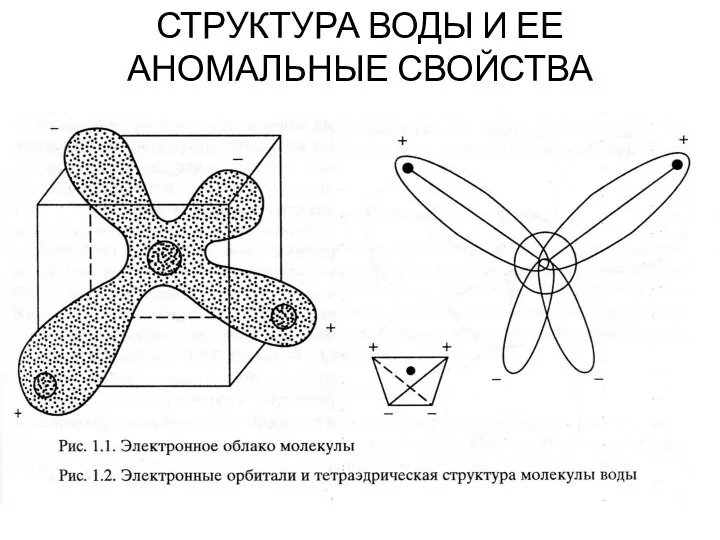
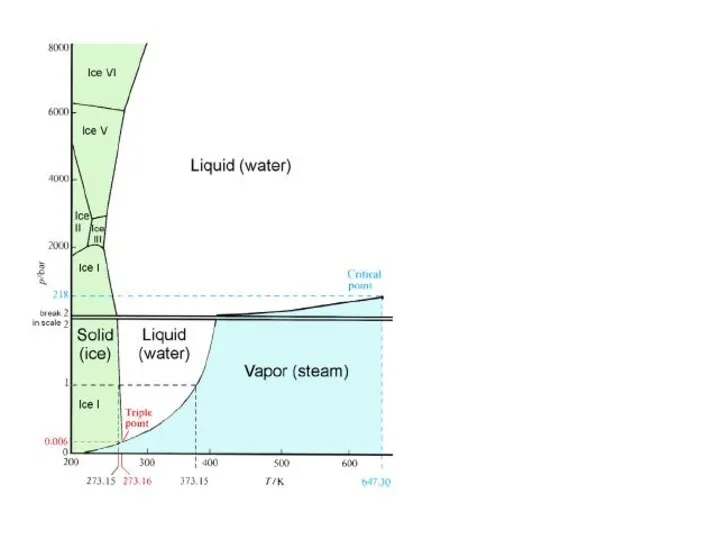
- 8. СТРУКТУРА ВОДЫ И ЕЕ АНОМАЛЬНЫЕ СВОЙСТВА
- 9. С современных позиций форму молекулы воды H2O можно представить в виде электронного облака: атом кислорода расположен
- 10. Молекула воды чрезвычайно устойчива, так как атомы кислорода и водорода связаны между собой ковалентно (Н-О). Распределение
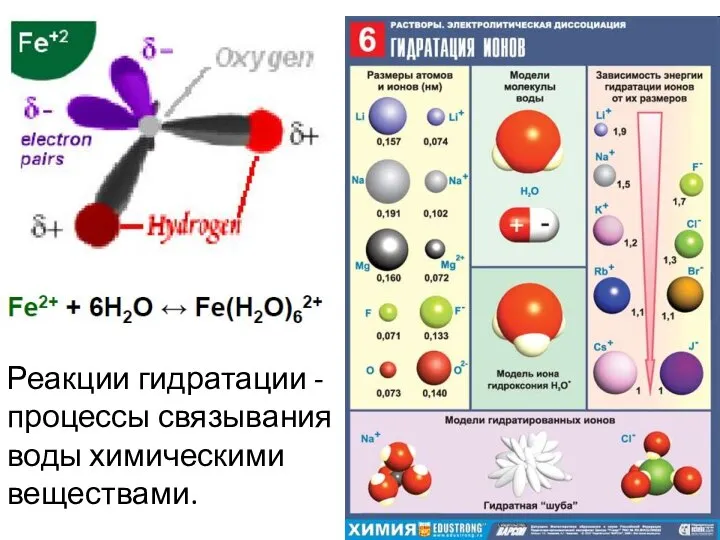
- 12. Реакции гидратации - процессы связывания воды химическими веществами.
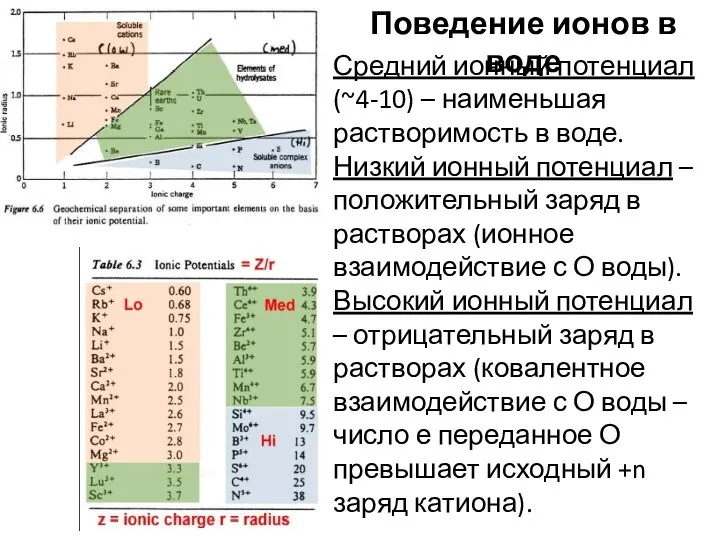
- 13. Поведение ионов в воде Средний ионный потенциал (~4-10) – наименьшая растворимость в воде. Низкий ионный потенциал
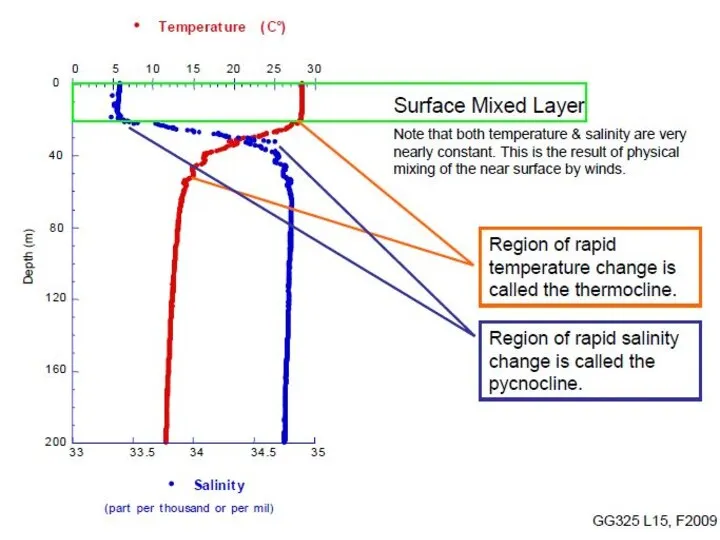
- 14. Вода находится в постоянном движении: испарение с поверхности открытых бассейнов, речной сток, конденсация, гидротермальная деятельность, участие
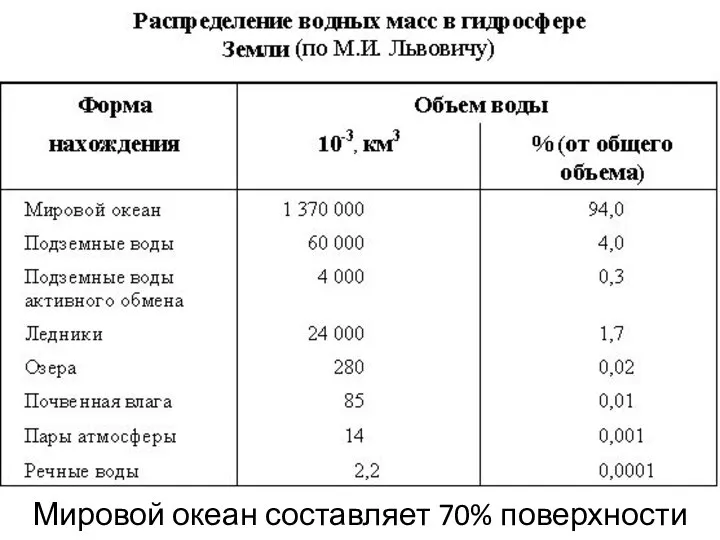
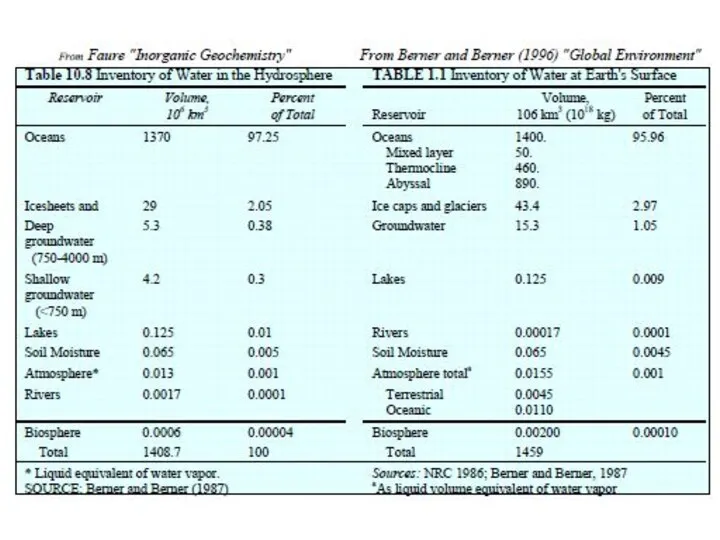
- 15. Мировой океан составляет 70% поверхности Земли
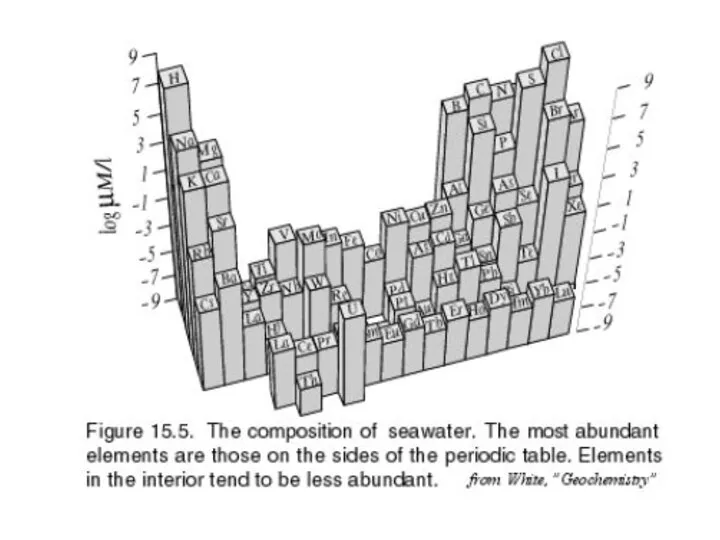
- 17. Средний состав гидросферы можно отождествить со средним составом океанической морской воды, одним из самых важных свойств
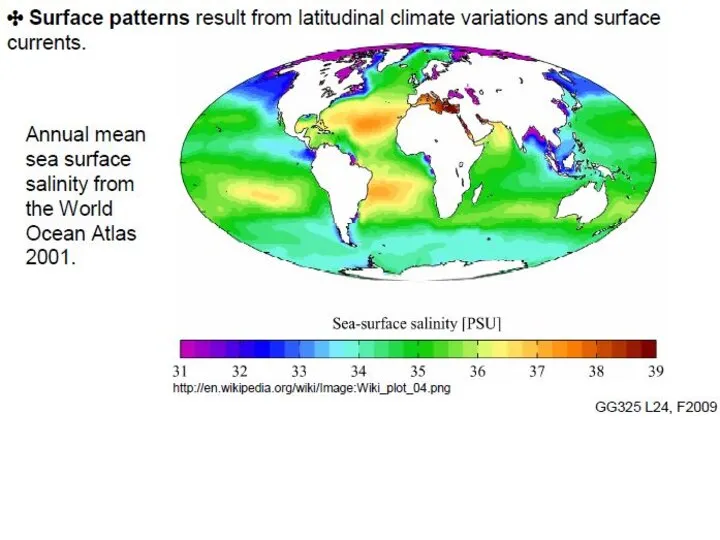
- 18. Пропорции основных компонентов в морской воде постоянны, поэтому соленость можно определить по хлорности, средняя величина которой
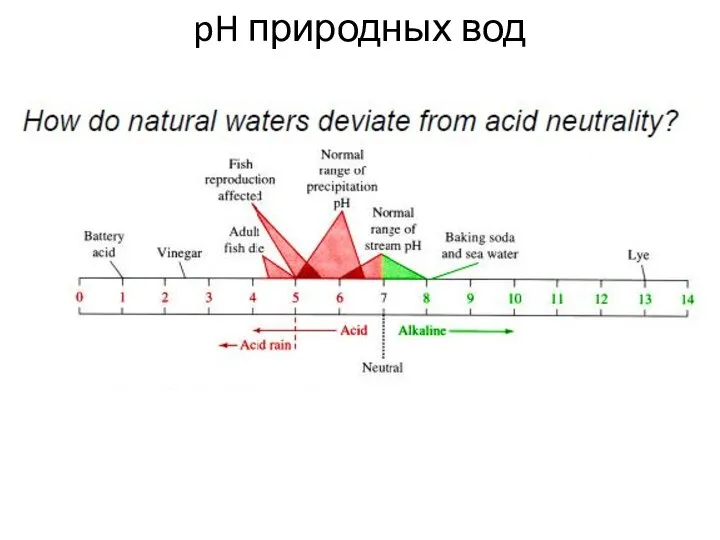
- 19. pH природных вод
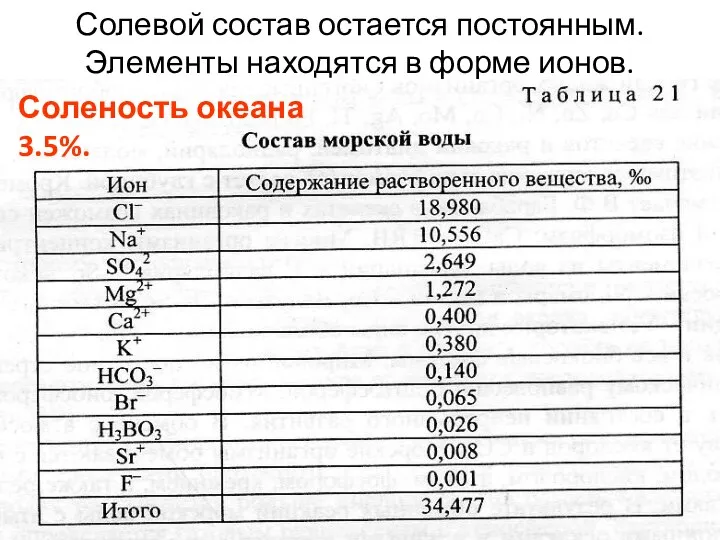
- 20. Солевой состав остается постоянным. Элементы находятся в форме ионов. Соленость океана 3.5%.
- 23. Океаническая вода (pH 8.2-8.5) имеет щелочной характер. Многие катионы быстро гидролизуются и выпадают в осадок. Многие
- 24. В процессе фотосинтеза поверхностные слои воды обогащаются кислородом и обедняются углекислотой, а живущие там организмы способны
- 25. Многие организмы концентрируют микроэлементы из воды: ламинарии – J радиолярии – Sr некоторые моллюски – Ni
- 26. В результате обменных реакций морской воды с атмосферой, донными осадками и с живыми организмами устанавливается существующая
- 27. Содержание свободного кислорода в океане также определяется биогенными процессами (фотосинтез, дыхание) и температурой: в холодных водах
- 28. Азот в океан поступает преимущественно из атмосферы в виде свободного азота N2, а также NH3, NO2-
- 29. Сероводород представлен малыми концентрациями в морях открытого типа, однако в замкнутых водоемах и на больших глубинах
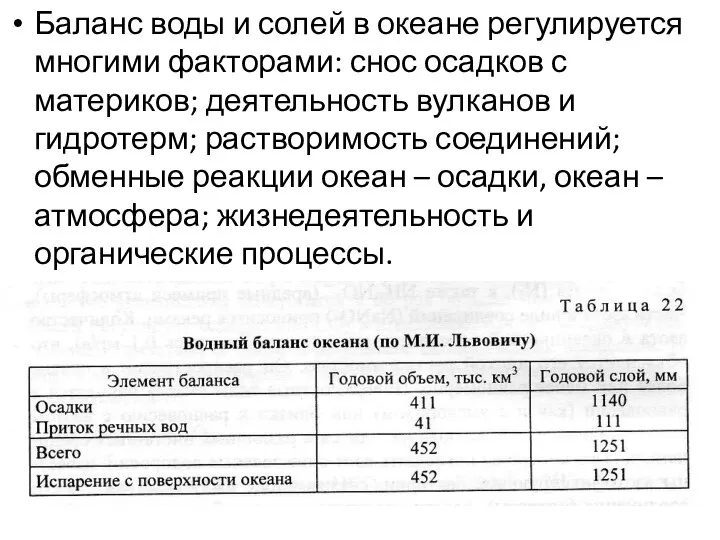
- 30. Баланс воды и солей в океане регулируется многими факторами: снос осадков с материков; деятельность вулканов и
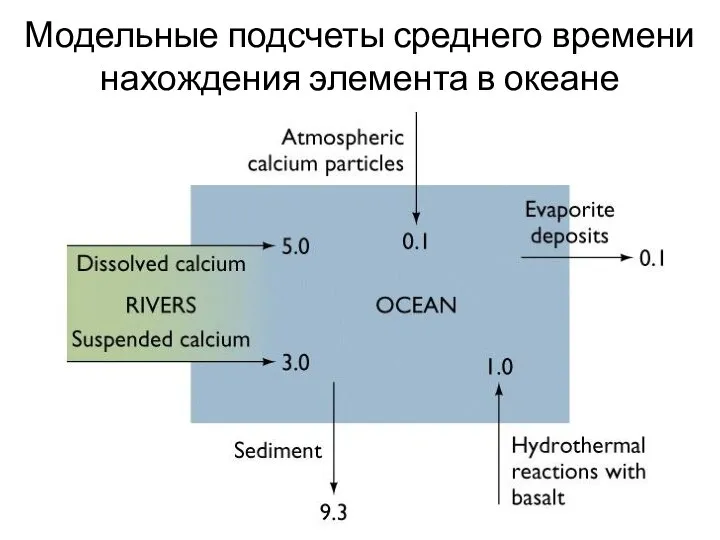
- 31. Модельные подсчеты среднего времени нахождения элемента в океане
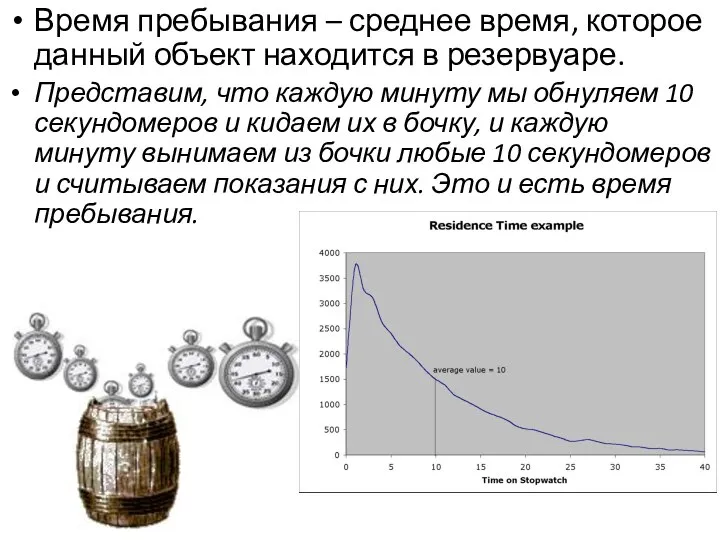
- 32. Время пребывания – среднее время, которое данный объект находится в резервуаре. Представим, что каждую минуту мы
- 33. Если считать состав воды океана постоянным, то можно определить время пребывания каждого элемента в океане условно
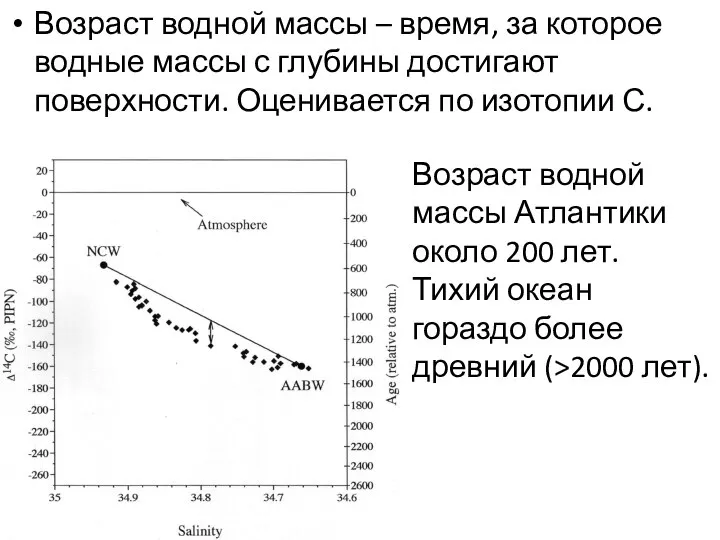
- 34. Возраст водной массы – время, за которое водные массы с глубины достигают поверхности. Оценивается по изотопии
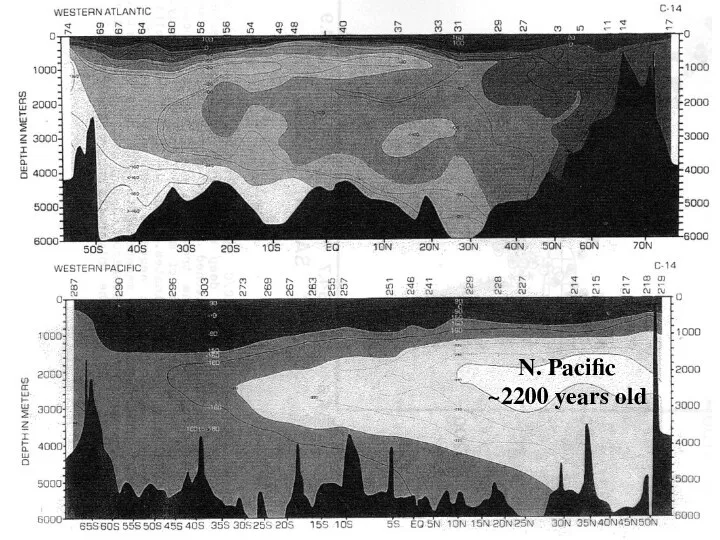
- 35. N. Pacific ~2200 years old
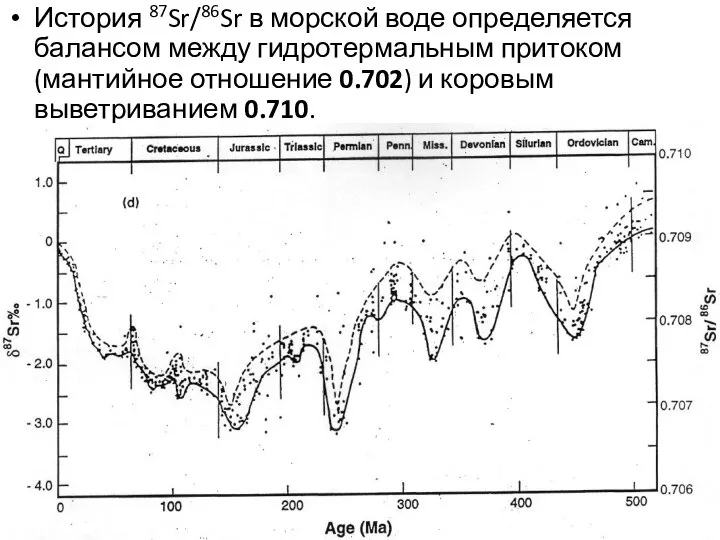
- 36. История 87Sr/86Sr в морской воде определяется балансом между гидротермальным притоком (мантийное отношение 0.702) и коровым выветриванием
- 37. Химия океана Элементы могут быть разделены на три группы по их поведению в океанической воде. 1.
- 38. 3. «Удаляемые» элементы (Mn, Pb и др.) – содержание больше на поверхности. Удаляются из морской воды
- 40. Происхождение гидросферы Вероятно, гидросфера образовалась одновременно с литосферой и атмосферой в результате остывания и дегазации вещества
- 41. Пресная вода на суше – результат прохождения океанской воды через атмосферу. Выделение воды из магмы продолжается
- 42. Материковые (наземные) воды Воды рек, озер, болот, ледниковые, подземные, а также термальные воды вулканических областей. С
- 43. Три основные геохимические обстановки наземных вод: окислительная (кислородная), глеевая и сероводородная. На геохимических барьерах водоносных горизонтов
- 44. Основной источник вод суши – атмосферные осадки и седиментационные. Также магматогенные и интрателлурические.
- 45. Химический состав материковых или подземных вод, в отличие от морской воды, довольно разнообразен: морская вода: Na>Mg>Ca;
- 46. Средняя соленость, степень минерализации (по содержанию ионов мг/л) речных вод изменяется в пределах: 50-200 – малая
- 47. Соотношение Eh и pH вод определяется степенью минерализации
- 48. Сильно кислые воды (pH Кислые воды (pH~3-6.5) – в гумидных зонах с равнинным рельефом и болотами.
- 49. Нейтральные, слабощелочные, пресные воды (маломинерализованные) распространены очень широко (pH~6.5-8.5). По ионному составу это воды гидрокарбонатно-кальциевые (HCO3-
- 51. Скачать презентацию






























 Презентация на тему "Стадии когнитивного развития по Пиаже" - скачать презентации по Медицине
Презентация на тему "Стадии когнитивного развития по Пиаже" - скачать презентации по Медицине Педагогический совет по теме: Федеральный государственный стандарт начального общего образования: актуальные вопросы введения.
Педагогический совет по теме: Федеральный государственный стандарт начального общего образования: актуальные вопросы введения. Первая медицинская помощь
Первая медицинская помощь Нарушения теплового баланса организма
Нарушения теплового баланса организма Методические рекомендации по составлению рабочей программы
Методические рекомендации по составлению рабочей программы Разработка системы управления давлением в шинах под управлением бортового компьютера в различных дорожных условиях
Разработка системы управления давлением в шинах под управлением бортового компьютера в различных дорожных условиях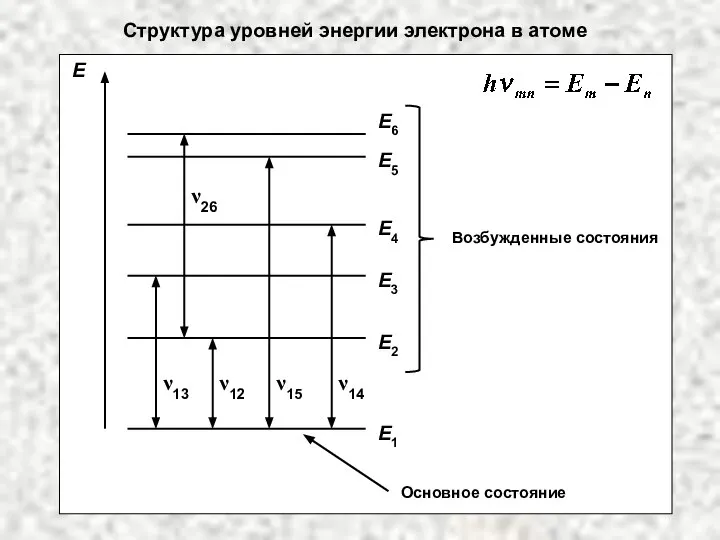 Структура уровней энергии электрона в атоме
Структура уровней энергии электрона в атоме  ВКР «Электроснабжение СПК «Жерелево» Калужской области с применением на подстанции устройств телемеханики»
ВКР «Электроснабжение СПК «Жерелево» Калужской области с применением на подстанции устройств телемеханики» Русские Писатели
Русские Писатели  Презентация "Символика Древнего Египта" - скачать презентации по МХК
Презентация "Символика Древнего Египта" - скачать презентации по МХК Интегро-дифференциальные уравнения
Интегро-дифференциальные уравнения Стекло — вещество и материал, один из самых древних и, благодаря разнообразию своих свойств, — универсальный в практике чело
Стекло — вещество и материал, один из самых древних и, благодаря разнообразию своих свойств, — универсальный в практике чело Как нарисовать зайца? Поэтапное рисование
Как нарисовать зайца? Поэтапное рисование Процессы управления проектами PDCA. Группы процессов управления проектами. Группа процессов инициации
Процессы управления проектами PDCA. Группы процессов управления проектами. Группа процессов инициации Миссионерская деятельность
Миссионерская деятельность Жилища в Австралии
Жилища в Австралии Право Нового времени
Право Нового времени Текущее состояние централизованной системы противоаварийного управления ОЭС Сибири
Текущее состояние централизованной системы противоаварийного управления ОЭС Сибири Жилая среда
Жилая среда Разработка технической документации на установку, настройку и техническую эксплуатацию портативного маршрутизатора TP-linkM7350
Разработка технической документации на установку, настройку и техническую эксплуатацию портативного маршрутизатора TP-linkM7350 Презентация на тему: «Гражданская правосубъектность физических лиц: анализ законодательства, теории и практики»
Презентация на тему: «Гражданская правосубъектность физических лиц: анализ законодательства, теории и практики» Разработка алгоритмов и программ сверху вниз
Разработка алгоритмов и программ сверху вниз Презентация на тему "Педагогічна рада 31.12.2014" - скачать презентации по Педагогике
Презентация на тему "Педагогічна рада 31.12.2014" - скачать презентации по Педагогике Курс по выбору «Алгебраический тренажёр»
Курс по выбору «Алгебраический тренажёр» Развитие вычислительной техники
Развитие вычислительной техники Выборы. O Выборы депутатов Государственной думы
Выборы. O Выборы депутатов Государственной думы Транспортная задача линейного программирования
Транспортная задача линейного программирования Системы хранения данных (СХД). Перспективы развития. (Лекция 13)
Системы хранения данных (СХД). Перспективы развития. (Лекция 13)