Содержание
- 2. Мультифункціональні біомолекули Молекули, що змінюють хімічні властивості під зовнішнім фізичним впливом Молекули, що використовуються для надання
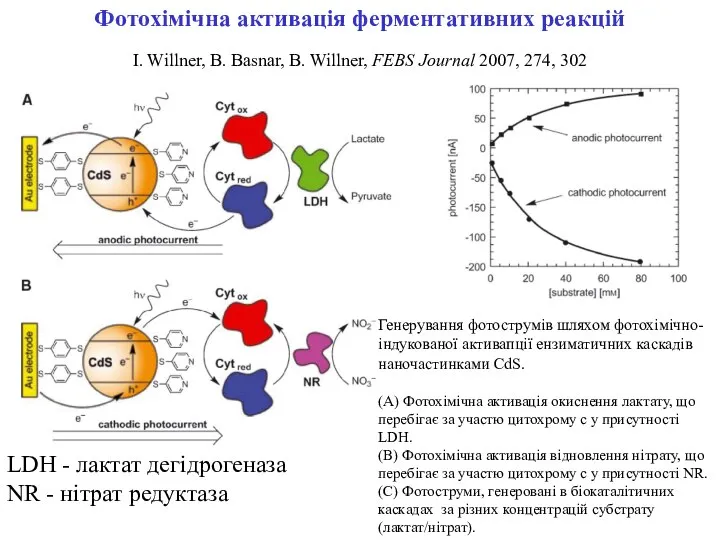
- 3. Фотохімічна активація ферментативних реакцій I. Willner, B. Basnar, B. Willner, FEBS Journal 2007, 274, 302 Генерування
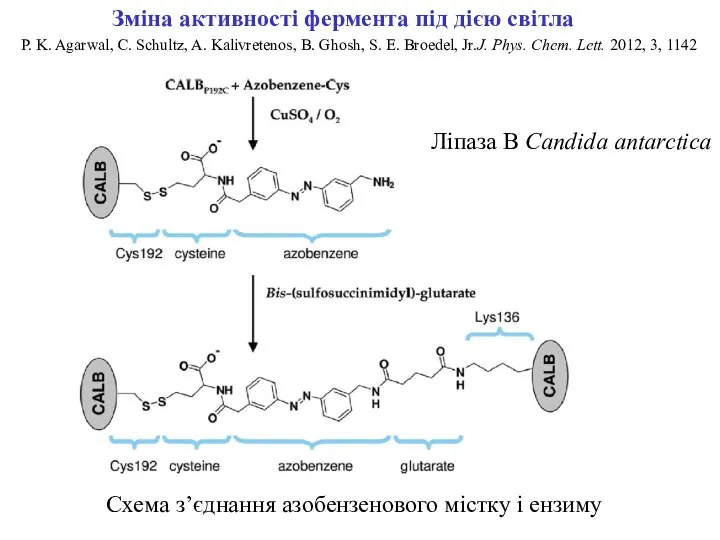
- 4. P. K. Agarwal, C. Schultz, A. Kalivretenos, B. Ghosh, S. E. Broedel, Jr.J. Phys. Chem. Lett.
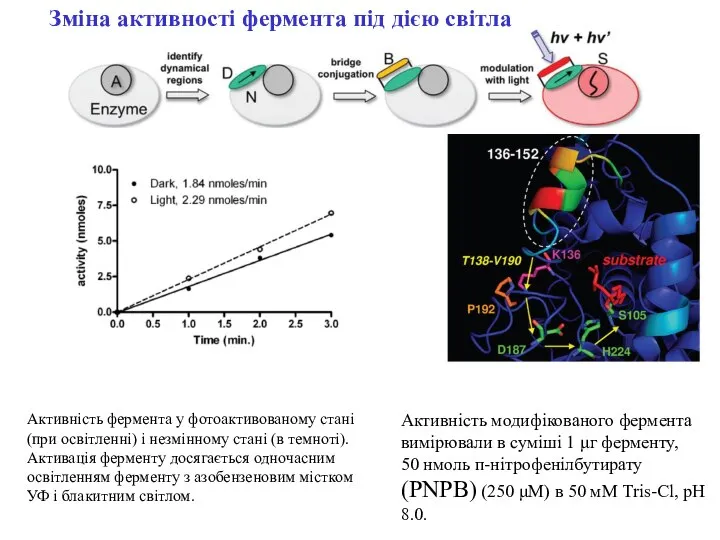
- 5. Активність фермента у фотоактивованому стані (при освітленні) і незмінному стані (в темноті). Активація ферменту досягається одночасним
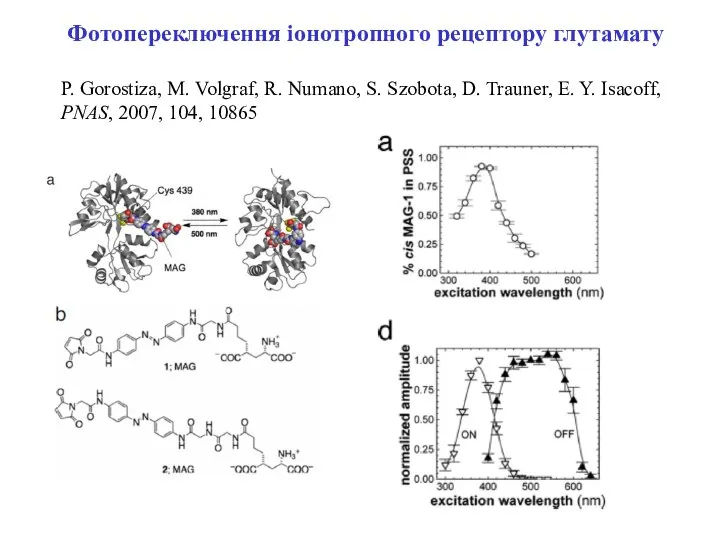
- 6. Фотопереключення іонотропного рецептору глутамату P. Gorostiza, M. Volgraf, R. Numano, S. Szobota, D. Trauner, E. Y.
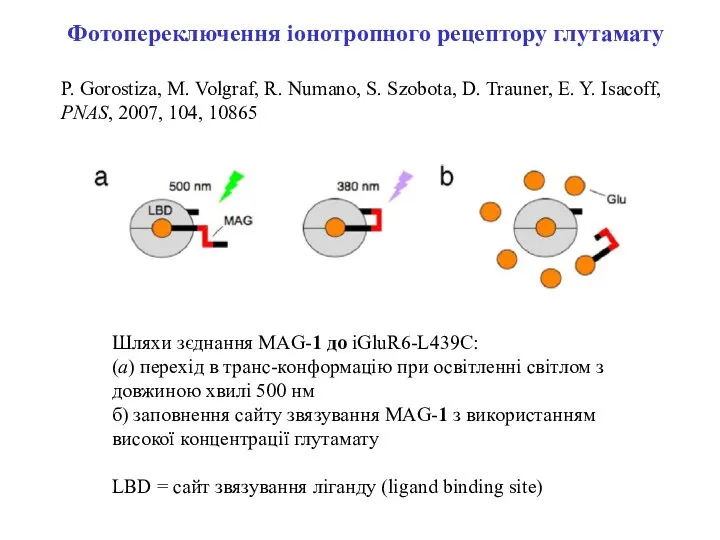
- 7. Шляхи зєднання MAG-1 до iGluR6-L439C: (a) перехід в транс-конформацію при освітленні світлом з довжиною хвилі 500
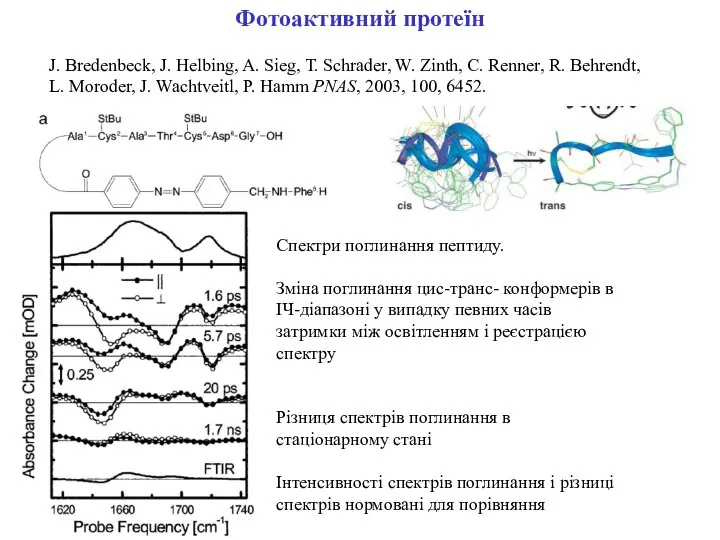
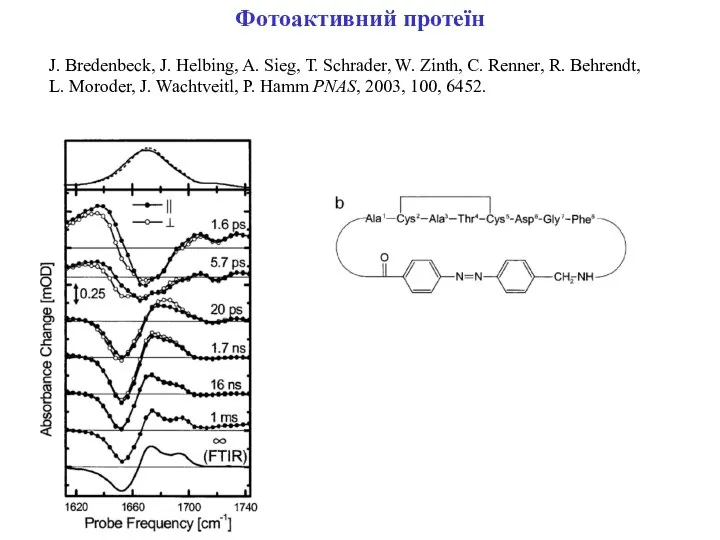
- 8. Фотоактивний протеїн J. Bredenbeck, J. Helbing, A. Sieg, T. Schrader, W. Zinth, C. Renner, R. Behrendt,
- 9. Фотоактивний протеїн J. Bredenbeck, J. Helbing, A. Sieg, T. Schrader, W. Zinth, C. Renner, R. Behrendt,
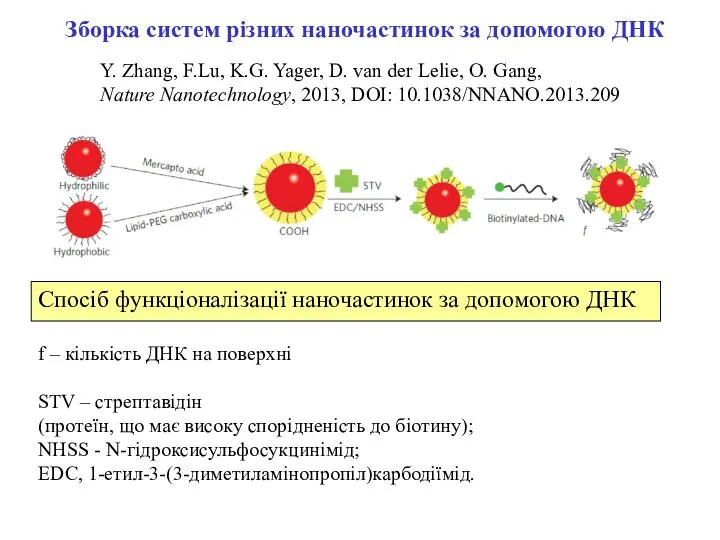
- 10. Y. Zhang, F.Lu, K.G. Yager, D. van der Lelie, O. Gang, Nature Nanotechnology, 2013, DOI: 10.1038/NNANO.2013.209
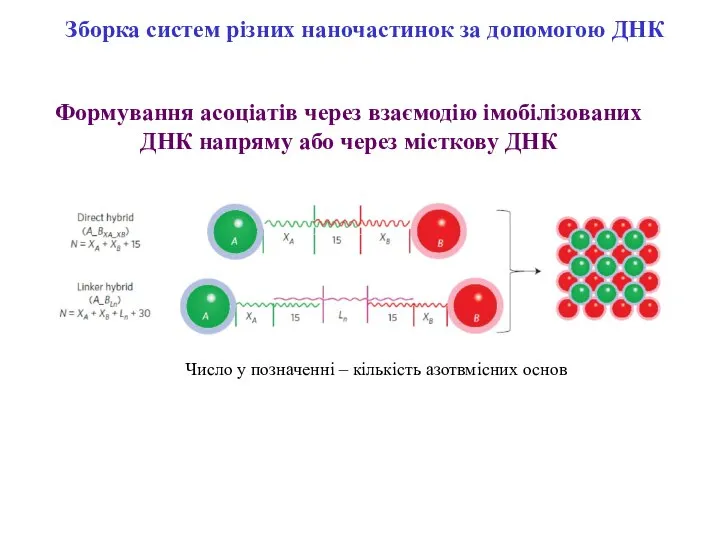
- 11. Зборка систем різних наночастинок за допомогою ДНК Формування асоціатів через взаємодію імобілізованих ДНК напряму або через
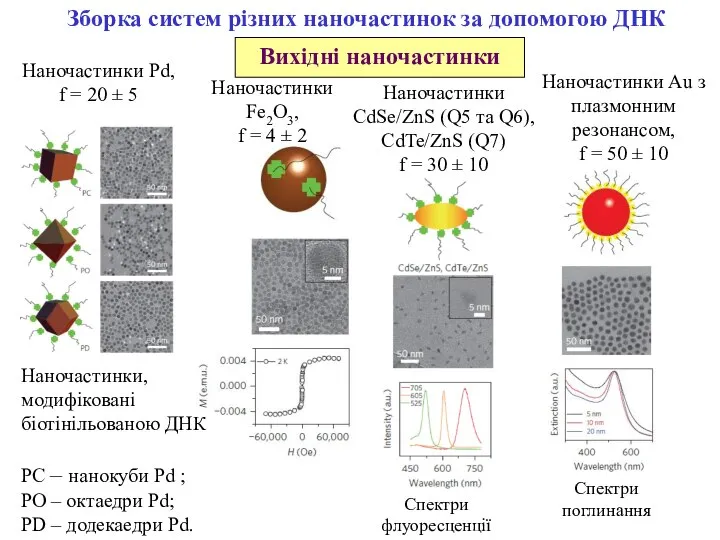
- 12. Зборка систем різних наночастинок за допомогою ДНК Наночастинки, модифіковані біотінільованою ДНК PC – нанокуби Pd ;
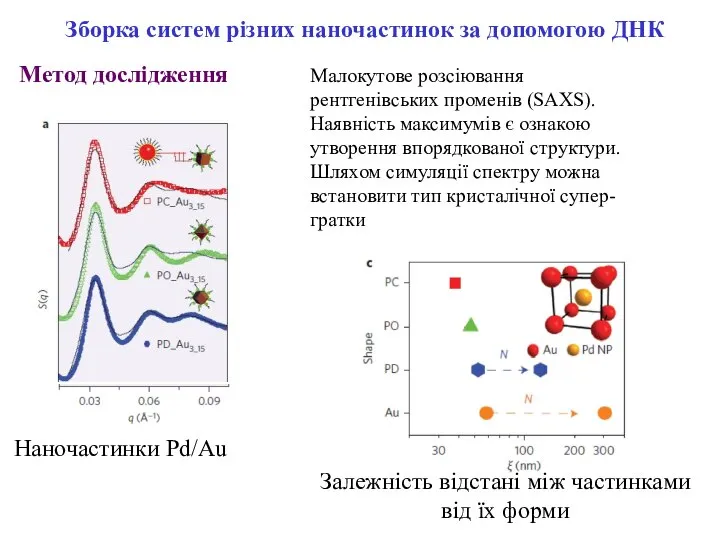
- 13. Малокутове розсіювання рентгенівських променів (SAXS). Наявність максимумів є ознакою утворення впорядкованої структури. Шляхом симуляції спектру можна
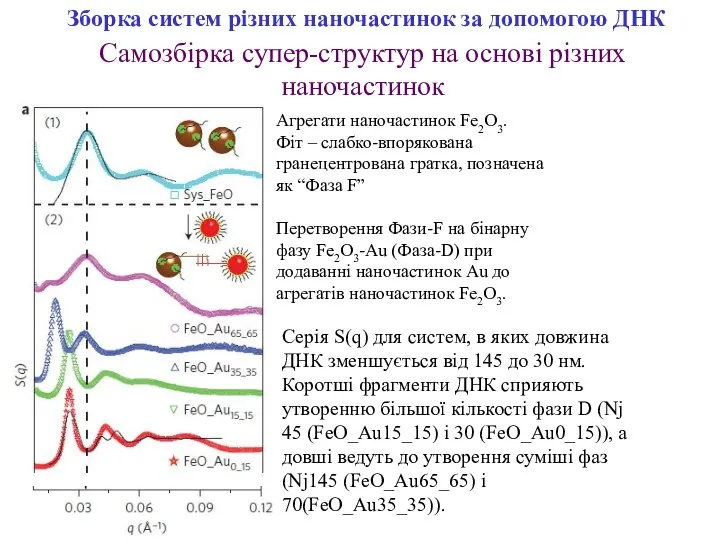
- 14. Зборка систем різних наночастинок за допомогою ДНК Агрегати наночастинок Fe2O3. Фіт – слабко-впорякована гранецентрована гратка, позначена
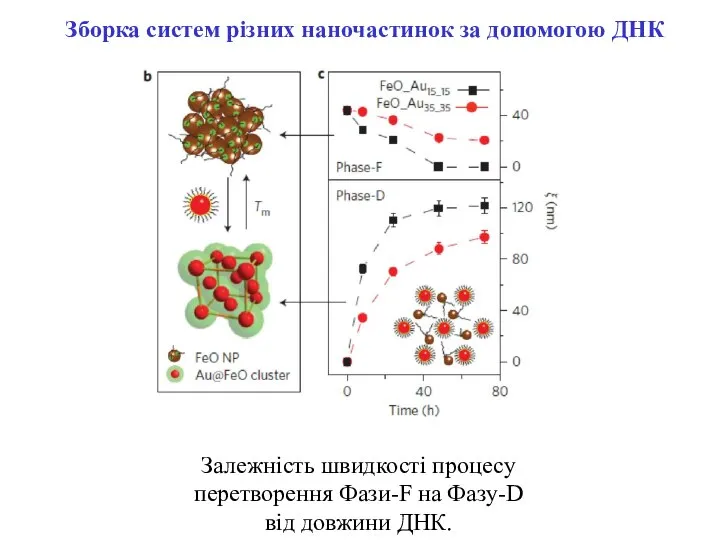
- 15. Залежність швидкості процесу перетворення Фази-F на Фазу-D від довжини ДНК. Зборка систем різних наночастинок за допомогою
- 17. Скачать презентацию
 Структурная схема машин. Механические передачи
Структурная схема машин. Механические передачи Основы гражданской обороны
Основы гражданской обороны Модернизации и культура Процессы модернизации Запада и Востока. (Лекция 10)
Модернизации и культура Процессы модернизации Запада и Востока. (Лекция 10) Презентация Анализ стратегических альтернатив
Презентация Анализ стратегических альтернатив Решение задач Выполнила: студентка 1 курса ЭФ, Холшевникова Оксана, группа Э111б
Решение задач Выполнила: студентка 1 курса ЭФ, Холшевникова Оксана, группа Э111б Презентация Функциональная логистика
Презентация Функциональная логистика Аттестационная работа. Методическая разработка по выполнению проекта «Путешествие в страну Франсуазы». Знакомство с Францией
Аттестационная работа. Методическая разработка по выполнению проекта «Путешествие в страну Франсуазы». Знакомство с Францией План мероприятий на 2019 - 2020 уч г
План мероприятий на 2019 - 2020 уч г Разработка и исследование систем автоматизированного тестирования СОРМ
Разработка и исследование систем автоматизированного тестирования СОРМ Методы изучения наследственности человека
Методы изучения наследственности человека  Лекция 06 - Желчнокаменная болезнь (слайды).ppt
Лекция 06 - Желчнокаменная болезнь (слайды).ppt Храмы – творение мастеров. Х
Храмы – творение мастеров. Х  Дискурс постправды: анализ политических медиа-эффектов
Дискурс постправды: анализ политических медиа-эффектов Психология как наука
Психология как наука Урок математики в 1 классе Ковальских Татьяна Васильевна Учитель начальных классов МКОУ «Горнореченская основная общеобразова
Урок математики в 1 классе Ковальских Татьяна Васильевна Учитель начальных классов МКОУ «Горнореченская основная общеобразова Презентация Федеральное собрание
Презентация Федеральное собрание  Создание мультисенсорной системы для мониторинга технической подготовленности лыжников-гонщиков
Создание мультисенсорной системы для мониторинга технической подготовленности лыжников-гонщиков Металлургический комплекс. Значение отрасли
Металлургический комплекс. Значение отрасли Информационные технологии в психологии 2
Информационные технологии в психологии 2 РАЗРАБОТКА МАРКЕТИНГОВЫХ РЕШЕНИЙ ПО ПРОДВИЖЕНИЮ ТОВАРА НА РЫНОК КОМПЛЕКС ПРОДВИЖЕНИЯ – ЭТО СПЕЦИФИЧЕСКОЕ СОЧЕТАНИ
РАЗРАБОТКА МАРКЕТИНГОВЫХ РЕШЕНИЙ ПО ПРОДВИЖЕНИЮ ТОВАРА НА РЫНОК КОМПЛЕКС ПРОДВИЖЕНИЯ – ЭТО СПЕЦИФИЧЕСКОЕ СОЧЕТАНИ РАСПОЛОЖЕНИЕ ПРЯМОЙ И ПЛОСКОСТИ
РАСПОЛОЖЕНИЕ ПРЯМОЙ И ПЛОСКОСТИ Кардиотонические средства
Кардиотонические средства  Презентация "Тренды и бренды" - скачать презентации по Экономике
Презентация "Тренды и бренды" - скачать презентации по Экономике КИШКОВОПОРОЖНИННІ
КИШКОВОПОРОЖНИННІ Наука и культура в 1917-1945 гг. Выполнила: Турышева А.А. Группа №2905.
Наука и культура в 1917-1945 гг. Выполнила: Турышева А.А. Группа №2905. Класифікація автоматизованих інформаційних систем
Класифікація автоматизованих інформаційних систем ИБ в СЭД
ИБ в СЭД Физическая культура у дошкольников
Физическая культура у дошкольников