При образования поверхности некоторые
локализованные связи должны быть разорваны
При образования
поверхности некоторые
локализованные связи должны быть разорваны
оборванные или
болтающиеся связи.
Энергия электронов
на оборванных
связях повышается.
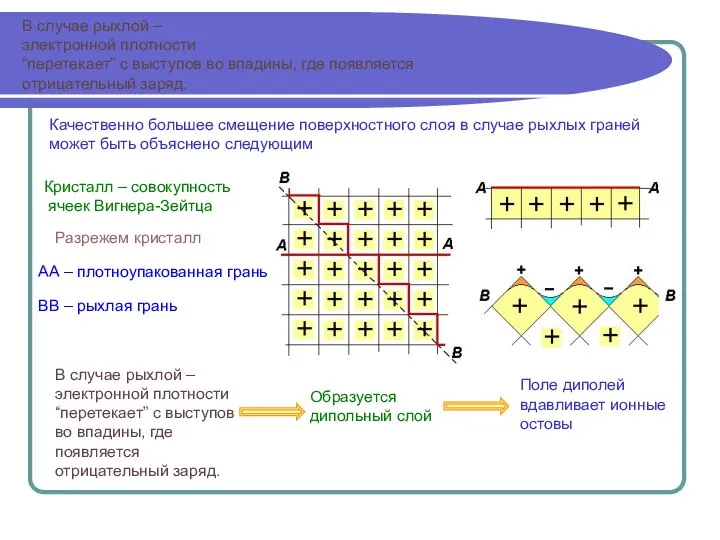
Выгодна перестройка связей в
поверхностной области,
чтобы уменьшить число
оборванных связей.
Увеличение кратности связи между
оставшимися атомами
m – кратность связи (может иметь дробную величину)
тройной (С≡С) - 1.20 Å.
Эмпирическое соотношение Полинга
Одна из возможностей
Например, углерод
длина одинарной связи (С-С) - 1.54 Å
двойной (С=С) - 1.34 Å
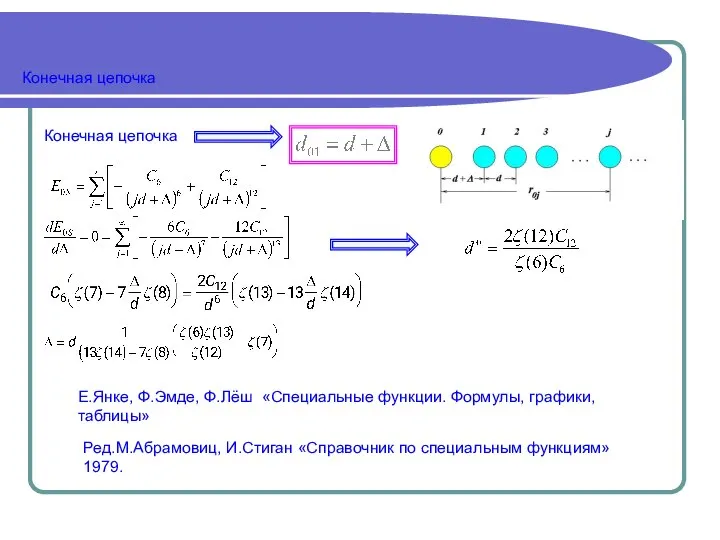
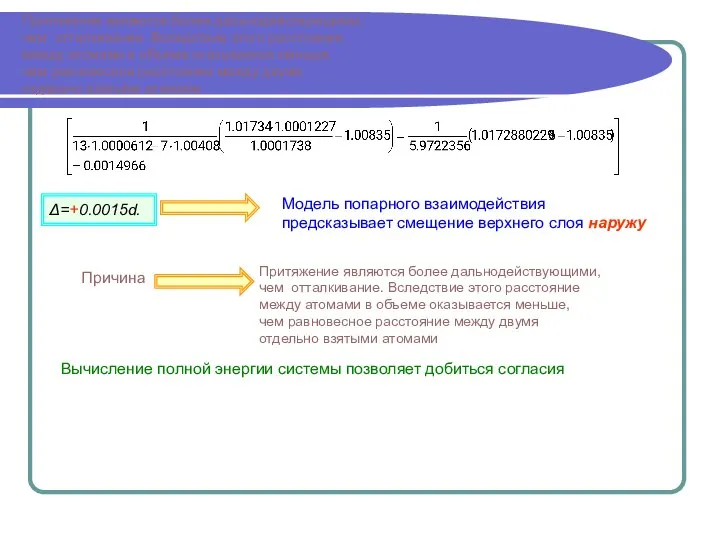
d(m)=d(1)-0,6 ln m
 Адасобленыя акалічнасці
Адасобленыя акалічнасці Бойове застосування КЗА 86Ж6. Призначення та структурна схема комплексу програм КЗА 86Ж6. (Тема 8.1)
Бойове застосування КЗА 86Ж6. Призначення та структурна схема комплексу програм КЗА 86Ж6. (Тема 8.1) Организация и проведение съемочного процесса при работе с животными
Организация и проведение съемочного процесса при работе с животными Презентация "Храм - синтез искусств" - скачать презентации по МХК
Презентация "Храм - синтез искусств" - скачать презентации по МХК Доверительный маркетинг Презентацию подготовила Свинарчук Е.И.
Доверительный маркетинг Презентацию подготовила Свинарчук Е.И.  Возможности использования интерактивной доски на уроках русского языка и литературы Подготовила материал Косач Л.Г., учитель ру
Возможности использования интерактивной доски на уроках русского языка и литературы Подготовила материал Косач Л.Г., учитель ру Алгоритм ветвление
Алгоритм ветвление Наш православный Пермский край
Наш православный Пермский край Конструкционные и функциональные волокнистые композиты. Неорганические матрицы
Конструкционные и функциональные волокнистые композиты. Неорганические матрицы Химический состав пищевых продуктов
Химический состав пищевых продуктов Основы теории государственного управления
Основы теории государственного управления Aztec
Aztec Вступ. Особистість в соціальній психології
Вступ. Особистість в соціальній психології  Политическая культура: сущность и роль в жизни общества. Выполнили Хропина Ольга и Фунтикова Виктория
Политическая культура: сущность и роль в жизни общества. Выполнили Хропина Ольга и Фунтикова Виктория Сканер. Принцип действия
Сканер. Принцип действия Продвижение сайта утками. Практические примеры Докладчик: Виктор Нагайцев Генеральный Директор. - презентация
Продвижение сайта утками. Практические примеры Докладчик: Виктор Нагайцев Генеральный Директор. - презентация отношения подростков к здоровому образу жизни
отношения подростков к здоровому образу жизни Предмет и метод правового регулирования
Предмет и метод правового регулирования Общественно -политические движения Выполнили: Карпенко Т., Галибина Л., гр.Т-114
Общественно -политические движения Выполнили: Карпенко Т., Галибина Л., гр.Т-114 Методы простых итераций
Методы простых итераций  Компания “БЕЛСТРОЙРЕСУРС”. Краткий обзор объектов
Компания “БЕЛСТРОЙРЕСУРС”. Краткий обзор объектов Релятивисткая динамика
Релятивисткая динамика НОВЕЙШАЯ ТЕКТОНИКА
НОВЕЙШАЯ ТЕКТОНИКА  Вычислительные машины, системы и сети
Вычислительные машины, системы и сети Типы данных_.ppt
Типы данных_.ppt МОУ гимназия №15 им.Н.Н.Белоусова Г.Сочи Проведение уроков с использованием ИКТ в начальной школе Приходько Татьяна Николаевна Уч
МОУ гимназия №15 им.Н.Н.Белоусова Г.Сочи Проведение уроков с использованием ИКТ в начальной школе Приходько Татьяна Николаевна Уч Архітектура комп'ютерів. Синтез комбінаційних схем. (Лабораторне заняття 2)
Архітектура комп'ютерів. Синтез комбінаційних схем. (Лабораторне заняття 2) Испания
Испания