Содержание
- 2. Основные понятия химической кинетики Элементарные кинетические уравнения и их решение
- 3. МОЛЕКУЛЯРНОСТЬ
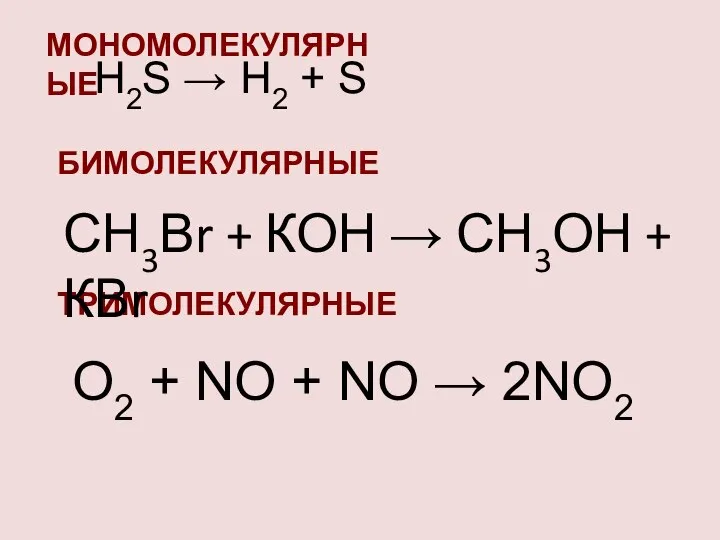
- 4. H2S → H2 + S МОНОМОЛЕКУЛЯРНЫЕ ТРИМОЛЕКУЛЯРНЫЕ БИМОЛЕКУЛЯРНЫЕ СН3Вr + КОН → СН3ОН + КВr О2
- 6. ПОРЯДОК РЕАКЦИИ Порядок реакции определяется величиной показателя степени в кинетическом уравнении порядок прямой реакции η=a+b aA+bB=cC+dD
- 7. Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени aA+bB=cC+dD
- 8. К.М.ГУЛЬДБЕРГ, П.ВААГЕ ЗАКОН ДЕЙСТВУЮЩИХ МАСС Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях
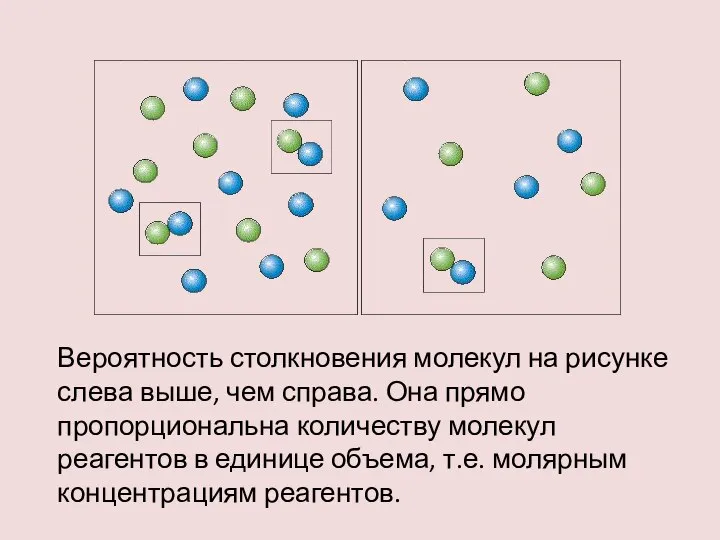
- 9. Вероятность столкновения молекул на рисунке слева выше, чем справа. Она прямо пропорциональна количеству молекул реагентов в
- 10. k- константа скорости реакции является мерой реакционной способности реагентов при данной температуре aA+bB=cC+dD
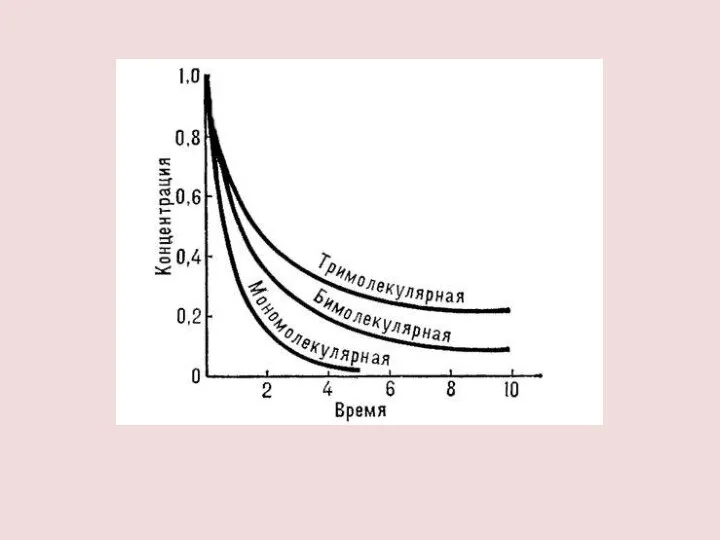
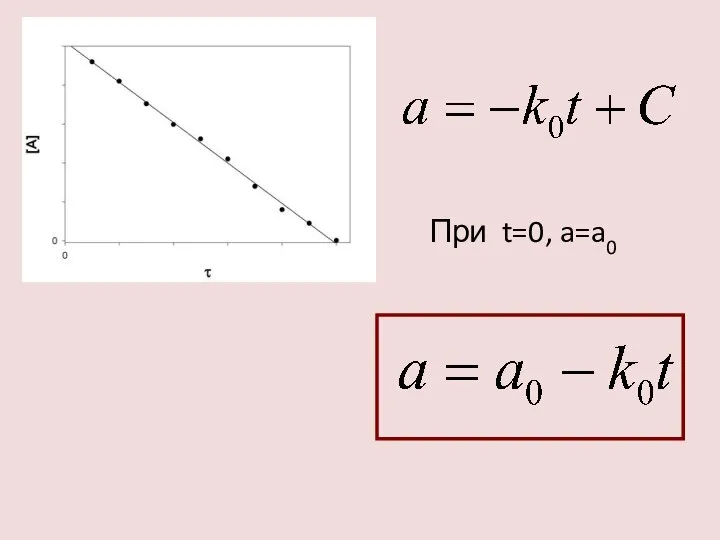
- 11. РЕАКЦИЯ НУЛЕВОГО ПОРЯДКА
- 12. При t=0, a=a0
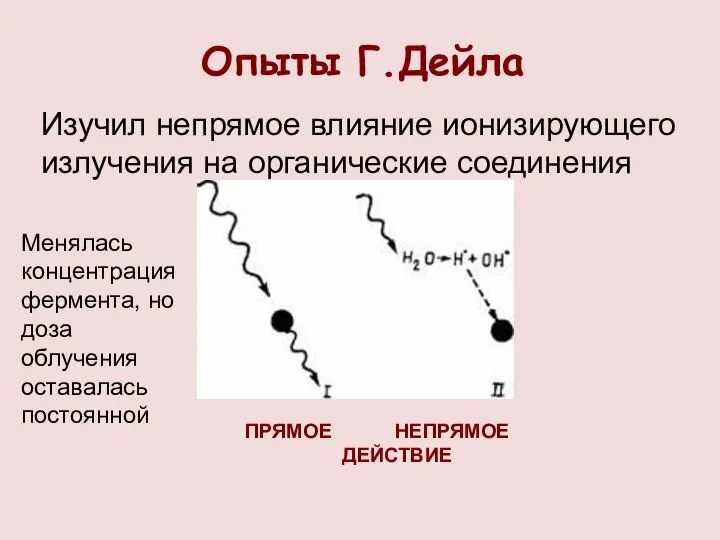
- 13. Опыты Г.Дейла Изучил непрямое влияние ионизирующего излучения на органические соединения ПРЯМОЕ НЕПРЯМОЕ ДЕЙСТВИЕ Менялась концентрация фермента,
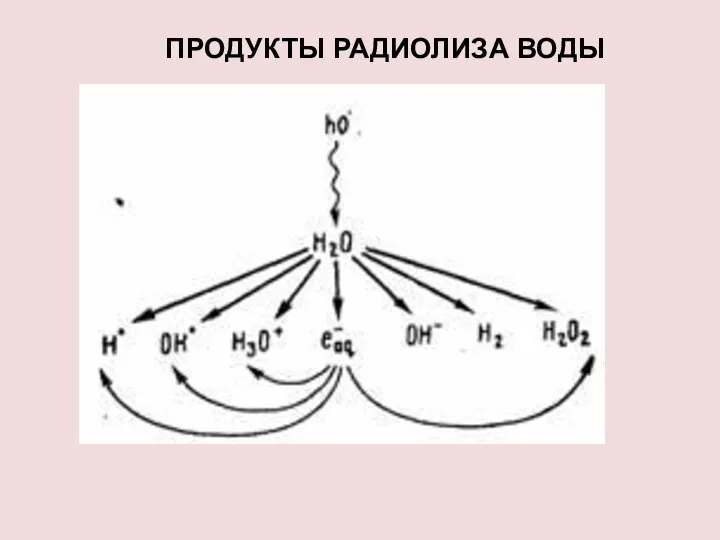
- 14. ПРОДУКТЫ РАДИОЛИЗА ВОДЫ
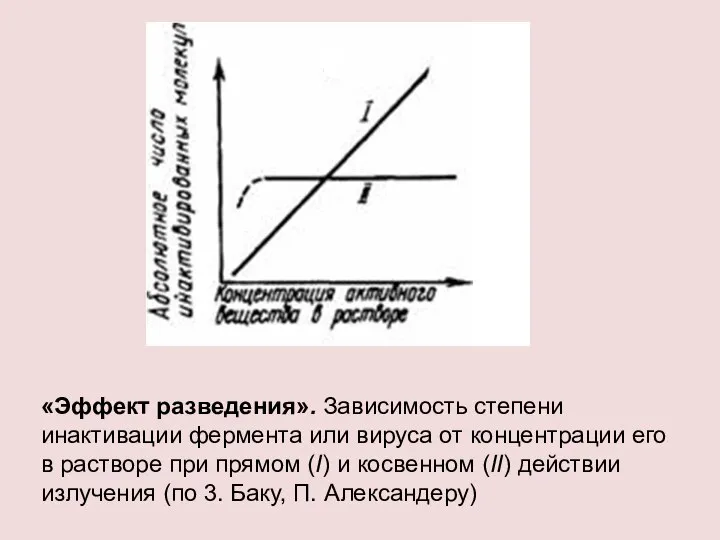
- 15. «Эффект разведения». Зависимость степени инактивации фермента или вируса от концентрации его в растворе при прямом (I)
- 16. РЕАКЦИЯ ПЕРВОГО ПОРЯДКА
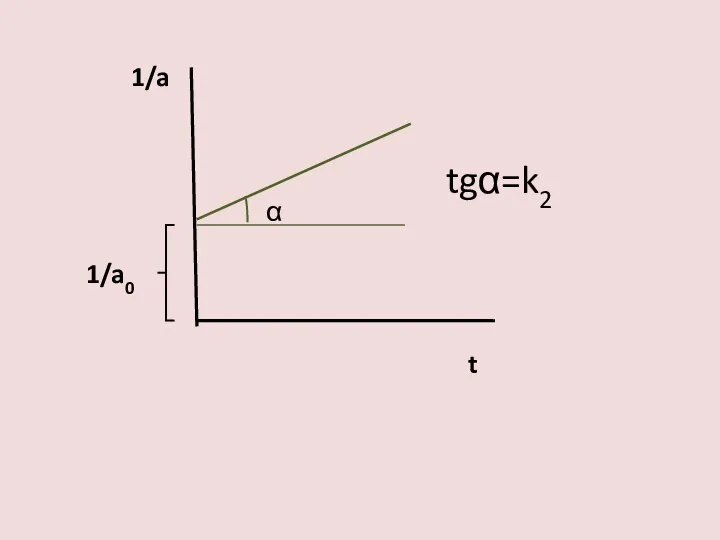
- 18. t α Определение константы скорости реакции
- 19. Выражение для b найдем из условия закрытости системы
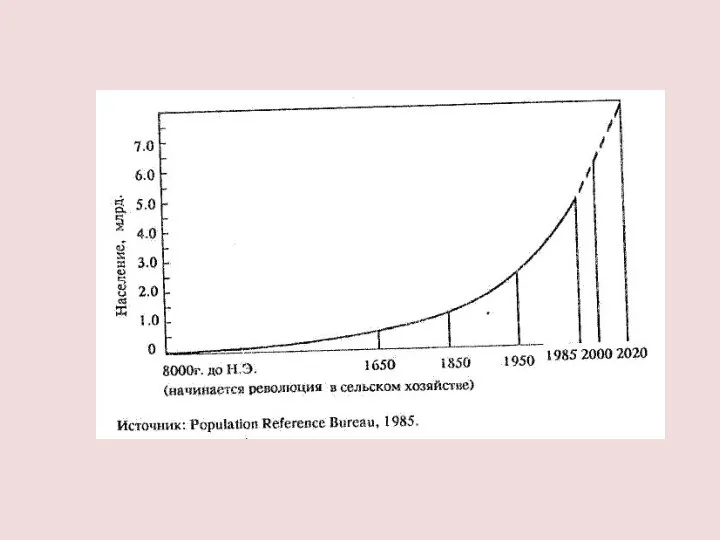
- 20. МОДЕЛЬ МАЛЬТУСА α — коэффициент прироста x0 — численность популяции в начальный момент времени. Т.Мальтус (1766–1834)
- 23. СКОРОСТЬ РЕАКЦИИ ВТОРОГО ПОРЯДКА
- 24. 2А→В k2 1 вариант
- 25. Определим С при t=0, a=a0
- 26. 1/a 1/a0 t tgα=k2 α
- 27. А+B→C k2 При t=0 a=a0 b=b0 X – количество каждого вещества, израсходованного за время t 2
- 28. ИСПОЛЬЗУЕМ ТОЖДЕСТВО: ПОЛУЧИМ:
- 30. ОПРЕДЕЛИМ С ПРИ УСЛОВИИ, ЧТО t=0, a=a0 , b=b0 , x=0
- 31. ПРЕОБРАЗОВАНИЕ ДАЕТ:
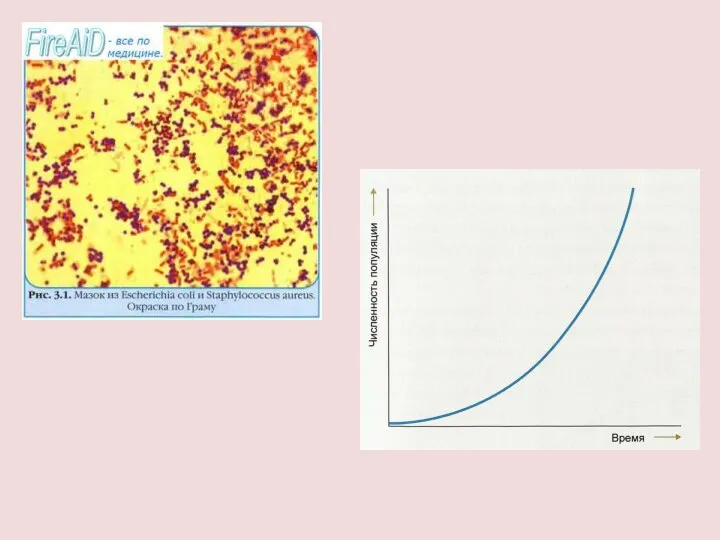
- 32. ПРИМЕР БИОЛОГИЧЕСКОЙ РЕАКЦИИ ВТОРОГО ПОРЯДКА СКОРОСТЬ РОСТА КЛЕТОК α НЕ ЯВЛЯЕТСЯ ПОСТОЯННОЙ, Т.К. КЛЕТКИ НЕ ТОЛЬКО
- 34. Скачать презентацию





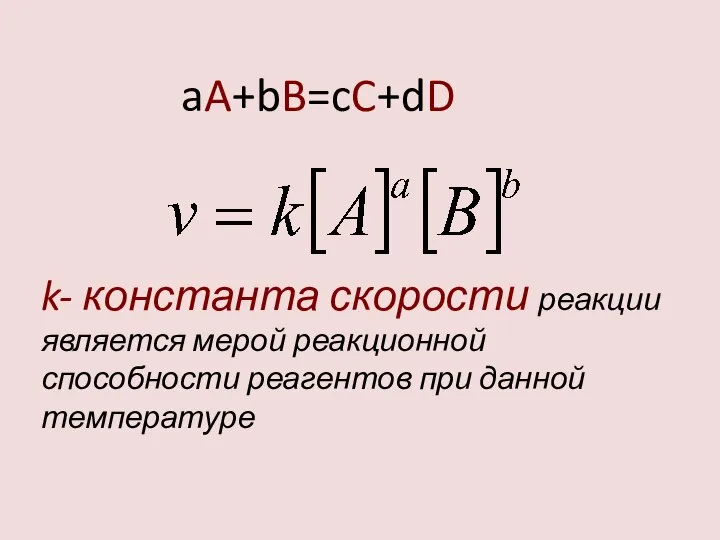







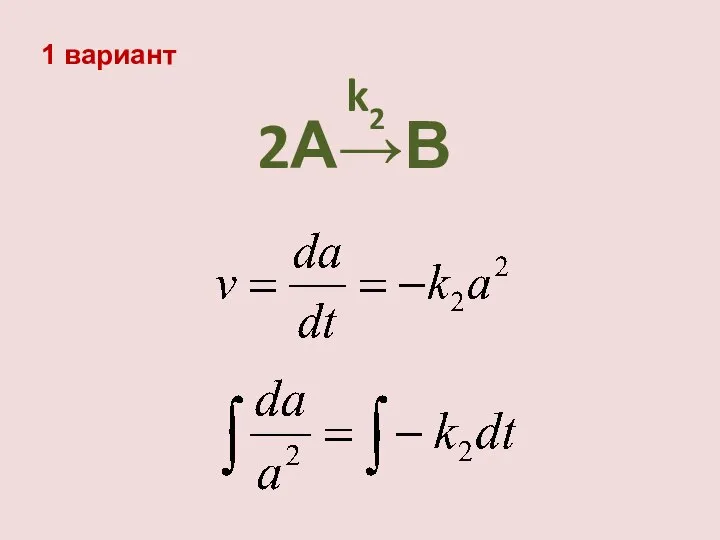



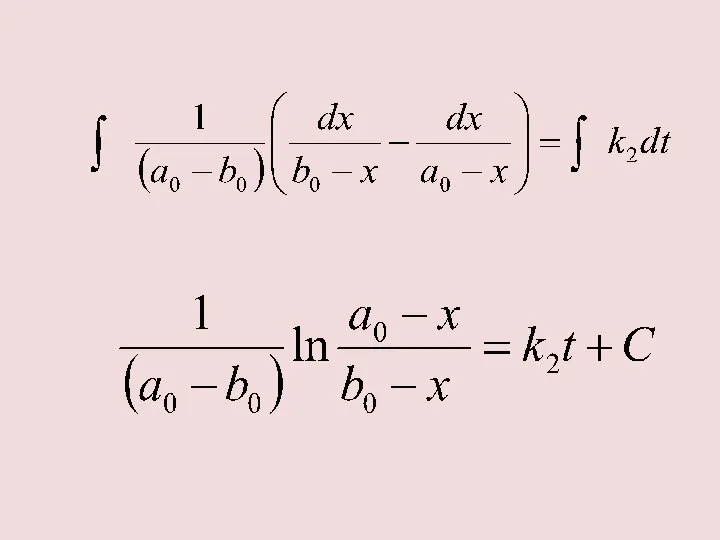
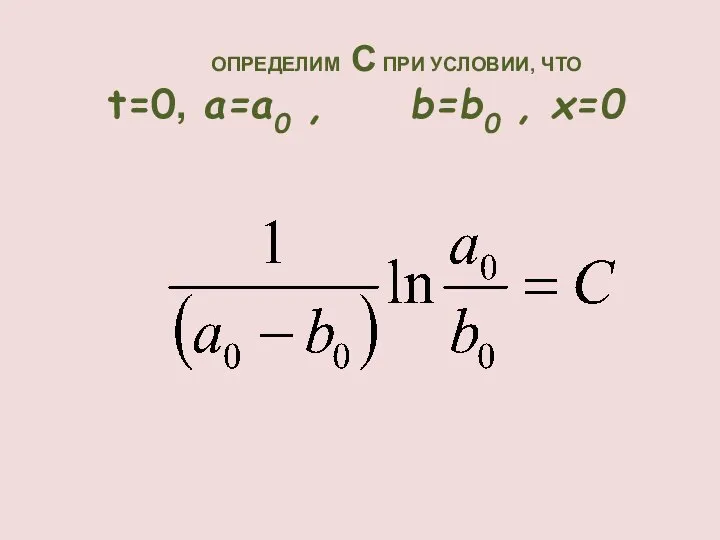


 Project The Way Teenagers Live
Project The Way Teenagers Live Бр̣хад Бхагаватамр̣та
Бр̣хад Бхагаватамр̣та ОПИС МІСЦЕВОСТІ І РОЗВ’ЯЗАННЯ ЗАДАЧ ЗА НАВЧАЛЬНИМИ ТОПОГРАФІЧНИМИ КАРТАМИ
ОПИС МІСЦЕВОСТІ І РОЗВ’ЯЗАННЯ ЗАДАЧ ЗА НАВЧАЛЬНИМИ ТОПОГРАФІЧНИМИ КАРТАМИ Цикл while. Enum. Обработка нажатия клавиши. Таймер
Цикл while. Enum. Обработка нажатия клавиши. Таймер Предмет, система и задачи науки криминалистики. (Тема 1)
Предмет, система и задачи науки криминалистики. (Тема 1) Разбор задач ЕГЭ. Анализ программ с циклами. В5
Разбор задач ЕГЭ. Анализ программ с циклами. В5 Операции для работы с файлами
Операции для работы с файлами состав числа - презентация для начальной школы
состав числа - презентация для начальной школы Персонал и стратегия - друзья или враги ?
Персонал и стратегия - друзья или враги ?  Поняття про речення. Основні ознаки речення. Мета. Формувати поняття речення як одиниці мовлення, що виражає
Поняття про речення. Основні ознаки речення. Мета. Формувати поняття речення як одиниці мовлення, що виражає История и ценности компании. Корпоративная культура. Холдинг «ЦЭПР» сегодня
История и ценности компании. Корпоративная культура. Холдинг «ЦЭПР» сегодня Коэффициент Тобина Подготовили: студентки группы ДС-04, Шунайлова Жанна, Епифанова Евгения
Коэффициент Тобина Подготовили: студентки группы ДС-04, Шунайлова Жанна, Епифанова Евгения Презентация "Русские народные танцы" - скачать презентации по МХК
Презентация "Русские народные танцы" - скачать презентации по МХК Особые приемы психологического воздействия на людей Выполнила студентка группы Ю-104 Чуева Яна
Особые приемы психологического воздействия на людей Выполнила студентка группы Ю-104 Чуева Яна  .2. Факторы производства и факторные доходы
.2. Факторы производства и факторные доходы Динамические структуры данных
Динамические структуры данных Горнолыжный курорт «Солнечная долина»
Горнолыжный курорт «Солнечная долина» Влажность. Виды влаги в древесине. Определение влажности древесины. Усушка и разбухание древесины в различных направлениях
Влажность. Виды влаги в древесине. Определение влажности древесины. Усушка и разбухание древесины в различных направлениях .01.2017 Биологические ресурсы
.01.2017 Биологические ресурсы Искусствознание и культура
Искусствознание и культура Политический процесс
Политический процесс Архитектура и живопись русского Классицизма Материалы к уроку литературы в 9 классе подготовлены учителем русского языка и литер
Архитектура и живопись русского Классицизма Материалы к уроку литературы в 9 классе подготовлены учителем русского языка и литер Nike компаниясы
Nike компаниясы Современные материалы и технологии их создания
Современные материалы и технологии их создания Никон Российский епископ, Московский патриарх
Никон Российский епископ, Московский патриарх Агентский договор и договор комиссии Выполнила: студентка 4-го курса ФТД ДС.1 Восколович Юля
Агентский договор и договор комиссии Выполнила: студентка 4-го курса ФТД ДС.1 Восколович Юля  Архитектоника
Архитектоника health care in kazakhstan
health care in kazakhstan