Содержание
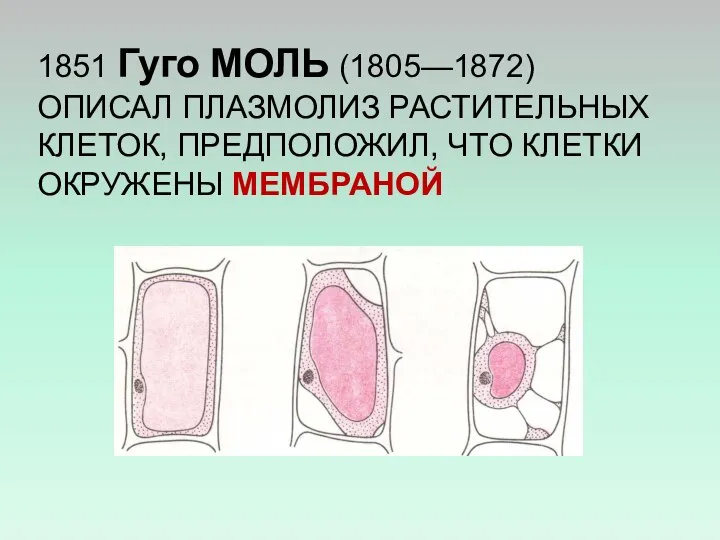
- 2. 1851 Гуго МОЛЬ (1805—1872) ОПИСАЛ ПЛАЗМОЛИЗ РАСТИТЕЛЬНЫХ КЛЕТОК, ПРЕДПОЛОЖИЛ, ЧТО КЛЕТКИ ОКРУЖЕНЫ МЕМБРАНОЙ
- 3. 1855 К. НАГЕЛИ: КЛЕТОЧНАЯ ПОВЕРХНОСТЬ – БАРЬЕР ДЛЯ ПРОНИКНОВЕНИЯ КРАСИТЕЛЯ В КЛЕТКУ
- 4. Микроскопы XVIII века Современный микроскоп Микроскоп, 1876 год
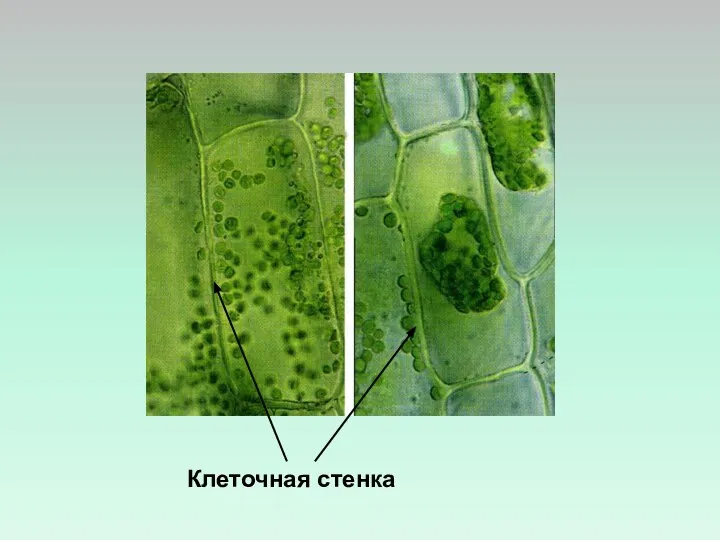
- 5. Клеточная стенка
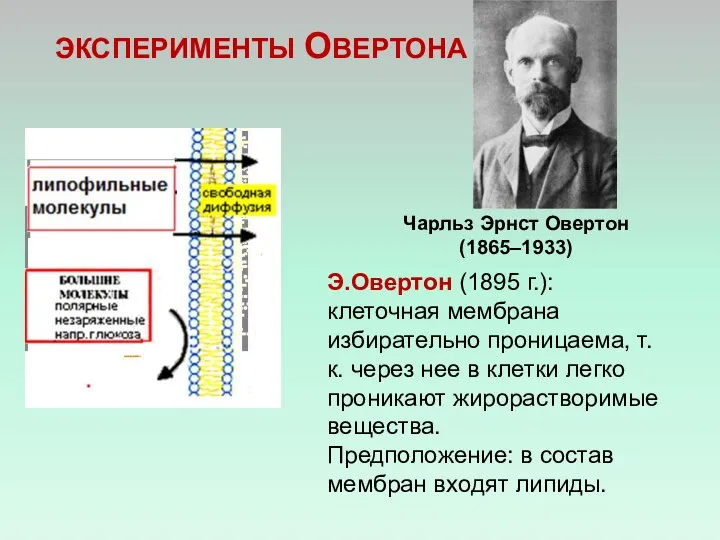
- 6. ЭКСПЕРИМЕНТЫ ОВЕРТОНА Э.Овертон (1895 г.): клеточная мембрана избирательно проницаема, т.к. через нее в клетки легко проникают
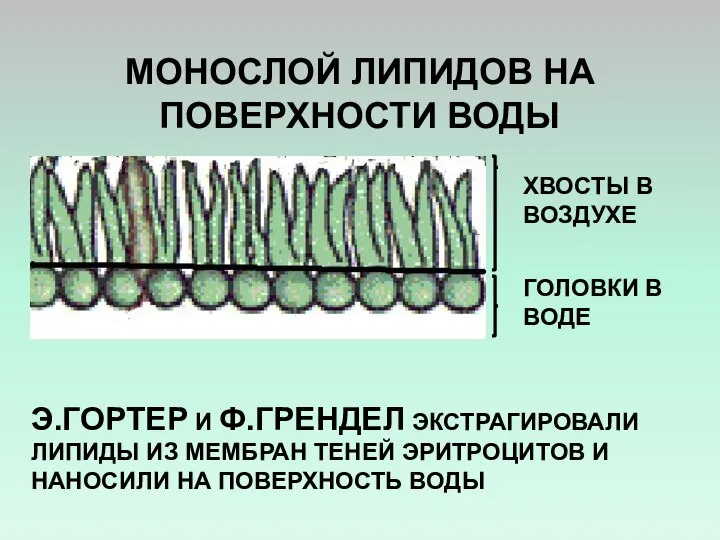
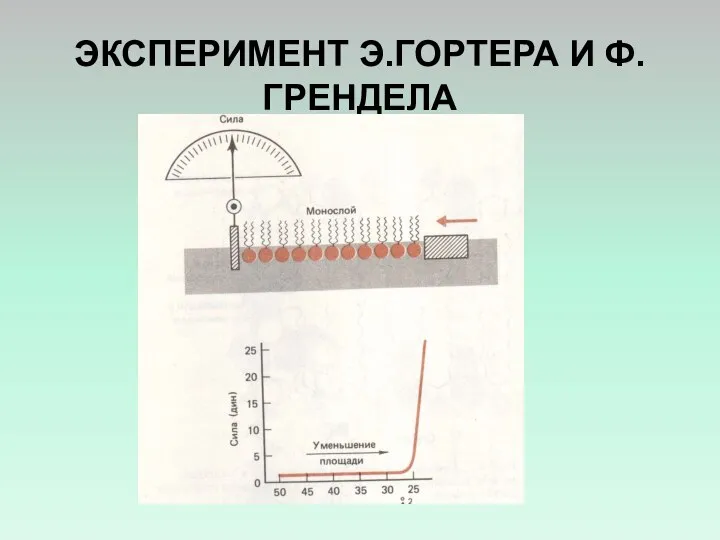
- 7. МОНОСЛОЙ ЛИПИДОВ НА ПОВЕРХНОСТИ ВОДЫ Э.ГОРТЕР И Ф.ГРЕНДЕЛ ЭКСТРАГИРОВАЛИ ЛИПИДЫ ИЗ МЕМБРАН ТЕНЕЙ ЭРИТРОЦИТОВ И НАНОСИЛИ
- 8. ЭКСПЕРИМЕНТ Э.ГОРТЕРА И Ф.ГРЕНДЕЛА
- 9. БИСЛОЙ ГОРТЕРА - ГРЕНДЕЛА
- 10. ЭЛЕКТРОННЫЙ МИКРОСКОП ЭЛЕКТРОНЫ УСКОРЯЮТСЯ ЭЛЕКТРИЧЕСКИМ ПОЛЕМ НАПРЯЖЕНИЕМ 105 В, ИХ СКОРОСТЬ 106 М/С, ДЛИНА ВОЛНЫ 0,1
- 11. ТРЕХСЛОЙНОЕ ИЗОБРАЖЕНИЕ БИОМЕМБРАНЫ НА ЭЛЕКТРОНОГРАММЕ ВНУТРИКЛЕТОЧНОЕ ПРОСТРАНСТВО ВНЕКЛЕТОЧНОЕ ПРОСТРАНСТВО МЕЖДУ ПАРОЙ ТЕМНЫХ ПОЛОС – СВЕТЛОЕ ПРОСТРАНСТВО
- 12. МОДЕЛИ МЕМБРАНЫ Унитарная модель мембраны Робертсона Модель Даниэлли - Давсона Джеймс Дэвид Робертсон ( 1923 -
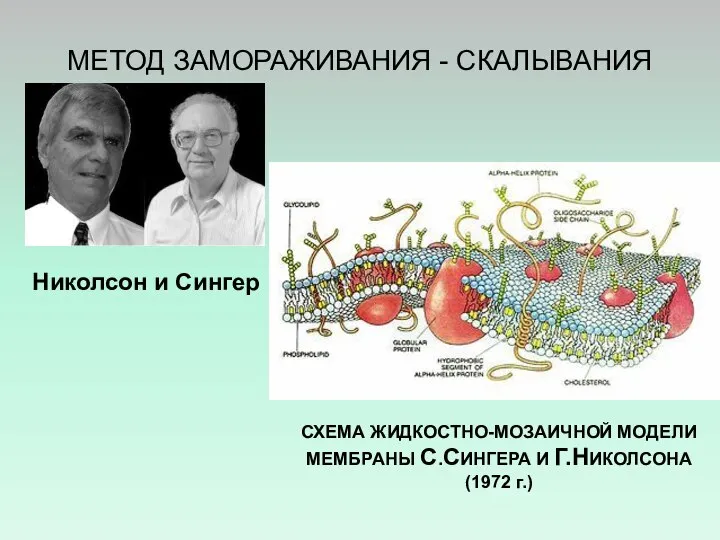
- 13. МЕТОД ЗАМОРАЖИВАНИЯ - СКАЛЫВАНИЯ Николсон и Сингер СХЕМА ЖИДКОСТНО-МОЗАИЧНОЙ МОДЕЛИ МЕМБРАНЫ С.СИНГЕРА И Г.НИКОЛСОНА (1972 г.)
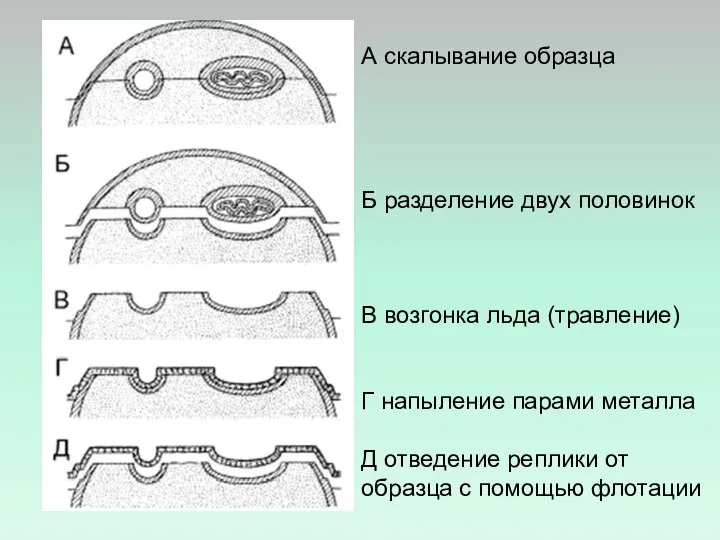
- 14. А скалывание образца Б разделение двух половинок В возгонка льда (травление) Г напыление парами металла Д
- 15. МИКРОФОТОГРАФИЯ МЕМБРАНЫ, ПРИГОТОВЛЕННОЙ МЕТОДОМ ЗАМОРАЖИВАНИЯ – СКАЛЫВАНИЯ
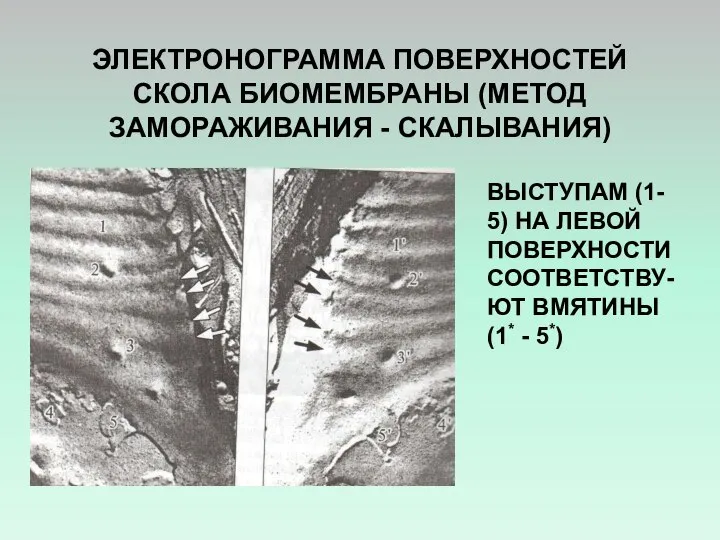
- 16. ЭЛЕКТРОНОГРАММА ПОВЕРХНОСТЕЙ СКОЛА БИОМЕМБРАНЫ (МЕТОД ЗАМОРАЖИВАНИЯ - СКАЛЫВАНИЯ) ВЫСТУПАМ (1- 5) НА ЛЕВОЙ ПОВЕРХНОСТИ СООТВЕТСТВУ-ЮТ ВМЯТИНЫ
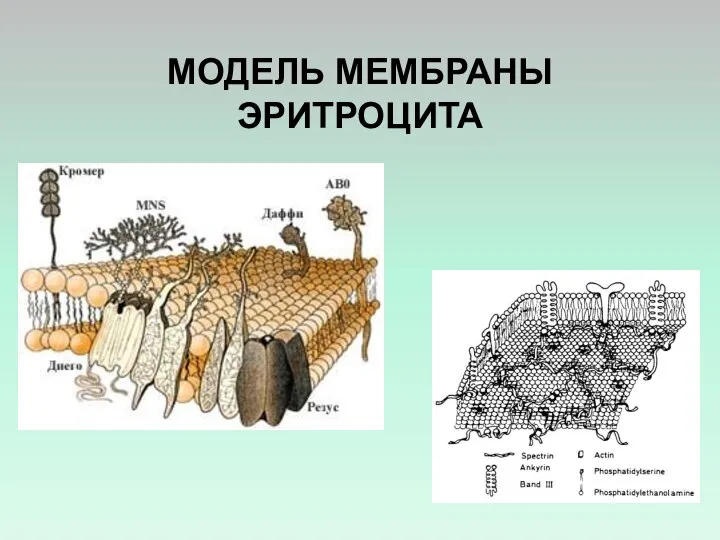
- 17. МОДЕЛЬ МЕМБРАНЫ ЭРИТРОЦИТА
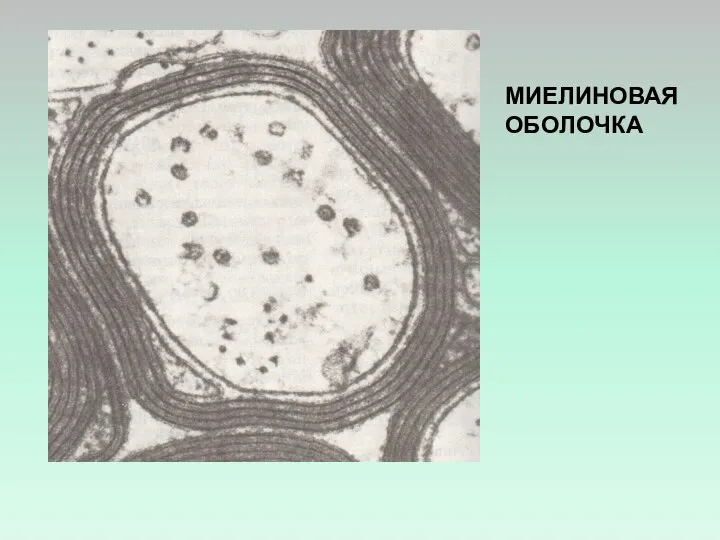
- 18. МИЕЛИНОВАЯ ОБОЛОЧКА
- 19. ЭТАПЫ ИЗУЧЕНИЯ МЕМБРАН
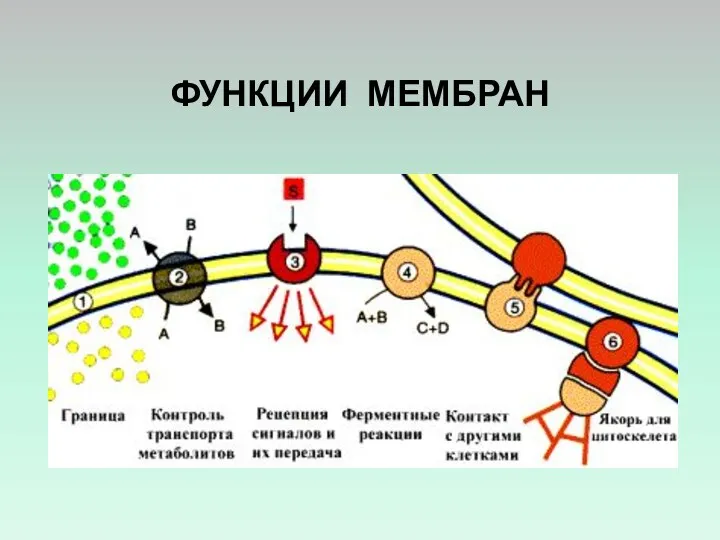
- 21. ФУНКЦИИ МЕМБРАН
- 22. ИСКУССТВЕННЫЕ МЕМБРАНЫ
- 23. ИСКУССТВЕННЫЕ МЕМБРАНЫ - ЛИПОСОМЫ Однослойные липосомы
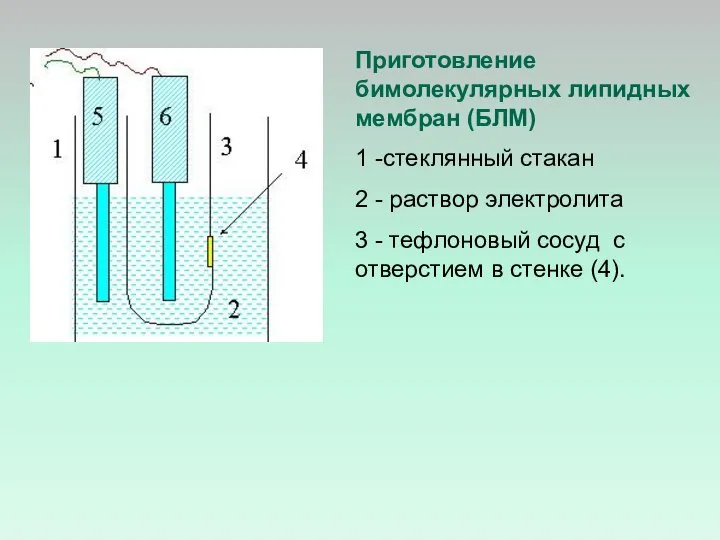
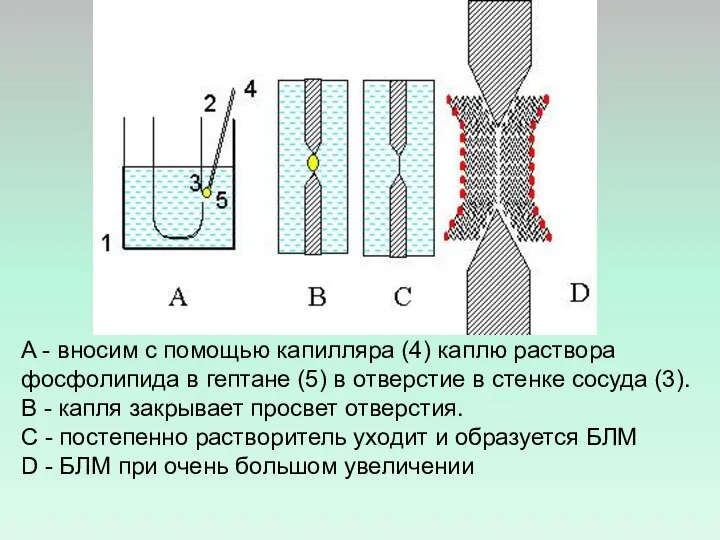
- 24. Приготовление бимолекулярных липидных мембран (БЛМ) 1 -стеклянный стакан 2 - раствор электролита 3 - тефлоновый сосуд
- 25. A - вносим с помощью капилляра (4) каплю раствора фосфолипида в гептане (5) в отверстие в
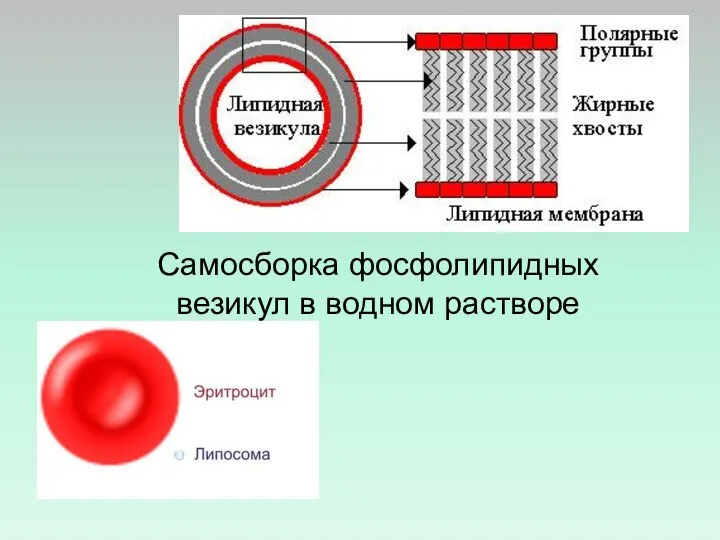
- 26. Самосборка фосфолипидных везикул в водном растворе
- 27. МЕТОДЫ ИССЛЕДОВАНИЯ МЕМБРАН
- 28. МЕТОДЫ ВЫДЕЛЕНИЕ БИОЛОГИЧЕСКИХ МЕМБРАН ЭЛЕКТРОННАЯ МИКРОСКОПИЯ ЭКСТРАКЦИЯ ЛИПИДОВ И БЕЛКОВ МЕМБРАН РАЗДЕЛЕНИЕ ЛИПИДОВ НА КЛАССЫ ИДЕНТИФИКАЦИЯ
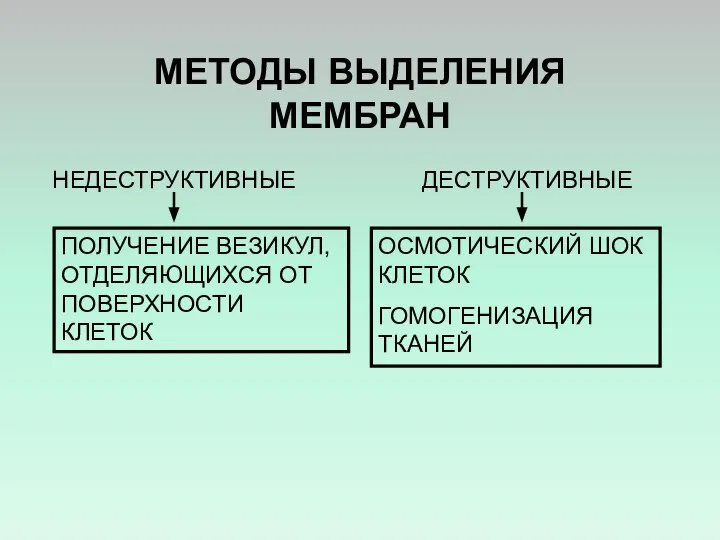
- 29. МЕТОДЫ ВЫДЕЛЕНИЯ МЕМБРАН НЕДЕСТРУКТИВНЫЕ ДЕСТРУКТИВНЫЕ ПОЛУЧЕНИЕ ВЕЗИКУЛ, ОТДЕЛЯЮЩИХСЯ ОТ ПОВЕРХНОСТИ КЛЕТОК ОСМОТИЧЕСКИЙ ШОК КЛЕТОК ГОМОГЕНИЗАЦИЯ ТКАНЕЙ
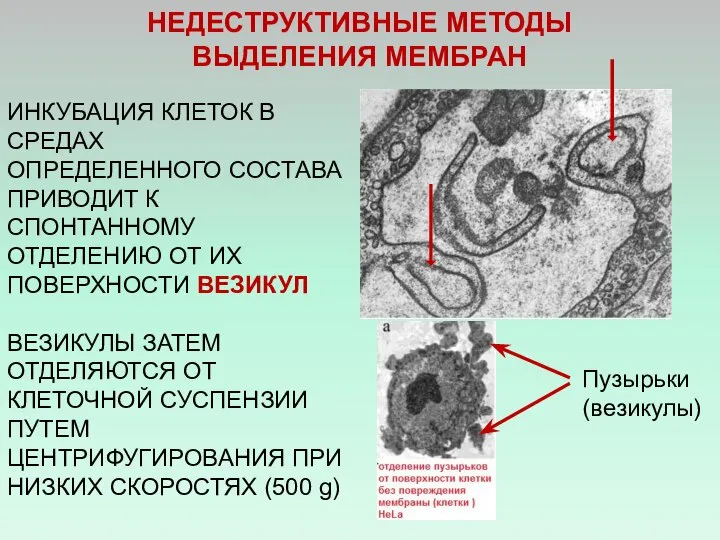
- 30. НЕДЕСТРУКТИВНЫЕ МЕТОДЫ ВЫДЕЛЕНИЯ МЕМБРАН ИНКУБАЦИЯ КЛЕТОК В СРЕДАХ ОПРЕДЕЛЕННОГО СОСТАВА ПРИВОДИТ К СПОНТАННОМУ ОТДЕЛЕНИЮ ОТ ИХ
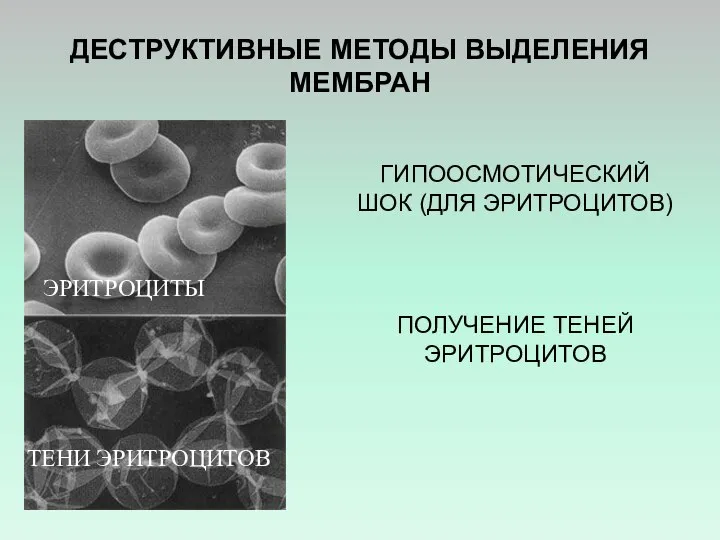
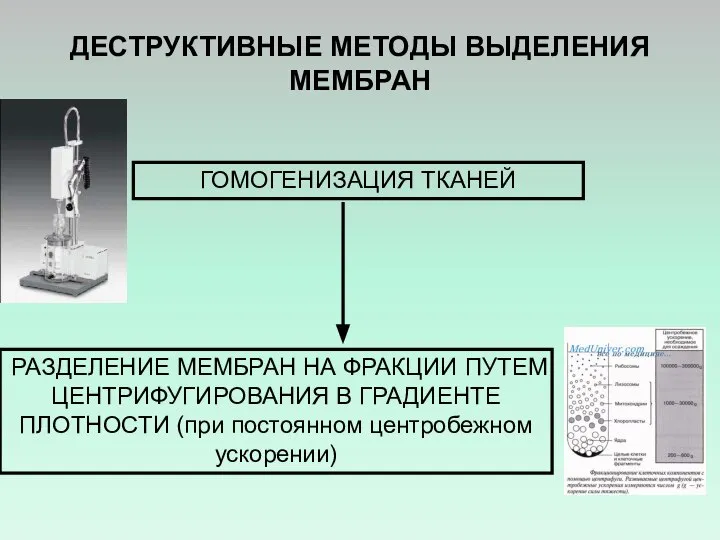
- 31. ДЕСТРУКТИВНЫЕ МЕТОДЫ ВЫДЕЛЕНИЯ МЕМБРАН ГИПООСМОТИЧЕСКИЙ ШОК (ДЛЯ ЭРИТРОЦИТОВ) ПОЛУЧЕНИЕ ТЕНЕЙ ЭРИТРОЦИТОВ ЭРИТРОЦИТЫ ТЕНИ ЭРИТРОЦИТОВ
- 32. РАЗДЕЛЕНИЕ МЕМБРАН НА ФРАКЦИИ ПУТЕМ ЦЕНТРИФУГИРОВАНИЯ В ГРАДИЕНТЕ ПЛОТНОСТИ (при постоянном центробежном ускорении) ДЕСТРУКТИВНЫЕ МЕТОДЫ ВЫДЕЛЕНИЯ
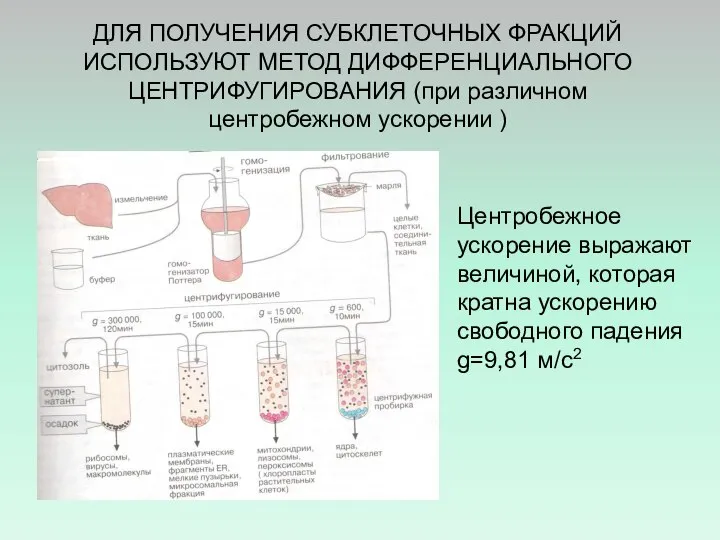
- 33. ДЛЯ ПОЛУЧЕНИЯ СУБКЛЕТОЧНЫХ ФРАКЦИЙ ИСПОЛЬЗУЮТ МЕТОД ДИФФЕРЕНЦИАЛЬНОГО ЦЕНТРИФУГИРОВАНИЯ (при различном центробежном ускорении ) Центробежное ускорение выражают
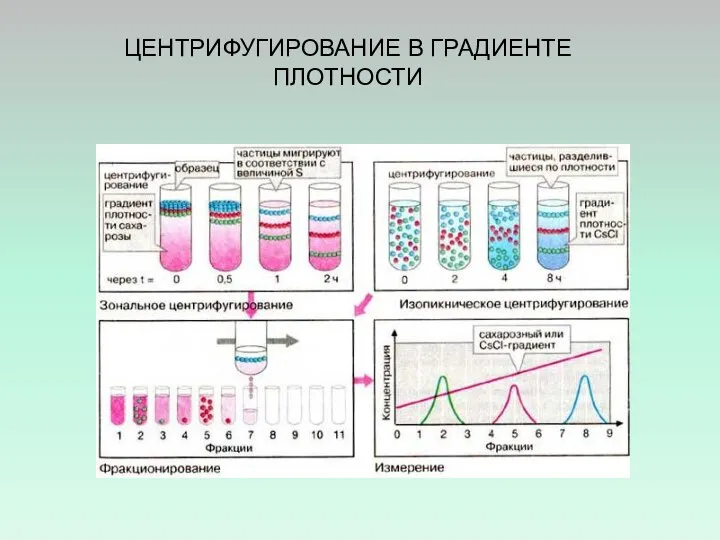
- 34. ЦЕНТРИФУГИРОВАНИЕ В ГРАДИЕНТЕ ПЛОТНОСТИ
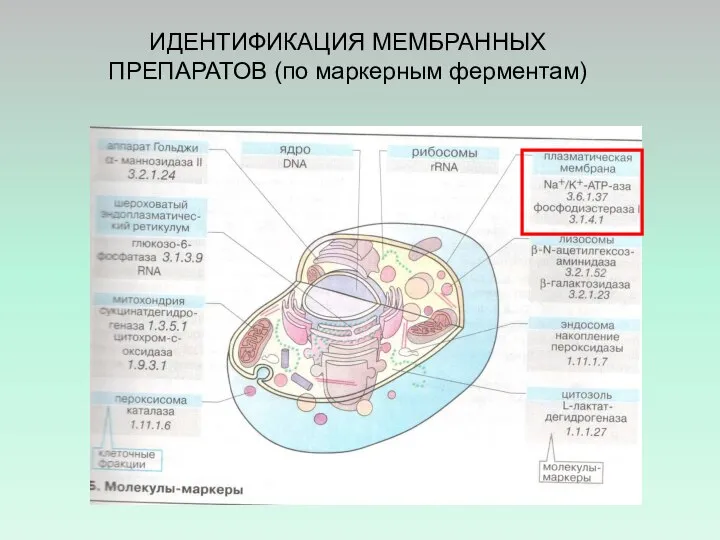
- 35. ИДЕНТИФИКАЦИЯ МЕМБРАННЫХ ПРЕПАРАТОВ (по маркерным ферментам)
- 36. ИЗУЧЕНИЕ МЕМБРАННЫХ ЛИПИДОВ И БЕЛКОВ
- 37. ВЫДЕЛЕНИЕ МЕМБРАННЫХ ЛИПИДОВ
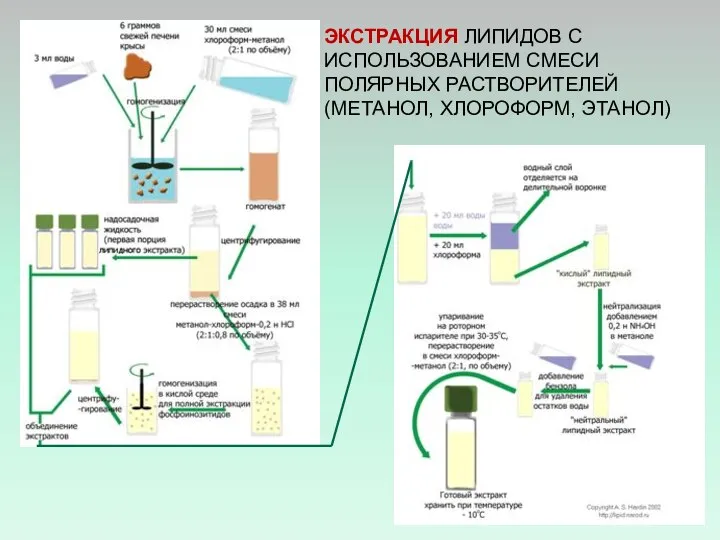
- 38. ЭКСТРАКЦИЯ ЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ СМЕСИ ПОЛЯРНЫХ РАСТВОРИТЕЛЕЙ (МЕТАНОЛ, ХЛОРОФОРМ, ЭТАНОЛ)
- 39. ДЛЯ УДАЛЕНИЯ НЕЛИПИДНЫХ КОМПОНЕНТОВ ПРОМЫВАНИЕ СМЕСИ ЛИПИДОВ ЦЕНТРИФУГИРОВАНИЕ УДАЛЕНИЕ РАСТВОРИТЕЛЯ (ВЫСУШИВАНИЕ В ПОТОКЕ АЗОТА ИЛИ СЖАТОГО
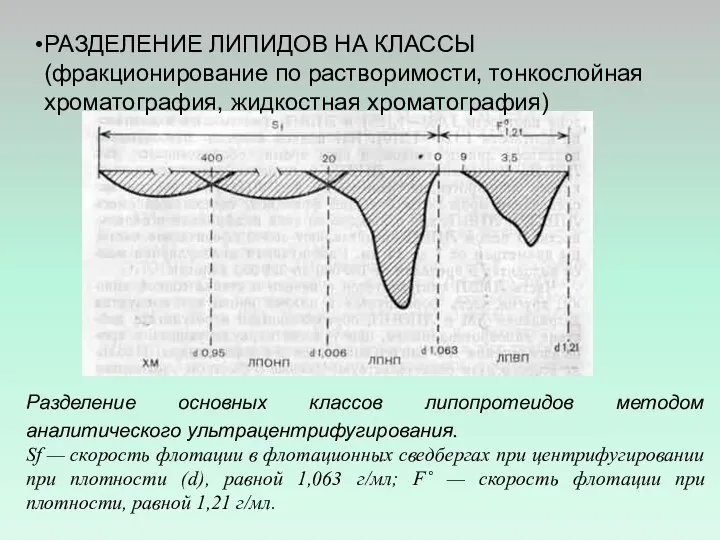
- 40. РАЗДЕЛЕНИЕ ЛИПИДОВ НА КЛАССЫ (фракционирование по растворимости, тонкослойная хроматография, жидкостная хроматография) Разделение основных классов липопротеидов методом
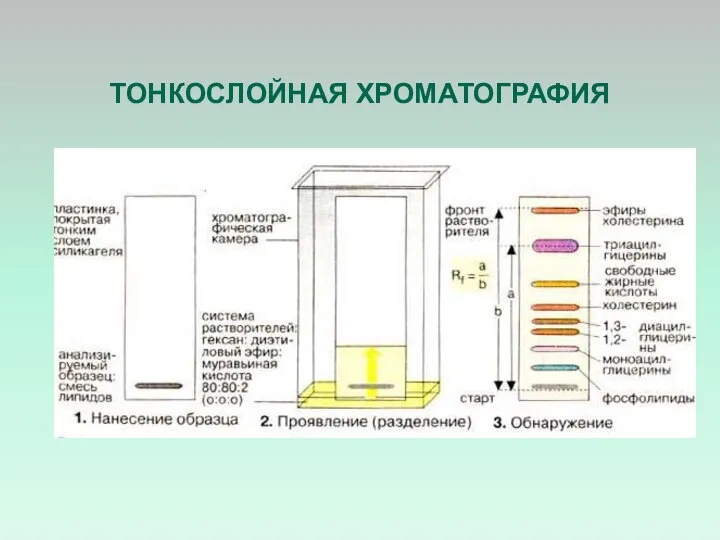
- 41. ТОНКОСЛОЙНАЯ ХРОМАТОГРАФИЯ
- 42. ВЫДЕЛЕНИЕ МЕМБРАННЫХ БЕЛКОВ МЕМБРАННЫЕ БЕЛКИ СВЯЗАНЫ С ЛИПИДАМИ, ПОЭТОМУ ДЛЯ ИХ ВЫДЕЛЕНИЯ ИСПОЛЬЗУЮТ ДЕТЕРГЕНТЫ («РАЗРУШИТЕЛИ» МЕМБРАН)
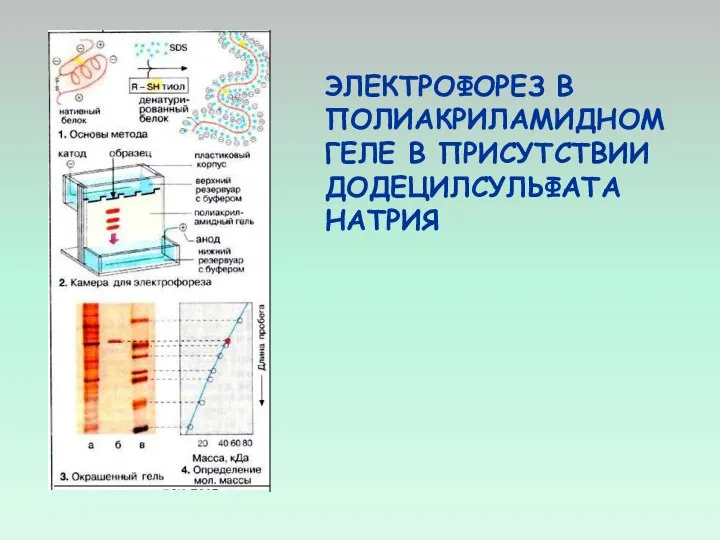
- 43. ДЛЯ ИДЕНТИФИКАЦИИ БЕЛКОВ, ИМЕЮЩИХСЯ В МЕМБРАНАХ, ИСПОЛЬЗУЮТ ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ В ПРИСУТСТВИИ ДОДЕЦИЛСУЛЬФАТА НАТРИЯ.
- 44. ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ В ПРИСУТСТВИИ ДОДЕЦИЛСУЛЬФАТА НАТРИЯ
- 45. ЭЛЕКТРОФОРЕГРАММА БЕЛКОВ ИЗ ТЕНЕЙ ЭРИТРОЦИТОВ СПЕКТРИН БЕЛОК ПОЛОСЫ 3 БЕЛКИ ПОЛОС 4.1 И 4.2 АКТИН
- 46. УДАЛЕНИЕ ДЕТЕРГЕНТА путем промывания СОЗДАНИЕ ЛИПОСОМ ВСТРАИВАНИЕ В НИХ БЕЛКОВ ОПРЕДЕЛЕНИЕ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ БЕЛКОВ РЕКОНСТРКУЦИЯ БЕЛКОВ
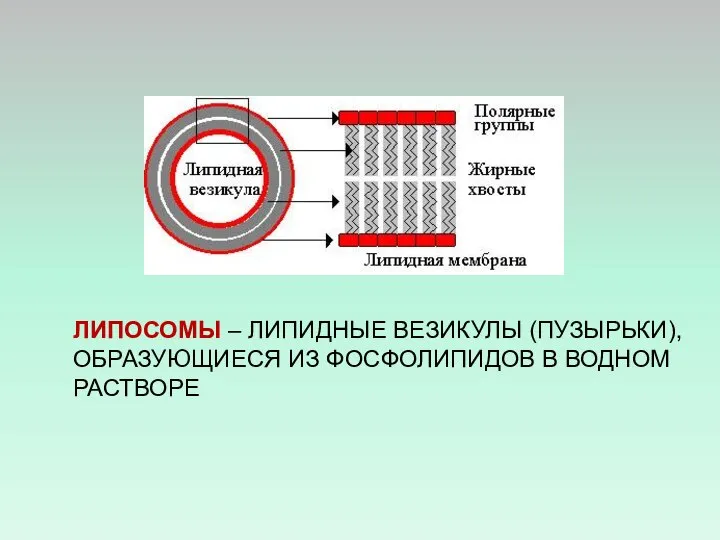
- 47. ЛИПОСОМЫ – ЛИПИДНЫЕ ВЕЗИКУЛЫ (ПУЗЫРЬКИ), ОБРАЗУЮЩИЕСЯ ИЗ ФОСФОЛИПИДОВ В ВОДНОМ РАСТВОРЕ
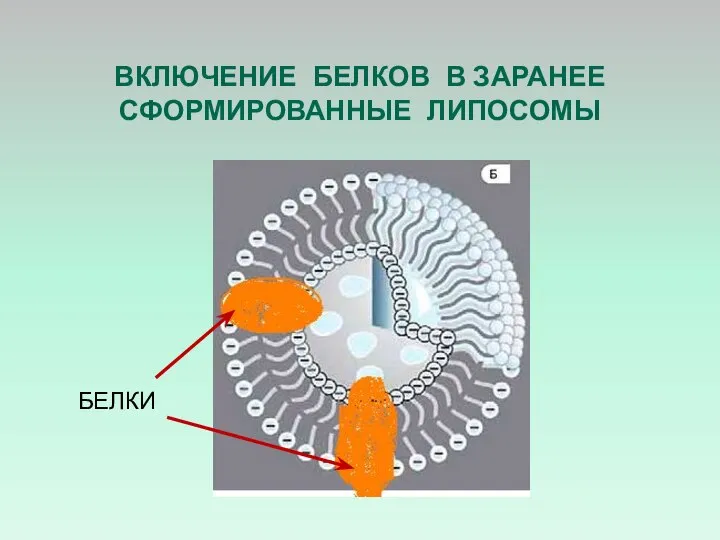
- 48. ВКЛЮЧЕНИЕ БЕЛКОВ В ЗАРАНЕЕ СФОРМИРОВАННЫЕ ЛИПОСОМЫ БЕЛКИ
- 50. Скачать презентацию




















 Западная школа геополитики
Западная школа геополитики Методы управления рисками. Метод компенсации рисков Выполнили: Минниахметова М., Сочнева а., Чуева в., Шипилова д.
Методы управления рисками. Метод компенсации рисков Выполнили: Минниахметова М., Сочнева а., Чуева в., Шипилова д. Государственные образования на белорусских землях в IX-XVII веках
Государственные образования на белорусских землях в IX-XVII веках Презентация на тему "Гигиена Зрения. Нарушения зрения у детей и их профилактика" - скачать презентации по Медицине
Презентация на тему "Гигиена Зрения. Нарушения зрения у детей и их профилактика" - скачать презентации по Медицине Филимоновская игрушка (для старших дошкольников)
Филимоновская игрушка (для старших дошкольников) Упражнения для ног и ягодиц
Упражнения для ног и ягодиц НЕПРОВЕРЯЕМЫЕ БЕЗУДАРНЫЕ ГЛАСНЫЕ. учитель: Громова С.А. МСОШ № 2 имени Е.В.Камышева города Гагарина.
НЕПРОВЕРЯЕМЫЕ БЕЗУДАРНЫЕ ГЛАСНЫЕ. учитель: Громова С.А. МСОШ № 2 имени Е.В.Камышева города Гагарина. Национальная программа « Образование» Подготовил студент группы Т093 Котов Павел
Национальная программа « Образование» Подготовил студент группы Т093 Котов Павел 4. Java OOP. 5. Abstract Classes
4. Java OOP. 5. Abstract Classes Сущность качества
Сущность качества Неорганические строительные материалы Керамические материалы. Фарфор. Фаянс. Керамика.
Неорганические строительные материалы Керамические материалы. Фарфор. Фаянс. Керамика. Организация технического обслуживания и ремонта автомобиля УАЗ Патриот
Организация технического обслуживания и ремонта автомобиля УАЗ Патриот Международная безопасность. Политический реализм и неореализм. (Лекция 12)
Международная безопасность. Политический реализм и неореализм. (Лекция 12) Ұлттық салт-дәстүрлеріміз, тіліміз бен музыкамыз, әдебиетіміз, жоралғыларымыз
Ұлттық салт-дәстүрлеріміз, тіліміз бен музыкамыз, әдебиетіміз, жоралғыларымыз PubMed – медициналық ақпапарттық желісі 4- топша
PubMed – медициналық ақпапарттық желісі 4- топша Псалмы
Псалмы Кодекс профессиональной этики инженерии программного обеспечения
Кодекс профессиональной этики инженерии программного обеспечения Открытый урок во 2 «А» классе по русскому языку
Открытый урок во 2 «А» классе по русскому языку Проблема - её роль, в жизни подростка. «Главное для человека не то, что есть, а то, что хочется….» Работы выполнила педагог-ор
Проблема - её роль, в жизни подростка. «Главное для человека не то, что есть, а то, что хочется….» Работы выполнила педагог-ор Суперкомп’ютери. Основні типи комп'ютерів
Суперкомп’ютери. Основні типи комп'ютерів ГСИ. Методики выполнения измерений
ГСИ. Методики выполнения измерений Изменения в нормативной базе для НФО (4937-У, 5075-У, 5084-У, 32-ФЗ)
Изменения в нормативной базе для НФО (4937-У, 5075-У, 5084-У, 32-ФЗ) Общественные пространства - 2018
Общественные пространства - 2018 Методические основы занятий физической культурой и спортом
Методические основы занятий физической культурой и спортом Международный бизнес проект PROэкспрессКарьера
Международный бизнес проект PROэкспрессКарьера Пристрої цифрової обробки радіолокаційних сигналів (заняття № 2.5)
Пристрої цифрової обробки радіолокаційних сигналів (заняття № 2.5) Концепция развития Свердловского округа г. Иркутска
Концепция развития Свердловского округа г. Иркутска Тема 1. Роль и назначение международных стандартов финансовой отчётности в гармонизации системы бухгалтерского учёта 1. Основные
Тема 1. Роль и назначение международных стандартов финансовой отчётности в гармонизации системы бухгалтерского учёта 1. Основные