Содержание
- 2. Я. Х. Вант-Гофф (1852–1911)
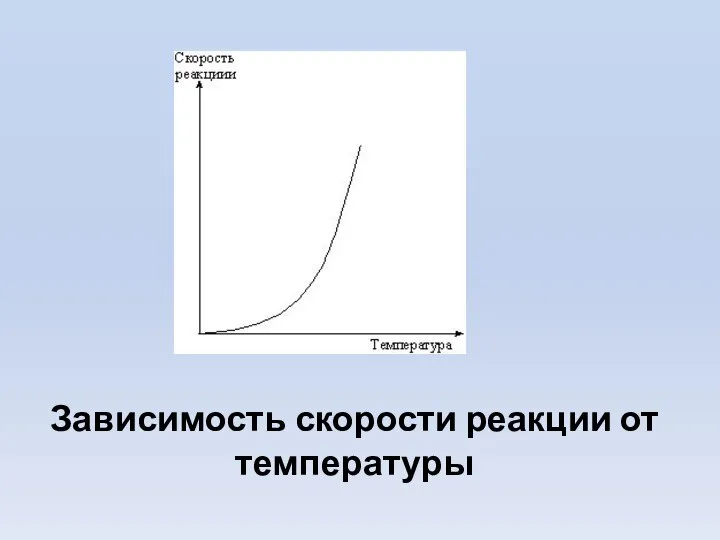
- 3. Зависимость скорости реакции от температуры
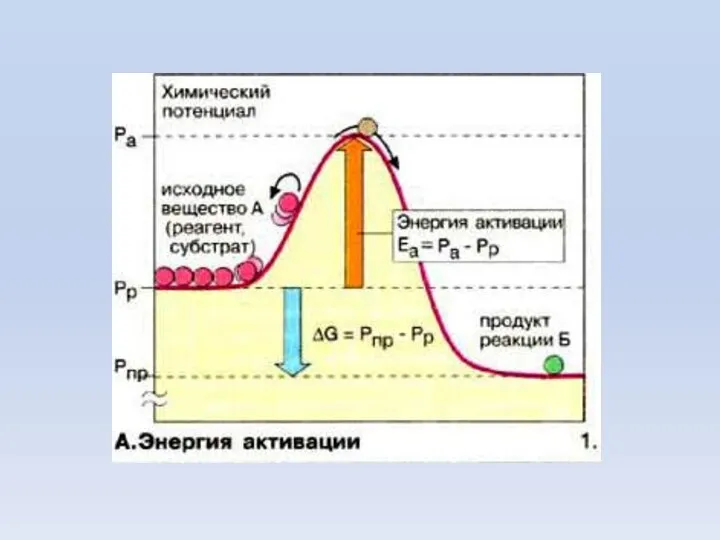
- 4. С. А.Аррениус (1859–1927) Ea - энергия активации
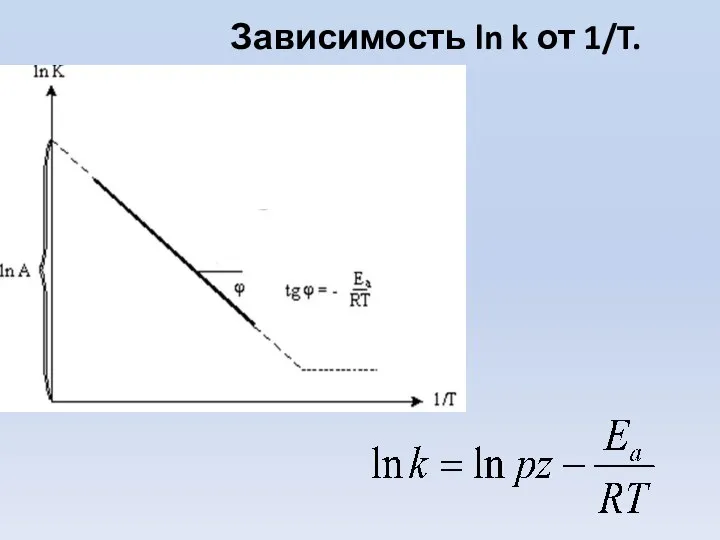
- 5. Зависимость ln k от 1/T.
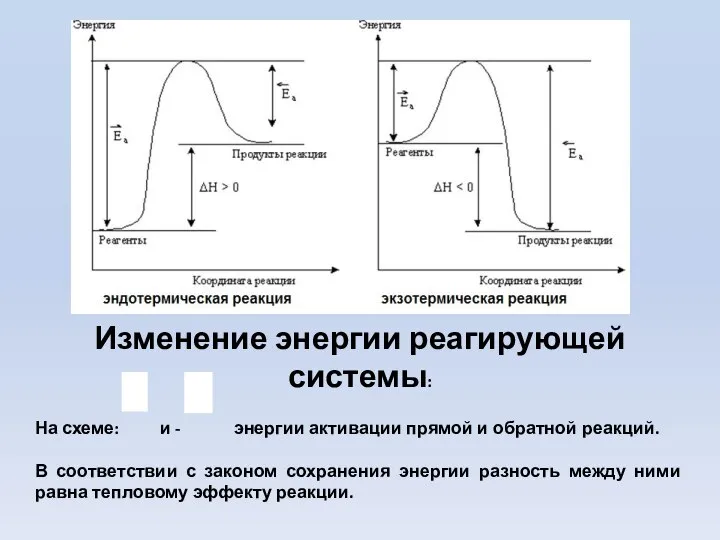
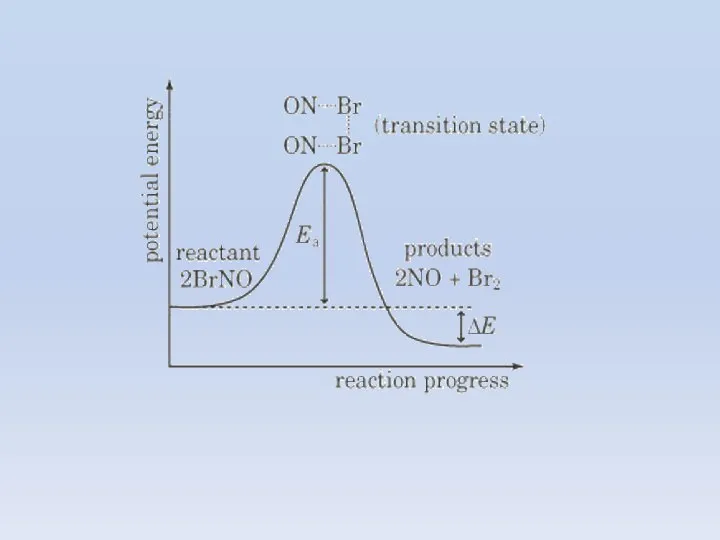
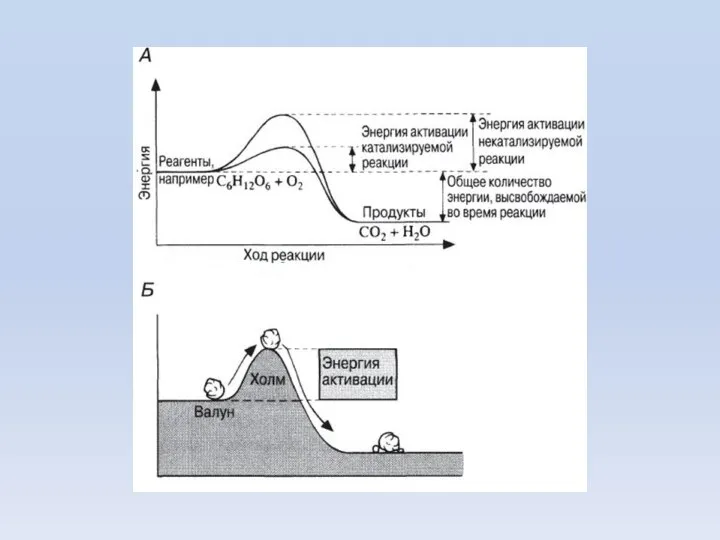
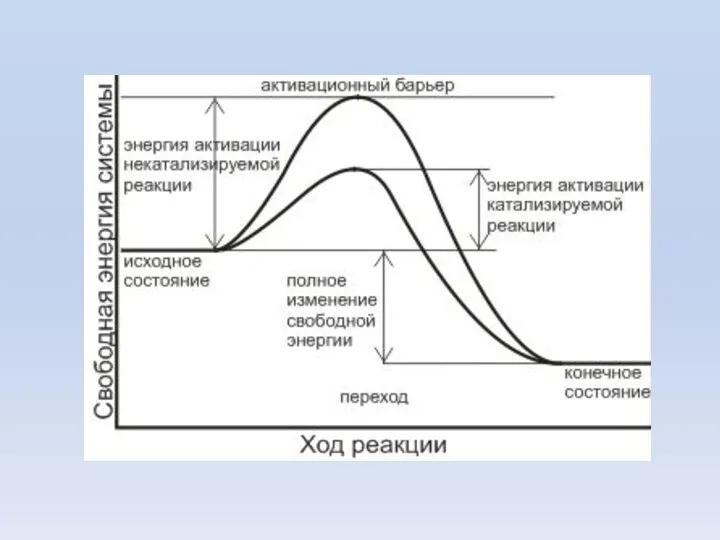
- 8. Изменение энергии реагирующей системы: На схеме: и - энергии активации прямой и обратной реакций. В соответствии
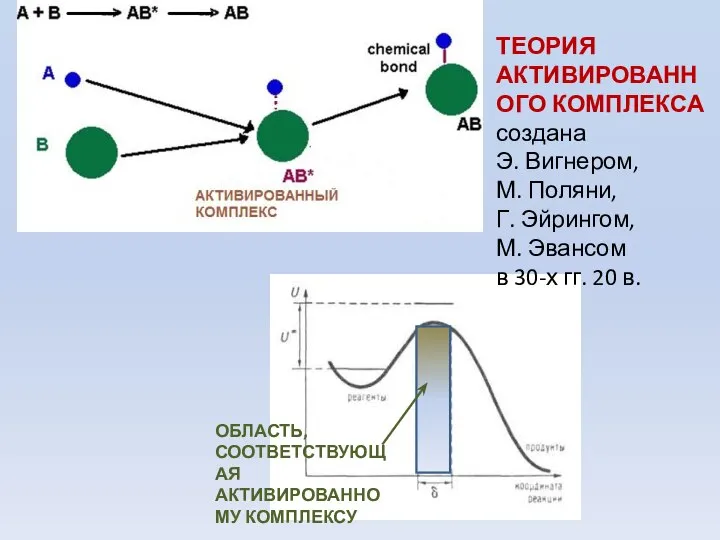
- 9. ТЕОРИЯ АКТИВИРОВАННОГО КОМПЛЕКСА создана Э. Вигнером, М. Поляни, Г. Эйрингом, М. Эвансом в 30-х гг. 20
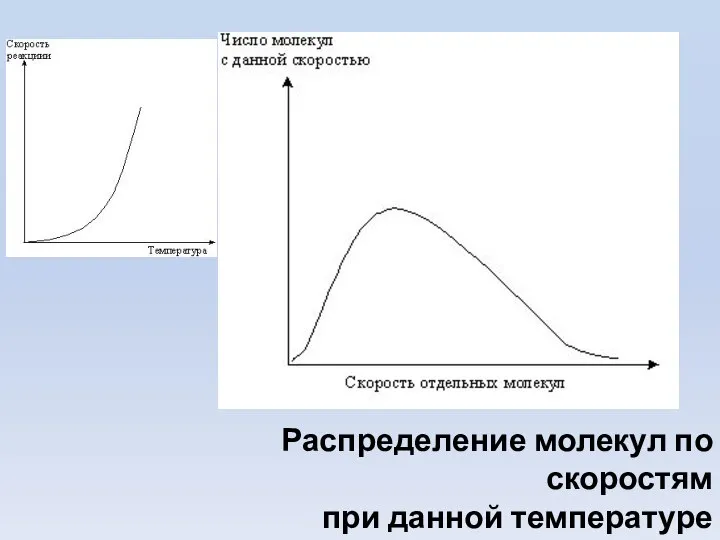
- 11. Распределение молекул по скоростям при данной температуре
- 13. КИНЕТИЧЕСКИЕ МОДЕЛИ ДЛЯ БИОЛОГИЧЕСКИХ СИСТЕМ
- 14. ОСОБЕННОСТИ КИНЕТИКИ БИОЛОГИЧЕСКИХ СИСТЕМ (БС) 1. В БС в качестве переменных выступают не только концентрации, но
- 15. Модель Мальтуса. Экспоненциальный рост α — коэффициент прироста x0 — численность популяции в начальный момент времени.
- 16. Модель Ферхюльста. Рост популяции, ограниченный ресурсами Пьер Ферхюльст 1804 - 1849 Ограниченный рост. Зависимость величины скорости
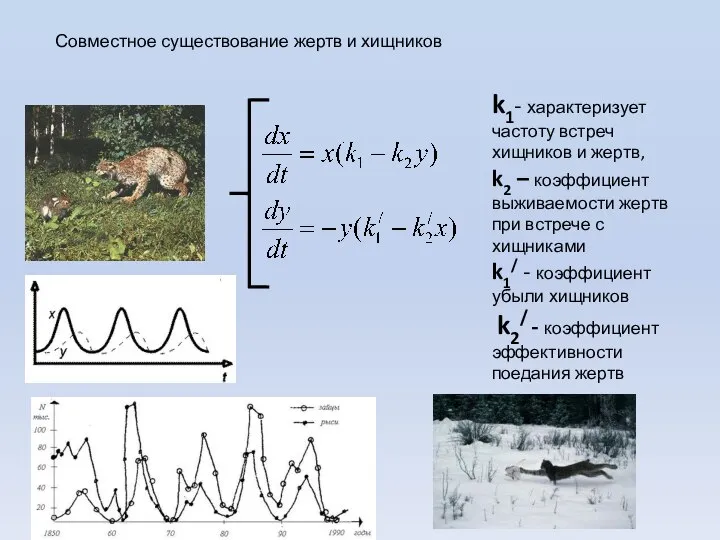
- 17. Модель Вольтерры «хищник - жертва» Вито Вольтерра 1860 - 1940, Рост численности жертв Убыль хищников k1-
- 18. k1- характеризует частоту встреч хищников и жертв, k2 – коэффициент выживаемости жертв при встрече с хищниками
- 19. ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
- 20. ОСОБЕННОСТИ ФЕРМЕНТОВ СКОРОСТЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ В 108 – 1020 РАЗ БОЛЬШЕ, ЧЕМ СООТВЕТСТВУЮЩИХ НЕКАТАЛИЗИРУЕМЫХ РЕАКЦИЙ. СПЕЦИФИЧНОСТЬ
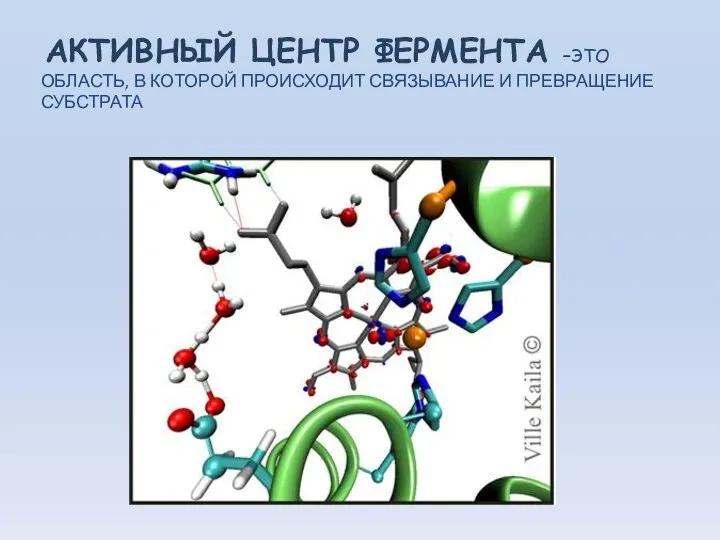
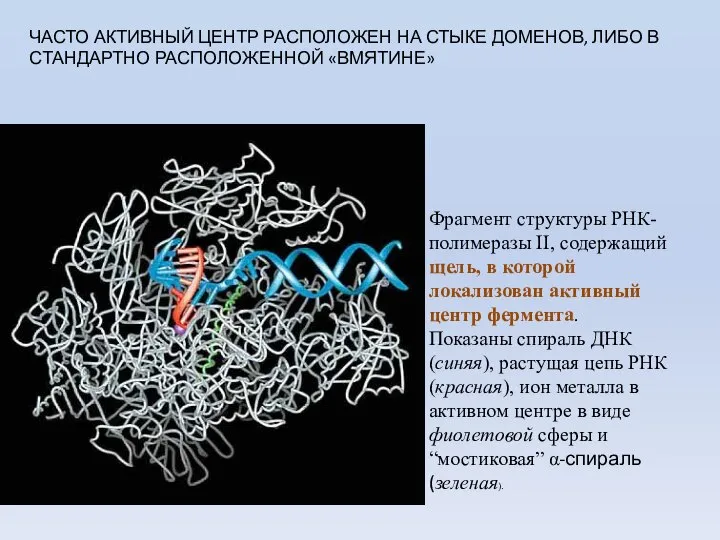
- 21. АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА –ЭТО ОБЛАСТЬ, В КОТОРОЙ ПРОИСХОДИТ СВЯЗЫВАНИЕ И ПРЕВРАЩЕНИЕ СУБСТРАТА
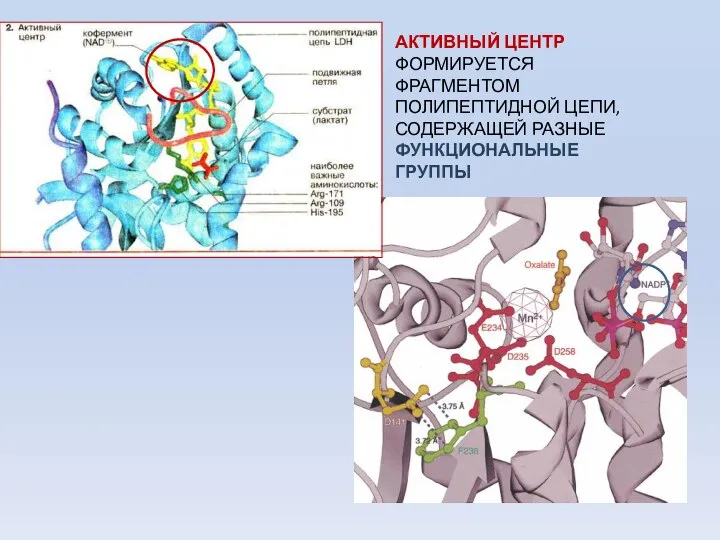
- 22. АКТИВНЫЙ ЦЕНТР ФОРМИРУЕТСЯ ФРАГМЕНТОМ ПОЛИПЕПТИДНОЙ ЦЕПИ, СОДЕРЖАЩЕЙ РАЗНЫЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
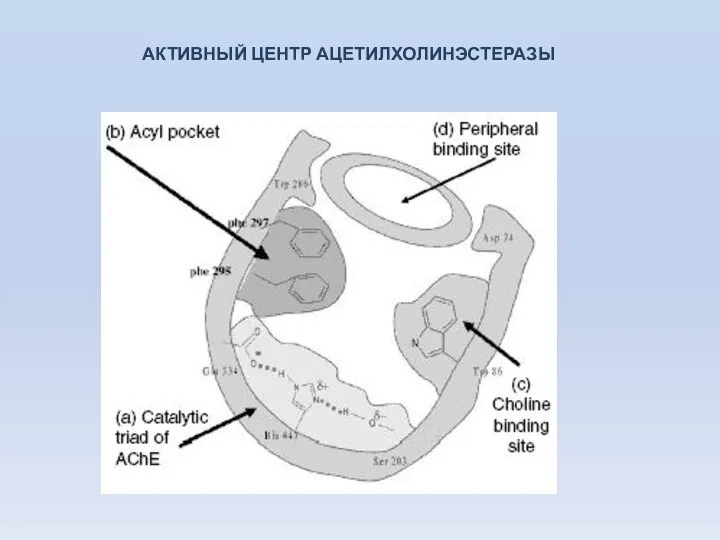
- 23. АКТИВНЫЙ ЦЕНТР АЦЕТИЛХОЛИНЭСТЕРАЗЫ
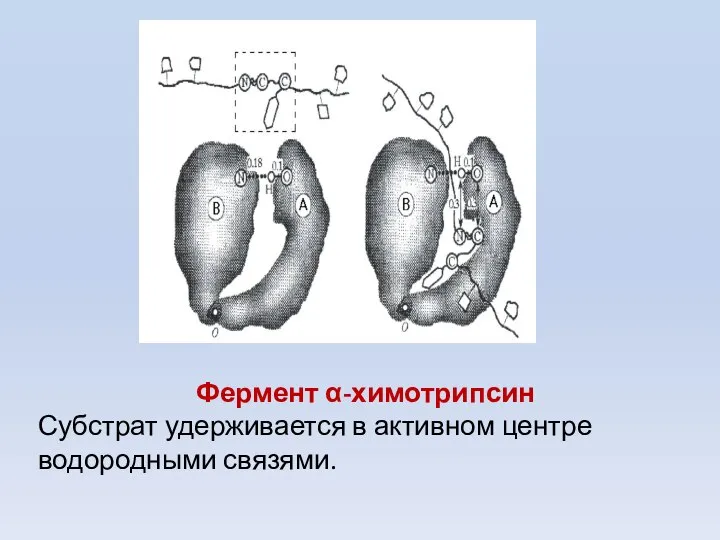
- 24. Фермент α-химотрипсин Субстрат удерживается в активном центре водородными связями.
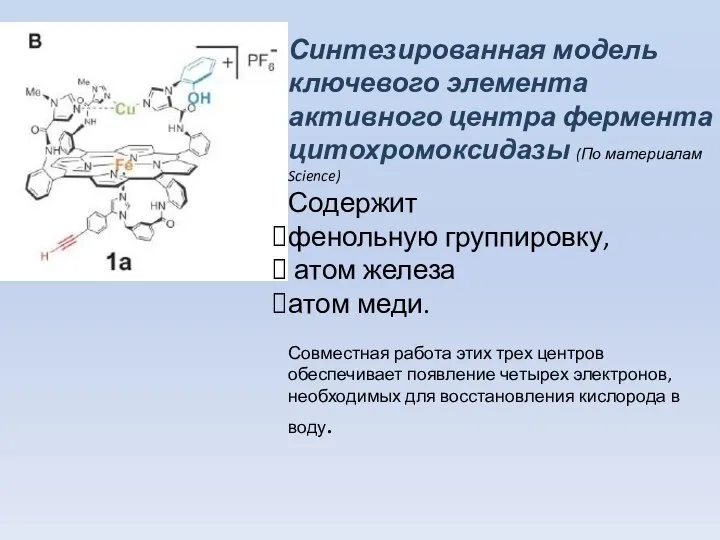
- 25. Синтезированная модель ключевого элемента активного центра фермента цитохромоксидазы (По материалам Science) Содержит фенольную группировку, атом железа
- 26. РОЛЬ ФУНКЦИОНАЛЬНЫХ ГРУПП УЧАСТИЕ В СОРБЦИИ СУБСТРАТА УЧАСТИЕ В ХИМИЧЕСКОМ ПРЕВРАЩЕНИИ СУБСТРАТА
- 27. Фрагмент структуры РНК-полимеразы II, содержащий щель, в которой локализован активный центр фермента. Показаны спираль ДНК (синяя),
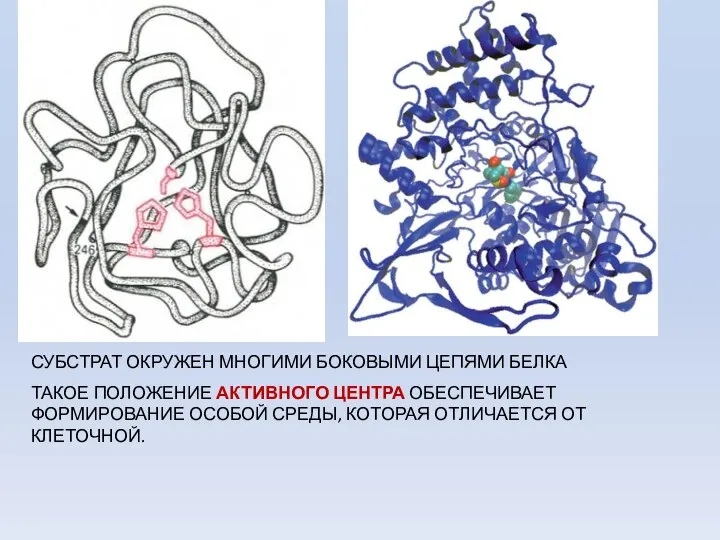
- 28. СУБСТРАТ ОКРУЖЕН МНОГИМИ БОКОВЫМИ ЦЕПЯМИ БЕЛКА ТАКОЕ ПОЛОЖЕНИЕ АКТИВНОГО ЦЕНТРА ОБЕСПЕЧИВАЕТ ФОРМИРОВАНИЕ ОСОБОЙ СРЕДЫ, КОТОРАЯ ОТЛИЧАЕТСЯ
- 29. МОДЕЛИ АКТИВНОГО ЦЕНТРА ФЕРМЕНТА
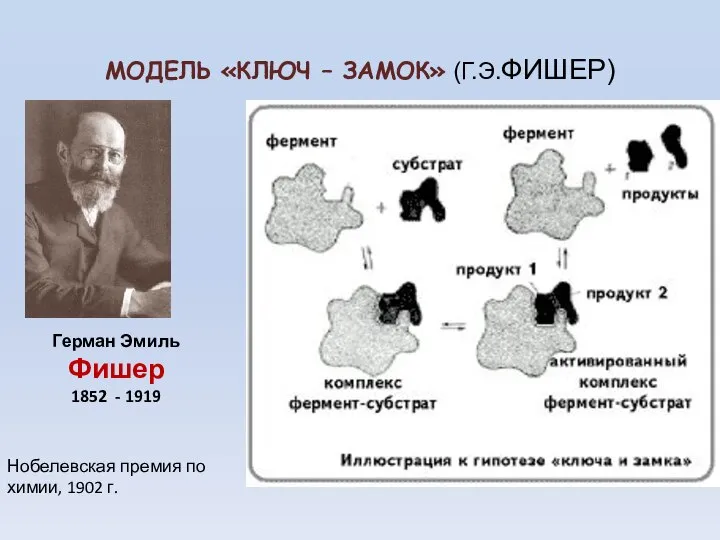
- 30. МОДЕЛЬ «КЛЮЧ – ЗАМОК» (Г.Э.ФИШЕР) Герман Эмиль Фишер 1852 - 1919 Нобелевская премия по химии, 1902
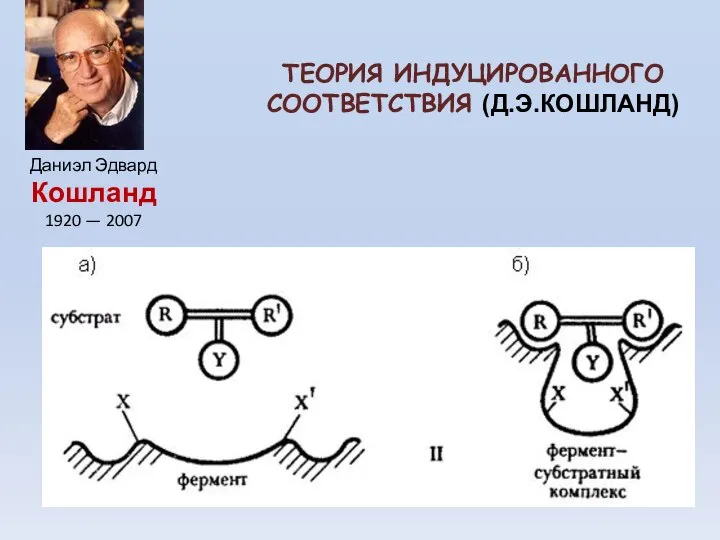
- 31. ТЕОРИЯ ИНДУЦИРОВАННОГО СООТВЕТСТВИЯ (Д.Э.КОШЛАНД) Даниэл Эдвард Кошланд 1920 — 2007
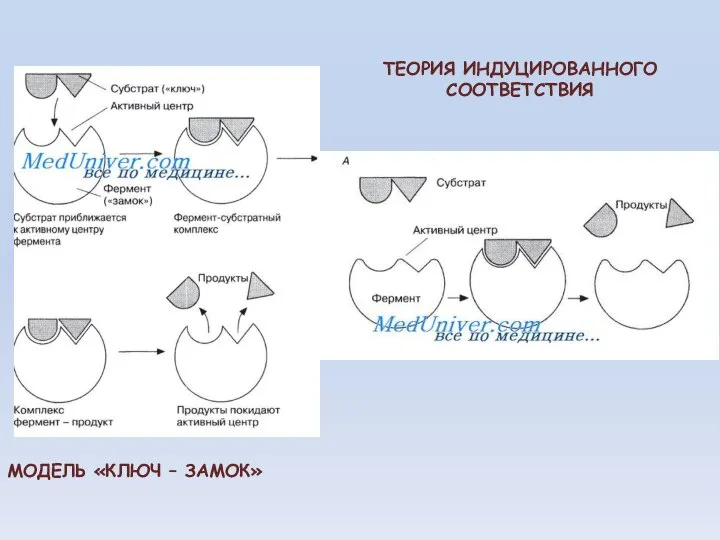
- 32. МОДЕЛЬ «КЛЮЧ – ЗАМОК» ТЕОРИЯ ИНДУЦИРОВАННОГО СООТВЕТСТВИЯ
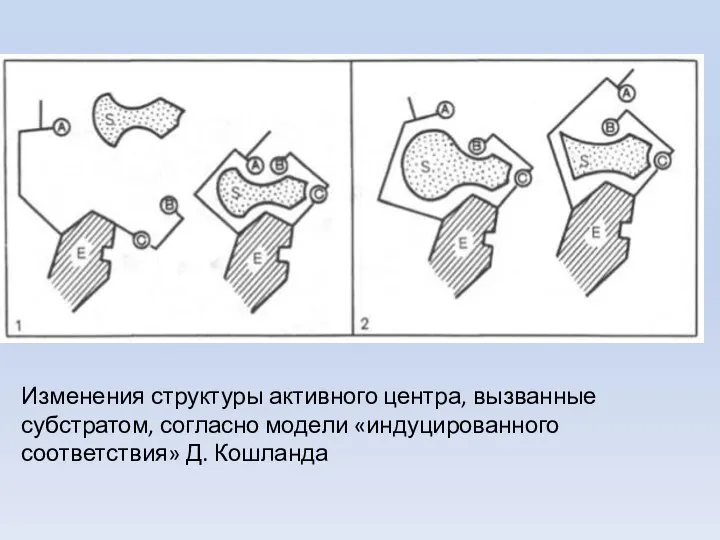
- 33. Изменения структуры активного центра, вызванные субстратом, согласно модели «индуцированного соответствия» Д. Кошланда
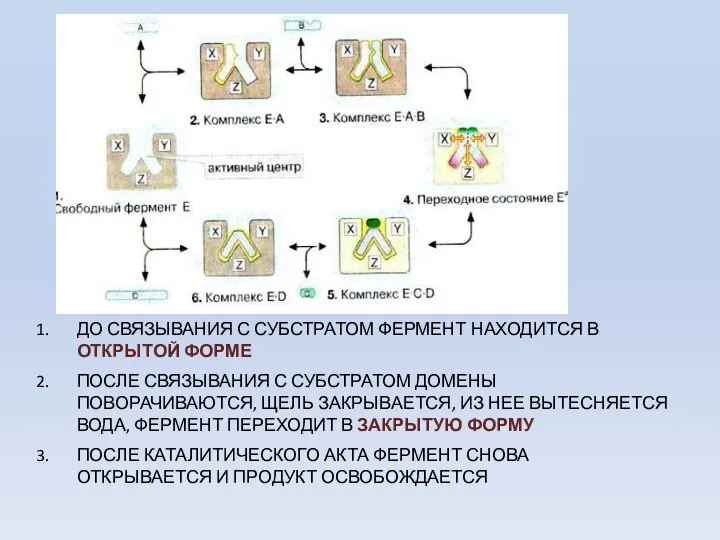
- 34. ИНДУЦИРОВАННОЕ СООТВЕТСТВИЕ ДОСТИГАЕТСЯ СМЕЩЕНИЕМ ЛИБО КРУПНЫХ БЛОКОВ, ЛИБО ЦЕЛЫХ БЕЛКОВЫХ ДОМЕНОВ. ЭТИ СМЕЩЕНИЯ ПРОИСХОДЯТ ПУТЕМ МЕЛКИХ
- 35. ДО СВЯЗЫВАНИЯ С СУБСТРАТОМ ФЕРМЕНТ НАХОДИТСЯ В ОТКРЫТОЙ ФОРМЕ ПОСЛЕ СВЯЗЫВАНИЯ С СУБСТРАТОМ ДОМЕНЫ ПОВОРАЧИВАЮТСЯ, ЩЕЛЬ
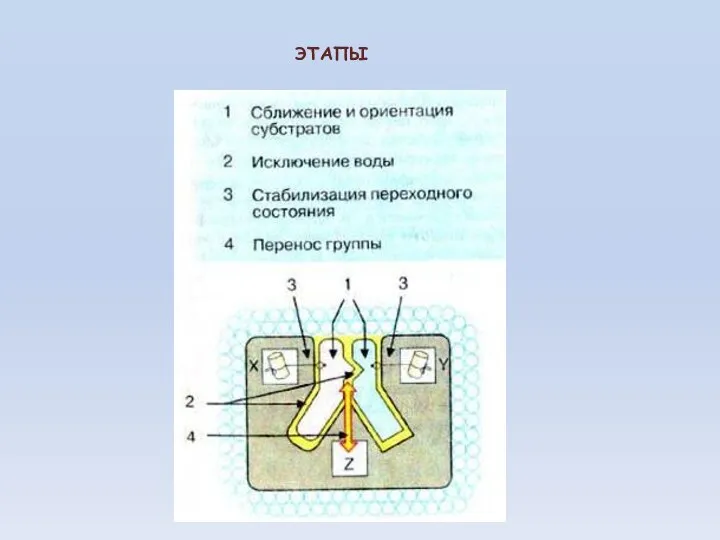
- 36. ЭТАПЫ
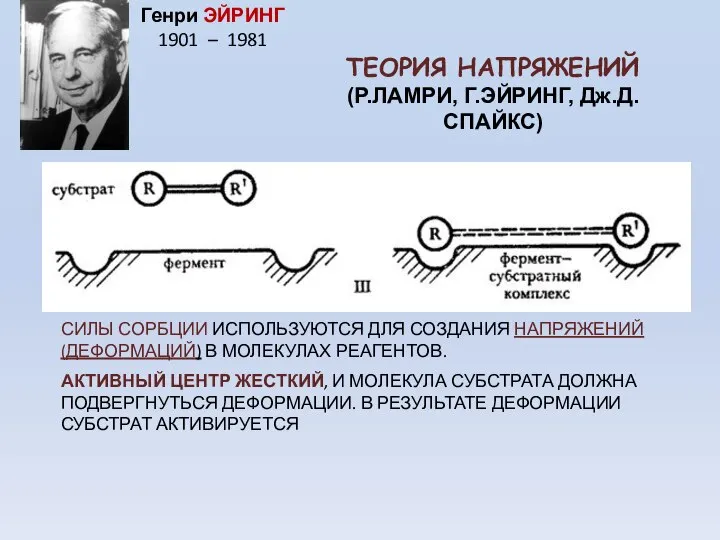
- 37. ТЕОРИЯ НАПРЯЖЕНИЙ (Р.ЛАМРИ, Г.ЭЙРИНГ, Дж.Д.СПАЙКС) СИЛЫ СОРБЦИИ ИСПОЛЬЗУЮТСЯ ДЛЯ СОЗДАНИЯ НАПРЯЖЕНИЙ (ДЕФОРМАЦИЙ) В МОЛЕКУЛАХ РЕАГЕНТОВ. АКТИВНЫЙ
- 38. В реальных системах ни субстрат, ни фермент не являются жесткими молекулами. При связывании претерпевают конформационные изменения,
- 39. ТЕРМОДИНАМИЧЕСКАЯ СУЩНОСТЬ всех этих теорий одна: потенциальная свободная энергия связывания (сорбции) субстрата на ферменте тратится на
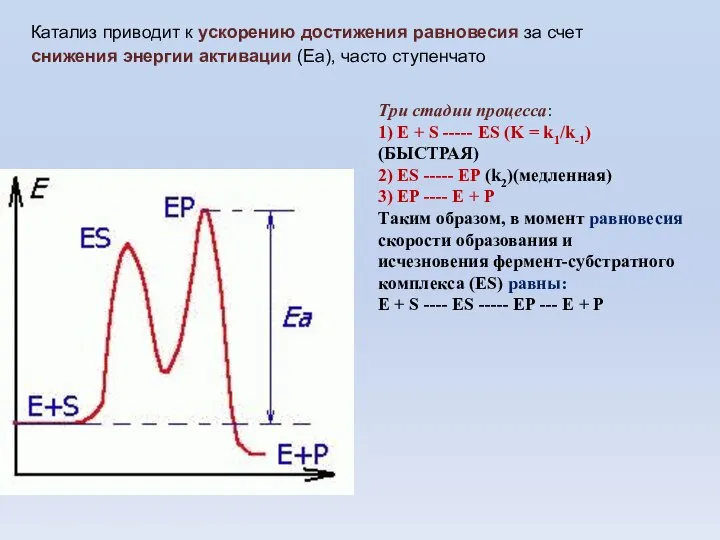
- 42. Три стадии процесса: 1) E + S ----- ES (K = k1/k-1) (БЫСТРАЯ) 2) ES -----
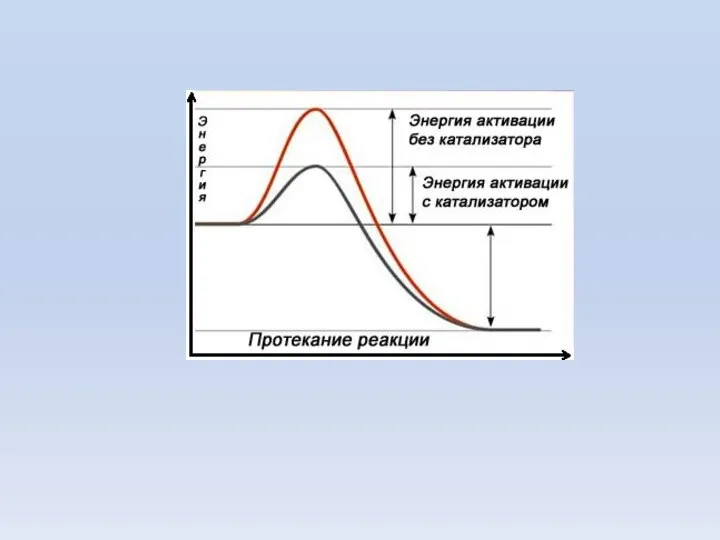
- 43. Разложение перекиси водорода Неферметативный путь: энергия активации 75 кДж/моль Ферментативный путь (каталаза): энергия активации 8 кДж/моль
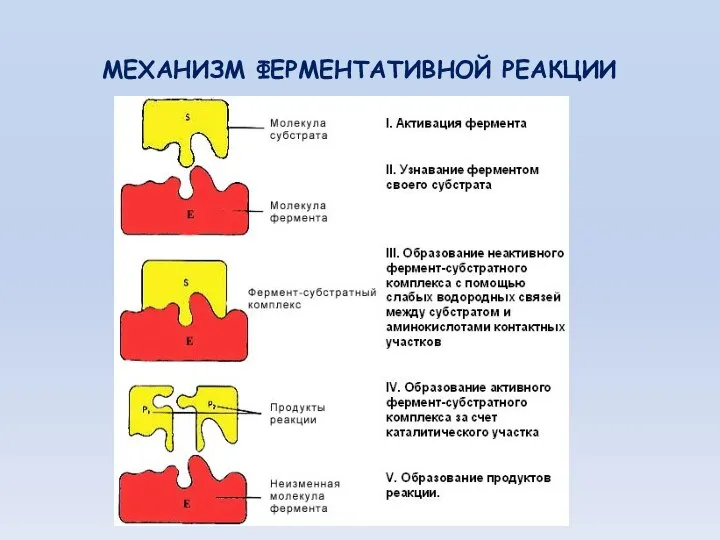
- 44. МЕХАНИЗМ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
- 45. В образовании фермент-субстратных комплексов участвуют водородные связи электростатические взаимодействия гидрофобные взаимодействия ковалентные, координационные Информация о природе
- 46. Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее
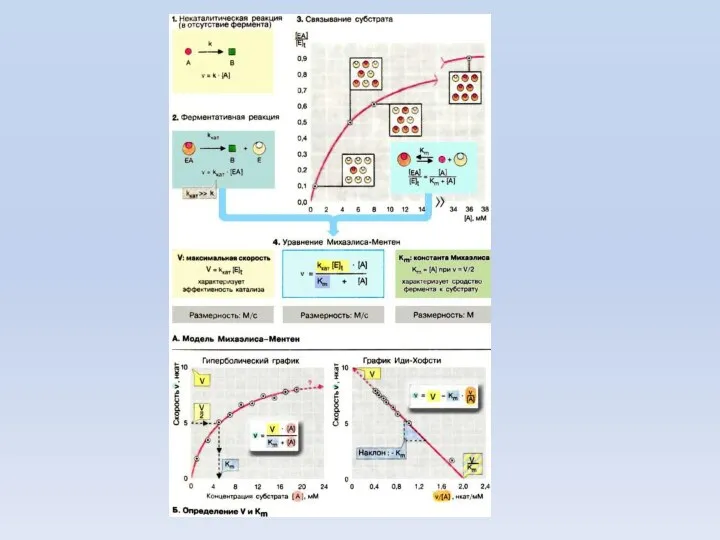
- 47. ВЫВОД УРАВНЕНИЯ МИХАЭЛИСА – МЕНТЕН
- 48. Леонор МИХАЭЛИС 1875 –1949 Мод Леонора МЕНТЕН 1879 –1960
- 50. Допущения: 1) В стационарном состоянии скорости образования и расходования ES равны; 2) Весь фермент в условиях
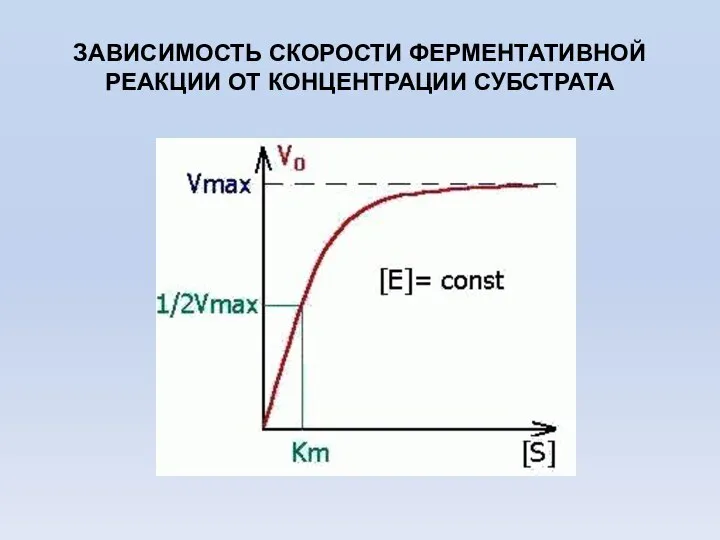
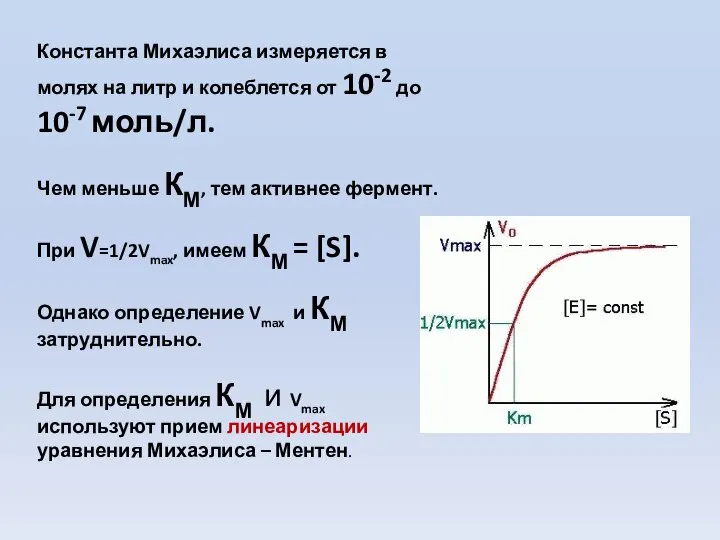
- 51. ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ СУБСТРАТА
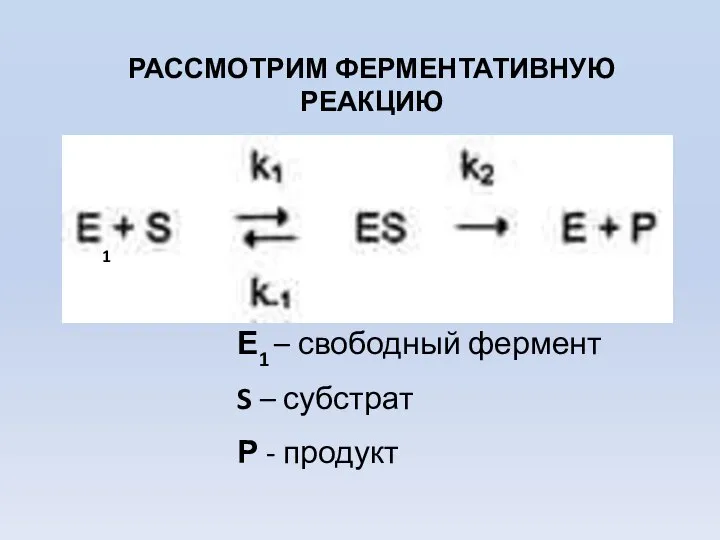
- 52. РАССМОТРИМ ФЕРМЕНТАТИВНУЮ РЕАКЦИЮ Е1 – свободный фермент S – субстрат Р - продукт
- 53. РАССМОТРИМ ПРИНЦИП ЗАКРЫТОСТИ СИСТЕМЫ: ОТСЮДА
- 54. СКОРОСТЬ ОБРАЗОВАНИЯ И РАСЩЕПЛЕНИЯ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА
- 55. В СТАЦИОНАРНОМ СОСТОЯНИИ V1 =0, ТОГДА
- 57. ВЫРАЗИМ [ES]
- 58. ОТНОШЕНИЯ КОНСТАНТ СКОРОСТЕЙ ТОГДА
- 59. ЗАПИШЕМ СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ КАК СКОРОСТЬ ОБРАЗОВАНИЯ ПРОДУКТА ПОДСТАВИМ ВЫРАЖЕНИЕ ДЛЯ ES
- 60. ПОЛУЧИМ
- 61. УЧТЕМ, ЧТО В ЭТОЙ СИТУАЦИИ ВЕСЬ ФЕРМЕНТ ПОШЕЛ НА ОБРАЗОВАНИЕ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА.
- 62. В ИТОГЕ ПОЛУЧИМ УРАВНЕНИЕ МИХАЭЛИСА – МЕНТЕН
- 63. Константа Михаэлиса измеряется в молях на литр и колеблется от 10-2 до 10-7 моль/л. Чем меньше
- 64. ЛИНЕЙНЫЕ ПРЕОБРАЗОВАНИЯ УРАВНЕНИЯ МИХАЭЛИСА – МЕНТЕН
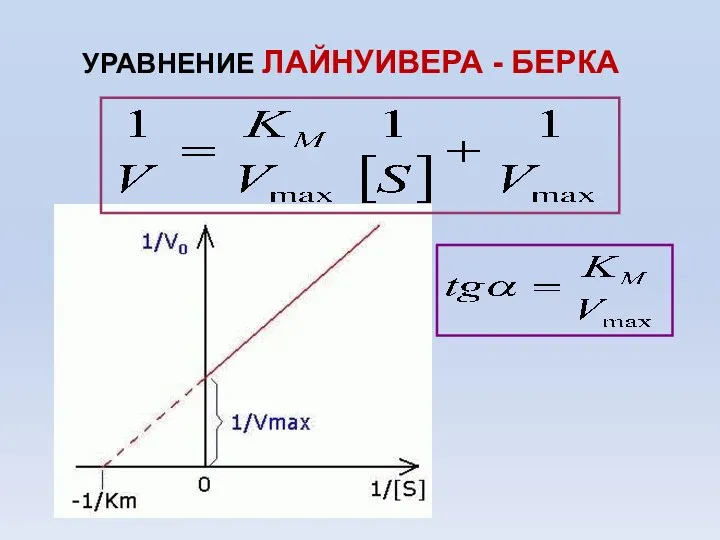
- 65. УРАВНЕНИЕ ЛАЙНУИВЕРА - БЕРКА
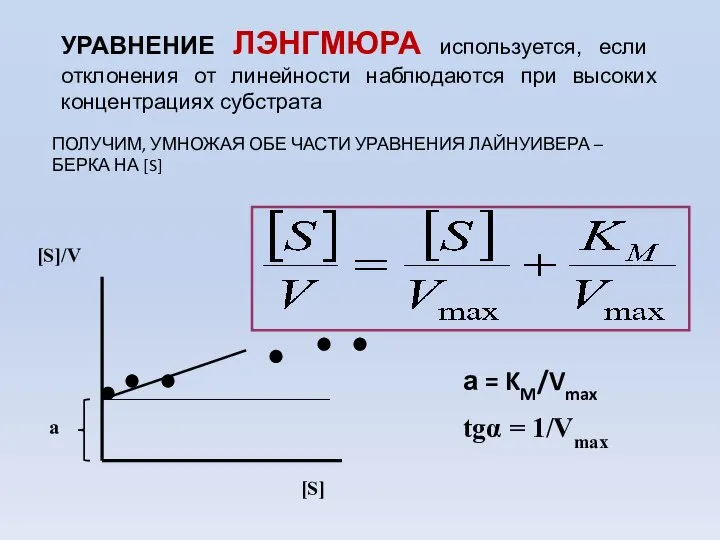
- 66. УРАВНЕНИЕ ЛЭНГМЮРА используется, если отклонения от линейности наблюдаются при высоких концентрациях субстрата ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ
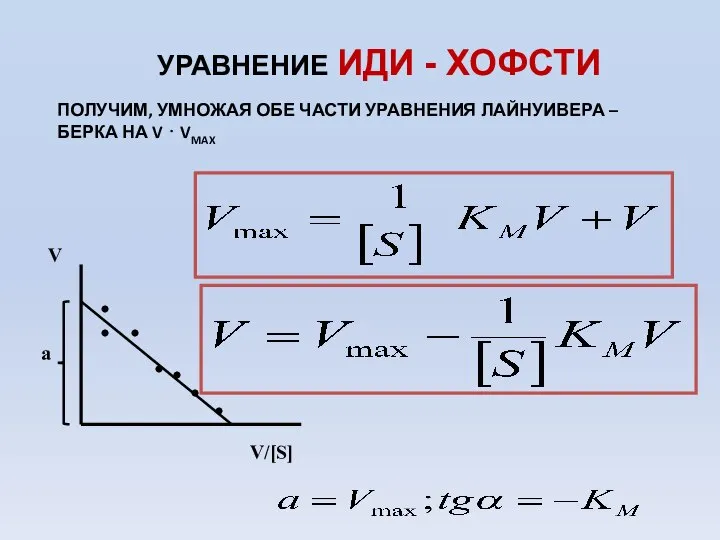
- 67. УРАВНЕНИЕ ИДИ - ХОФСТИ ПОЛУЧИМ, УМНОЖАЯ ОБЕ ЧАСТИ УРАВНЕНИЯ ЛАЙНУИВЕРА – БЕРКА НА V ⋅ VMAX
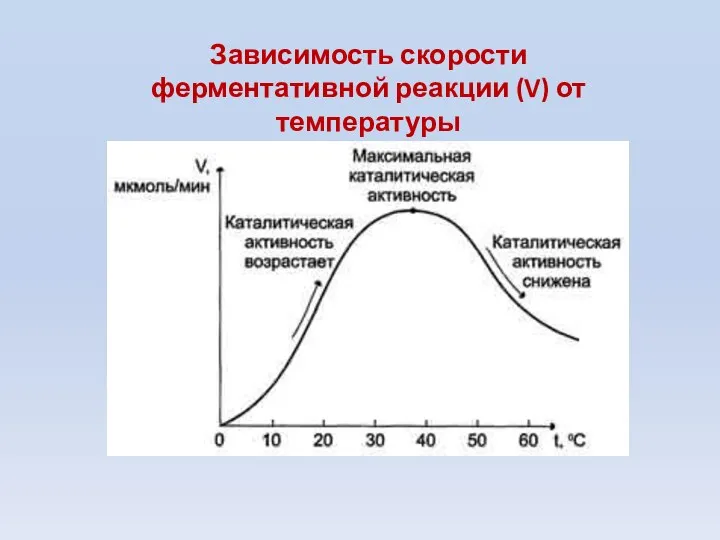
- 68. Зависимость скорости ферментативной реакции (V) от температуры
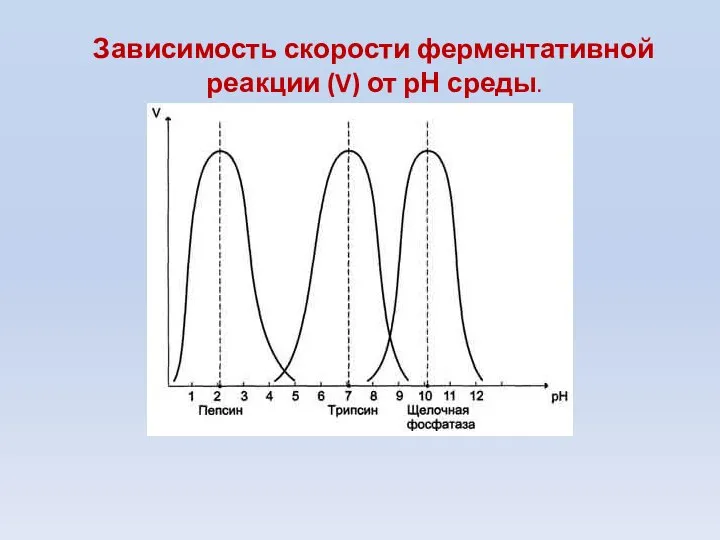
- 69. Зависимость скорости ферментативной реакции (V) от рН среды.
- 71. Скачать презентацию
























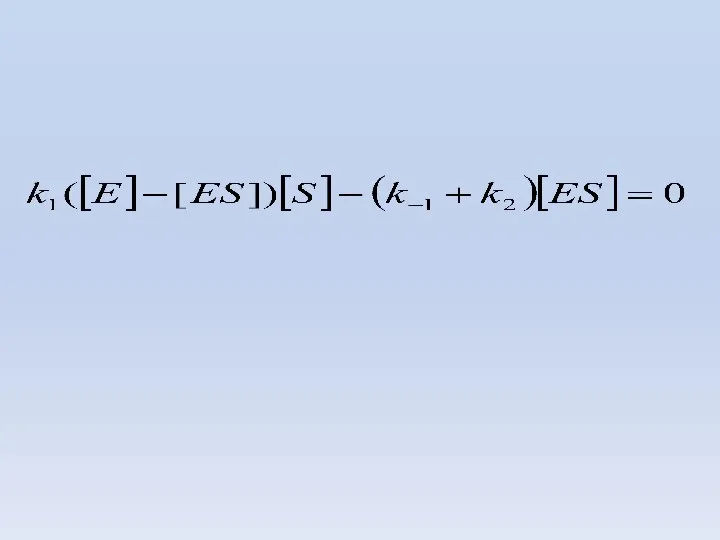
![ВЫРАЗИМ [ES]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302944/slide-56.jpg)


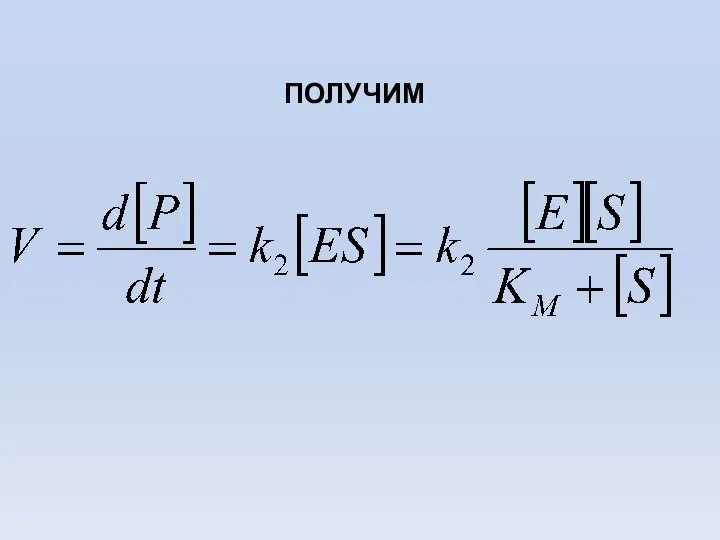



 Гладиаторы
Гладиаторы Безработица в России. Защита от безработицы
Безработица в России. Защита от безработицы Спам — массовая рассылка коммерческой, политической и иной рекламы
Спам — массовая рассылка коммерческой, политической и иной рекламы Благоустройсто сквера Нижнекисляйского городского поселения Нижний Кисляй Бутурлиновского муниципального района
Благоустройсто сквера Нижнекисляйского городского поселения Нижний Кисляй Бутурлиновского муниципального района Деловая игра: ««Рынок и законы его функционирования»»
Деловая игра: ««Рынок и законы его функционирования»»  Вегетативная нервная система
Вегетативная нервная система  Хронический гепатит
Хронический гепатит  Выпускная работа: «Оборудование стендов (9-10) для проведения электромонтажных практических работ электромонтажной мастерской»
Выпускная работа: «Оборудование стендов (9-10) для проведения электромонтажных практических работ электромонтажной мастерской» Вольтер. Биография
Вольтер. Биография Аттестационная работа. Развитие исследовательской деятельности учащихся через создание виртуального школьного музея
Аттестационная работа. Развитие исследовательской деятельности учащихся через создание виртуального школьного музея Общие правила огнеупорной кладки
Общие правила огнеупорной кладки Правила поведения в обществе (ППВО)
Правила поведения в обществе (ППВО) Презентация Основы таможенного дела
Презентация Основы таможенного дела Культура Азербайджана
Культура Азербайджана Планетарные и дифференциальные механизмы
Планетарные и дифференциальные механизмы Масленица
Масленица Совершенствование системы разрешения конфликтов в современной организации
Совершенствование системы разрешения конфликтов в современной организации Презентация Microsoft PowerPoint (2)
Презентация Microsoft PowerPoint (2) Архитектурная типология. Категории и понятия
Архитектурная типология. Категории и понятия Характеристика возбуждения и торможения в ЦНС.
Характеристика возбуждения и торможения в ЦНС. Гибридные автомобили. Схема гибридного автомобиля
Гибридные автомобили. Схема гибридного автомобиля Халықаралық сауда тәжірибесіндегі халықаралық есепайырысулар және сақтандыру
Халықаралық сауда тәжірибесіндегі халықаралық есепайырысулар және сақтандыру Архітектура комп'ютера
Архітектура комп'ютера Кислородное голодание. Гипоксия. Выполнили : Кондратенко А. Дамаева К.
Кислородное голодание. Гипоксия. Выполнили : Кондратенко А. Дамаева К. Предварительное расследование: понятие, назначение, формы.
Предварительное расследование: понятие, назначение, формы. Обмен липидов РЕГУЛЯЦИЯ ЛИПИДНОГО ОБМЕНА
Обмен липидов РЕГУЛЯЦИЯ ЛИПИДНОГО ОБМЕНА Старинные русские народные игры
Старинные русские народные игры Арабо-мусульманский тип культуры
Арабо-мусульманский тип культуры