Содержание
- 2. Причина периодичности - порядок заполнения электронной оболочки атомов. Периодическая система элементов состоит из периодов и групп.
- 3. Номер периода совпадает с номером заполняющегося уровня. Число элементов входящих в период определяется энергетической емкостью уровня.
- 4. Элементы атомы, которых завершают заполнение своей электронной оболочки на s – подуровне называются s – элементами.
- 5. В ПЭС - 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Номер группы показывает
- 6. Первая группа - щелочные металлы. На внешнем электронном уровне один s-электрон. Электрон теряется очень легко, с
- 7. Четвёртая группа - характерны ковалентные связи, – восьми электронная оболочка инертного газа образуется за счёт образования
- 8. Пятая группа образуют только ковалентные связи. Низшая степень окисления у них -3 (NH3 - аммиак, РН3
- 9. d-элементы 1) d-орбитали заполняться не после р-орбиталей, а пропустив вперёд s-элементы следующего периода (в соответствии с
- 10. 4) Обязательно имеют степень окисления +2, когда отрываются два электрона с s-орбитали. 5) Отрицательных степеней окисления
- 11. 7) Первые члены ряда d-элементов (в побочных подгруппах) имеют определённое сходство с соответствующими р – элементами.
- 12. “Попятный ход” элементов по С.А. Щукареву: после достижения “островка стабильности” в 7 группе (Mn, Tc, Re)
- 13. Выводы из ПСЭ 1) число электронных уровней в атоме определяется номером периода, в котором находится элемент.
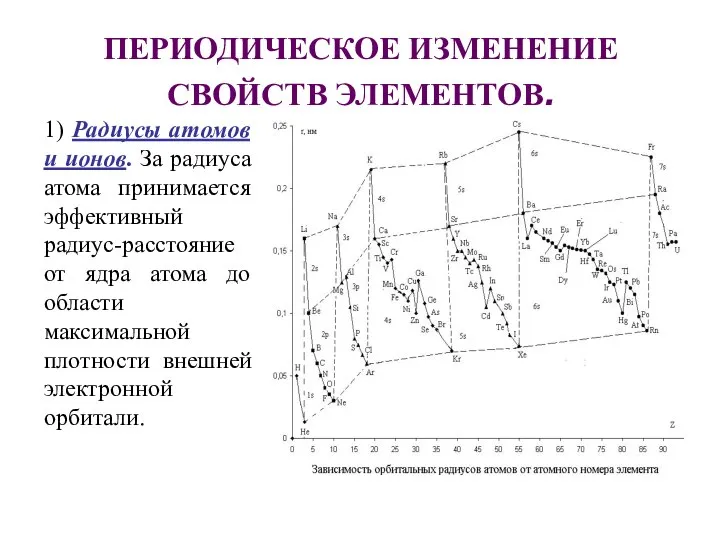
- 14. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ЭЛЕМЕНТОВ. 1) Радиусы атомов и ионов. За радиуса атома принимается эффективный радиус-расстояние от
- 15. Радиусы атомов уменьшаются в периодах с ростом порядкового номера элемента (заряда ядра). Увеличивающийся заряд ядра стягивает
- 16. Радиусы катионов меньше, а анионов – больше, чем радиусы атомов. Минимальные размеры имеют катионы высшей степени
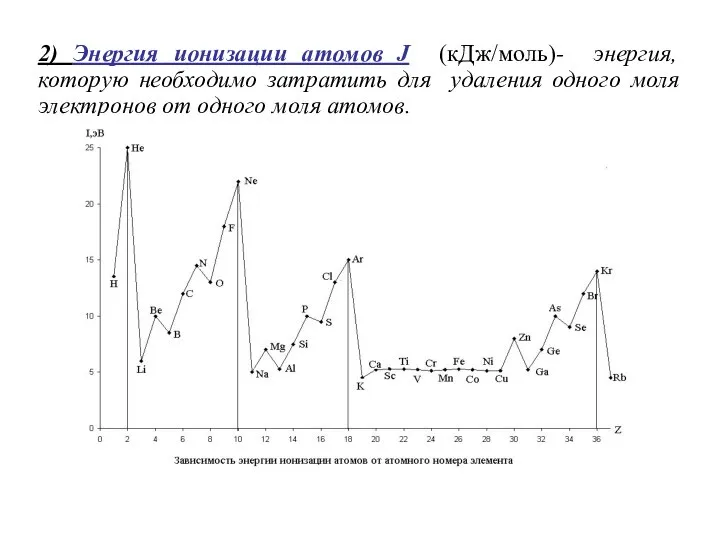
- 17. 2) Энергия ионизации атомов J (кДж/моль)- энергия, которую необходимо затратить для удаления одного моля электронов от
- 18. Высокие значения J1 наблюдаются у элементов, которые имеют достроенные оболочки. Не, Νе – достроенная р -
- 19. 3) При движении по периоду слева на право восстановительная способность падает, а окислительная растет. При движении
- 20. 4) Сродство к электрону. Наименьшие значения сродства к электрону у атомов с заполненным s и р
- 21. Сродство к электрону Максимальные значения имеют галогены, т.к. в результате присоединения электрона образуется полностью достроенный слой.
- 22. 5) Электроотрицательность. В периодах слева на право увеличивается. В группах сверху вниз уменьшается. Самый электроотрицательный элемент
- 24. Скачать презентацию



















 Система договоров в гражданском праве
Система договоров в гражданском праве Крестные страдания и смерть Иисуса Христа. Погребение Иисуса Христа
Крестные страдания и смерть Иисуса Христа. Погребение Иисуса Христа Презентация Сортировка пушно-меховых и овчинно-шубных товаров
Презентация Сортировка пушно-меховых и овчинно-шубных товаров Электронагревательные приборы
Электронагревательные приборы Мотивация и стимулирование трудовой деятельности персонала
Мотивация и стимулирование трудовой деятельности персонала Дополнительные материалы.Фомирование нового облика российского образования ( доклад, часть 2)
Дополнительные материалы.Фомирование нового облика российского образования ( доклад, часть 2) вопросы.pptx
вопросы.pptx Христианское богослужение - основные понятия
Христианское богослужение - основные понятия Sissejuhatus infotehnoloogiasse
Sissejuhatus infotehnoloogiasse Технический уровень знаний об игре баскетбол
Технический уровень знаний об игре баскетбол Гинекология Цистит у беременных женщин Выполнила :
Гинекология Цистит у беременных женщин Выполнила :  Презентация____
Презентация____ Формирование комфортной городской среды
Формирование комфортной городской среды Конституционно-правовые основы взаимоотношений личности и государства . Тема 10
Конституционно-правовые основы взаимоотношений личности и государства . Тема 10 Простой тест
Простой тест ЦЕНООБРАЗОВАНИЕ И ЦЕНОВАЯ ПОЛИТИКА ФИРМЫ
ЦЕНООБРАЗОВАНИЕ И ЦЕНОВАЯ ПОЛИТИКА ФИРМЫ Пилатес. Основные принципы методики
Пилатес. Основные принципы методики Основы программирования
Основы программирования Соблюдение законодательства при рассмотрении письменных обращений граждан, поступивших в пенсионный фонд ЛНР в 2018 году
Соблюдение законодательства при рассмотрении письменных обращений граждан, поступивших в пенсионный фонд ЛНР в 2018 году Использование коллекций
Использование коллекций Rocket Hostel
Rocket Hostel Толстовское учение
Толстовское учение ВЗАИМОДЕЙСТВИЕ СВЕТА С ВЕЩЕСТВОМ
ВЗАИМОДЕЙСТВИЕ СВЕТА С ВЕЩЕСТВОМ СТРОИТЕЛЬСТВО И ЭКСПЛУАТАЦИЯ ОБЪЕКТОВ ЛАНДШАФТНОГО СТРОИТЕЛЬСТВА
СТРОИТЕЛЬСТВО И ЭКСПЛУАТАЦИЯ ОБЪЕКТОВ ЛАНДШАФТНОГО СТРОИТЕЛЬСТВА  Новое поколение образовательных стандартов как механизм реализации национальной инициативы «Наша новая школа»
Новое поколение образовательных стандартов как механизм реализации национальной инициативы «Наша новая школа» Факторы способствующие активизации творческого потенциала
Факторы способствующие активизации творческого потенциала Быт и нравы Древней Руси
Быт и нравы Древней Руси Виды научных работ
Виды научных работ