Содержание
- 2. Рассмотрим более сложные примеры. Пусть один из электронов перешел в сос-тояние l1 = 1, а второй
- 3. Рассмотрим случай l2 = 1 (оба электрона в состоянии p). Тогда L=0, 1, 2. Если S
- 4. Если S = 1, то количество термов будет больше, т.к. тогда J = L+1, L, L-1.
- 5. Итак, двум p-электронам отвечает де-сять возможных состояний атома. Од-нако все они могут осуществиться толь-ко в том
- 6. Действительно, при данных L и S воз-можные значения магнитных кван-товых чисел ML и MS определяются условиями:
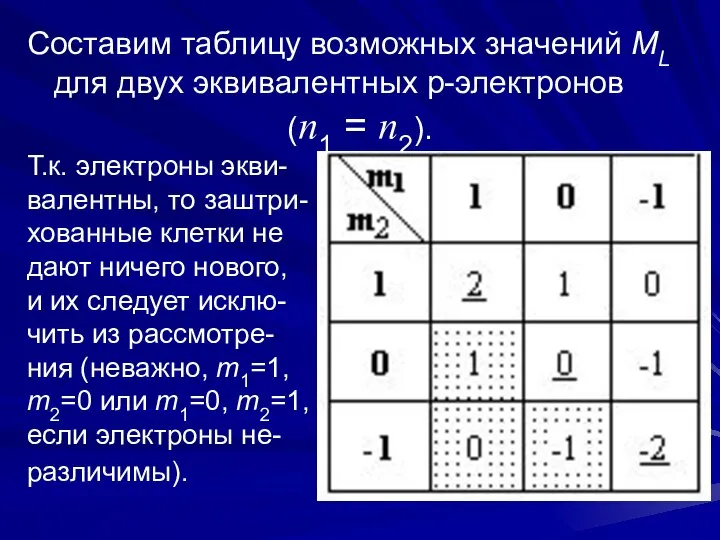
- 7. Составим таблицу возможных значений ML для двух эквивалентных p-электронов (n1 = n2). Т.к. электроны экви- валентны,
- 8. Оставшиеся значения ML можно разбить на две группы: Эти значения осуществляются, если m1=m2, это возможно, если
- 9. Если ms1 = ms2, т.е. если S=1, то невозможны состояния с m1=m2, поэтому значения ML на
- 10. Аналогичные рассуждения можно про-вести для любого количества электро-нов, причем векторная модель очень точно предсказывает особенности спектров
- 11. Правило Хунда Среди термов, принадлежащих одной элект-ронной конфигурации, самым глубоким яв-ляется тот, который связан с наибольшим
- 12. Правило Хунда является следствием взаимного отталкивания электронов. Действительно, энер-гия атома (с учетом взаимодействия между электронами) тем
- 14. Скачать презентацию










 Царская одежда
Царская одежда Dataflow bending programs
Dataflow bending programs Основной обмен
Основной обмен  Внутренние водостоки
Внутренние водостоки Сетевые технологии высокоскоростной передачи данных
Сетевые технологии высокоскоростной передачи данных Системы Автоматизации Управления Воздушным Движением
Системы Автоматизации Управления Воздушным Движением Сон. Память. Мотивации. Эмоции
Сон. Память. Мотивации. Эмоции Базовые программы обработки двумерного массива
Базовые программы обработки двумерного массива Қылмыстық кодекс
Қылмыстық кодекс Виконавча влада
Виконавча влада Разработка мобильной эстакады для транспортных средств категории М1
Разработка мобильной эстакады для транспортных средств категории М1 Структурная и инвестиционная политика
Структурная и инвестиционная политика Модели деловой карьеры
Модели деловой карьеры Объектно-ориентированное программирование. Collections Framework. (Занятие 7)
Объектно-ориентированное программирование. Collections Framework. (Занятие 7) уважаемые уважаемые коллеги!
уважаемые уважаемые коллеги! Живопись
Живопись Сегодня на сайте World-Mirchar мы дружно хеппибёздим нашу (порой вредную и противную XD, но от этого не ставшую нам менее дорогой и любимой) подругу… Caluroso.
Сегодня на сайте World-Mirchar мы дружно хеппибёздим нашу (порой вредную и противную XD, но от этого не ставшую нам менее дорогой и любимой) подругу… Caluroso. In deutsch essen
In deutsch essen Плоский прямой изгиб
Плоский прямой изгиб Cпланхнология – учение о внутренних органах.
Cпланхнология – учение о внутренних органах. Применение некоторых модуляций в системах связи
Применение некоторых модуляций в системах связи Республиканская конференция «Отечественные франшизы, как фактор роста казахстанского содержания» 31.01.2012г. «КАЗАХСТА
Республиканская конференция «Отечественные франшизы, как фактор роста казахстанского содержания» 31.01.2012г. «КАЗАХСТА Правовая сфера общества
Правовая сфера общества Уравнения n-ой степени - презентация по Алгебре_
Уравнения n-ой степени - презентация по Алгебре_ Пеностекло. Общие характеристики
Пеностекло. Общие характеристики Культурный релятивизм
Культурный релятивизм ОСТРОВНЫЕ И КОЛЬЦЕВЫЕ СИЛИКАТЫ
ОСТРОВНЫЕ И КОЛЬЦЕВЫЕ СИЛИКАТЫ Окончание процедуры банкротства и права кредиторов. (Лекция 6)
Окончание процедуры банкротства и права кредиторов. (Лекция 6)