Содержание
- 2. ЛЕКЦИЯ № 3 КЛИНИЧЕСКАЯ ЭНЗИМОЛОГИЯ, или ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ В МЕДИЦИНЕ
- 3. Актуальность темы Широкое использование ферментов в медицинской практике – диагностике и терапии, - диктует необходимость изучения
- 4. План лекции Применение ферментов как реагентов в диагностике заболеваний Применение ферментов в качестве лекарственных препаратов (энзимотерапия)
- 5. Цель лекции Знать: пути использования ферментов в медицинской практике (примеры) ферменты, используемые в энзимодиагностике, и сущность
- 6. Ферменты как реагенты ПРИМЕРЫ: Глюкозооксидаза грибов (аэробная дегидрогеназа ) – FAD-содержащий специфический фермент для определения глюкозы
- 7. Ферменты как реагенты Определение лактата в крови для оценки тяжести шока, гипоксических состояний, сахарного диабета с
- 8. Ферменты как реагенты Рестриктазы бактерий (специфические эндонуклеазы) используются для исследования генома, например, в пренатальном скрининге наследственных
- 9. Энзимотерапия Применение ферментов (гидролазы) в качестве лекарственных препаратов Заместительная терапия – использование ферментов в случае их
- 10. Энзимотерапия Комплексная терапия – применение ферментов в качестве дополнительного терапевтического средства ПРИМЕРЫ: фитогидролазы: бромелаин, папаин (широкая
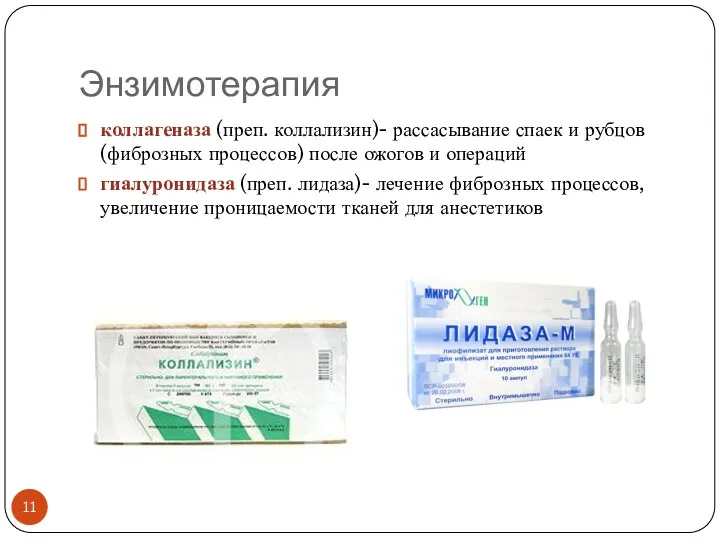
- 11. Энзимотерапия коллагеназа (преп. коллализин)- рассасывание спаек и рубцов (фиброзных процессов) после ожогов и операций гиалуронидаза (преп.
- 12. Энзимотерапия трипсин, химотрипсин – лечение гнойно-некротических ран, эмфиземы легких, бронхита фибринолизин (плазмин)– разрушение тромба при тромбозах
- 13. Энзимотерапия аспарагиназа, глутаминаза – лечение лейкозов Лейкозные клетки не способны синтезировать асн и глн – аминокислоты,
- 14. Трудности энзимотерапии нестабильность ферментов антигенные свойства трудности доставки к пораженным органам ПРИМЕР: действие фибринолизина не является
- 15. Иммобилизованные ферменты Иммобилизация (лат. immobilis – неподвижный) – связывание молекул ферментов с носителем Преимущества: устойчивость, нерастворимость
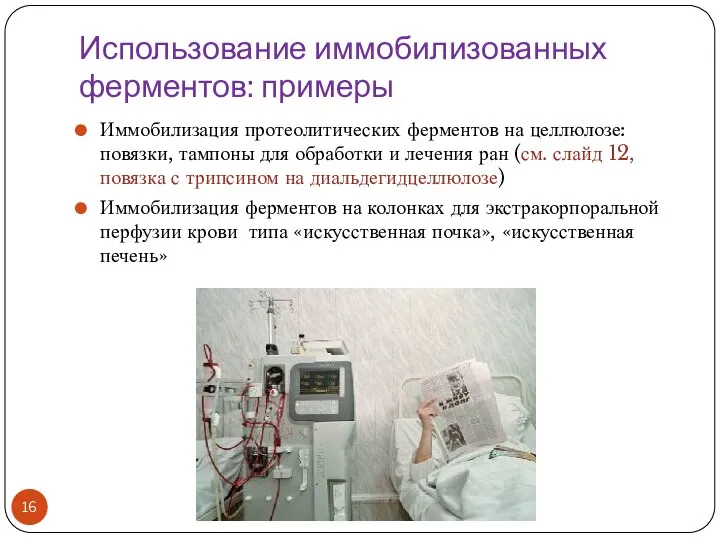
- 16. Использование иммобилизованных ферментов: примеры Иммобилизация протеолитических ферментов на целлюлозе: повязки, тампоны для обработки и лечения ран
- 17. Энзимодиагностика Постановка диагноза на основе определения активности ферментов в биологических жидкостях человека Используются ферменты, которые по
- 18. Секреторные ферменты синтезируются в печени «работают» в крови (субстрат фермента находится в крови) активность в крови
- 19. Экскреторные ферменты синтезируются в экзокринных железах «работают» в полости органов активность в крови незначительная и обусловлена
- 20. Внутриклеточные ферменты: цитоплазматические: лактатдегидрогеназа (ЛДГ), аланин (аспартат) аминотрансфераза (АЛТ, АСТ), креатинкиназа (КК) митохондриальные: АСТ лизосомные: кислая
- 21. «Требования» к ферментам энзимодиагностики Органоспецифичность (тканеспецифичность) фермента или его изоформ: преимущественная или абсолютная локализация в определенных
- 22. Изоферменты Множественные формы одного олигомерного фермента (имеющего IV структуру), обусловленные различными комбинациями разных по структуре субъединиц
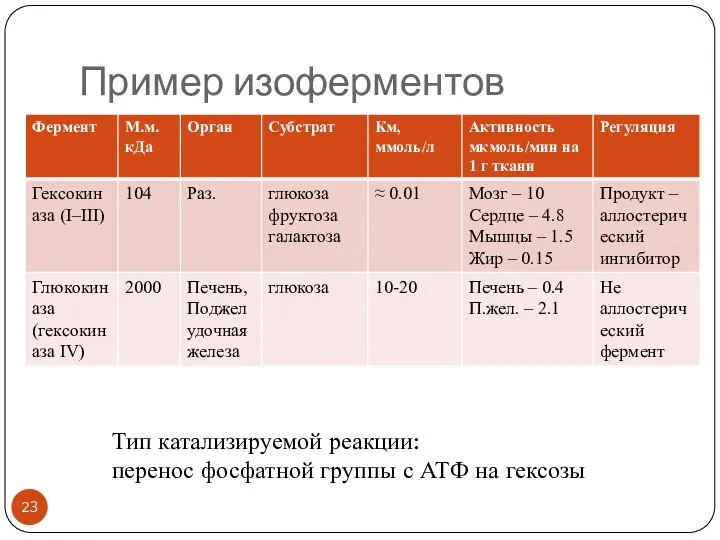
- 23. Пример изоферментов Тип катализируемой реакции: перенос фосфатной группы с АТФ на гексозы
- 24. Изоформы в диагностике заболеваний Лактатдегидрогеназа (ЛДГ) пируват + NADH+Н+ ↔ лактат + NAD+ Охарактеризуйте положение фермента
- 26. Лактатдегидрогеназа 1 и 2 – сердечные изоформы Специфичность ЛДГ 1 и 2 выше к лактату, чем
- 27. Изоформы в диагностике заболеваний Креатинкиназа (КК) креатин + АТФ ↔ креатинфосфат + АДФ Охарактеризуйте положение фермента
- 28. КК-ММ (скелетная мышца) – диагностика повреждений скелетных мышц КК-МВ (сердечная мышца) – диагностика инфаркта миокарда КК-ВВ
- 29. Почему важно определять изоферментный состав, а не просто суммарную активность фермента? Суммарная активность фермента не предоставляет
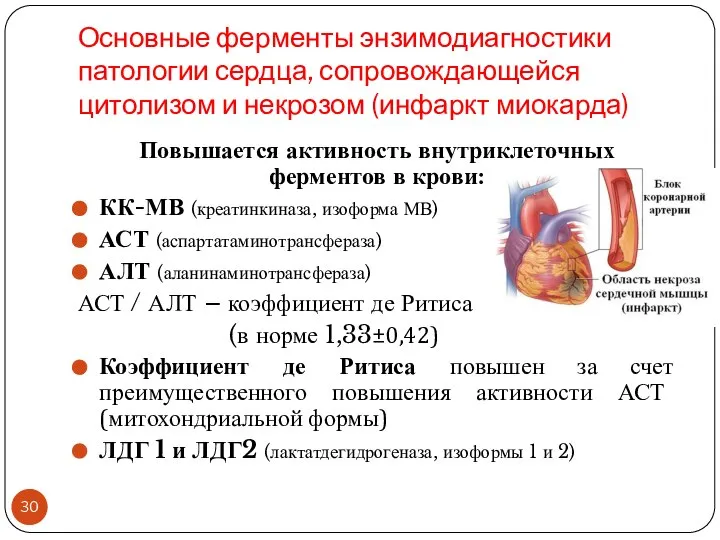
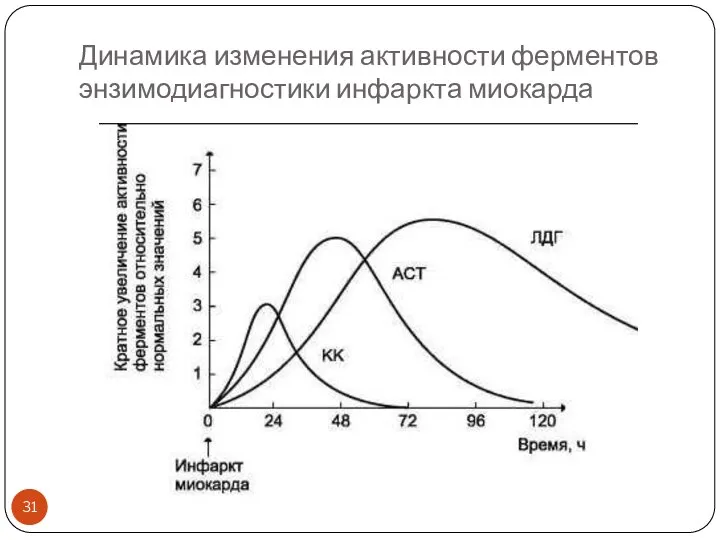
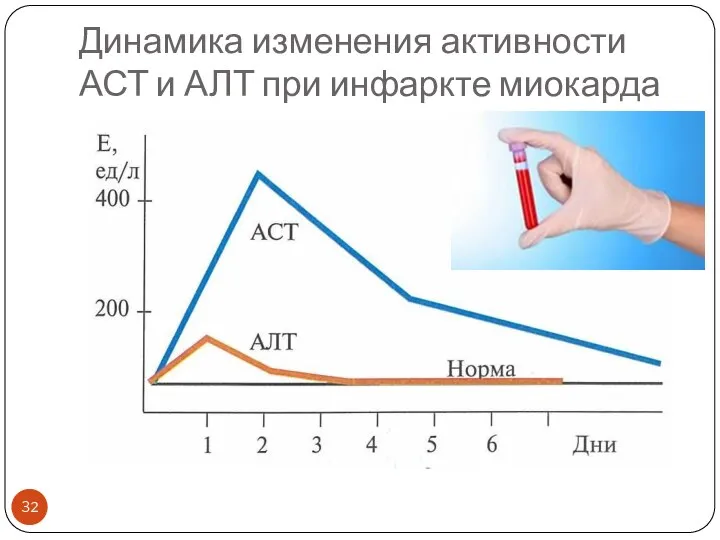
- 30. Основные ферменты энзимодиагностики патологии сердца, сопровождающейся цитолизом и некрозом (инфаркт миокарда) Повышается активность внутриклеточных ферментов в
- 31. Динамика изменения активности ферментов энзимодиагностики инфаркта миокарда
- 32. Динамика изменения активности АСТ и АЛТ при инфаркте миокарда
- 33. Основные ферменты энзимодиагностики патологии печени Воспаление, цитолиз, некроз (гепатит, цирроз) Повышается активность внутриклеточных ферментов в крови:
- 34. Динамика изменения активности АЛТ и АСТ при вирусном гепатите
- 35. Основные ферменты энзимодиагностики патологии печени Синдром холестаза Повышается активность экскреторного фермента печени в крови – ЩФ
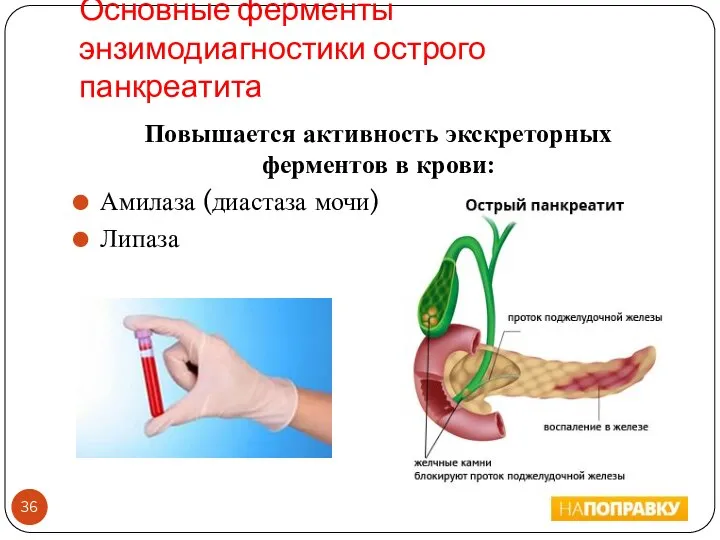
- 36. Основные ферменты энзимодиагностики острого панкреатита Повышается активность экскреторных ферментов в крови: Амилаза (диастаза мочи) Липаза
- 37. Дополнительные вопросы клинической энзимологии Использование ингибиторов ферментов в качестве лекарственных препаратов Энзимопатии
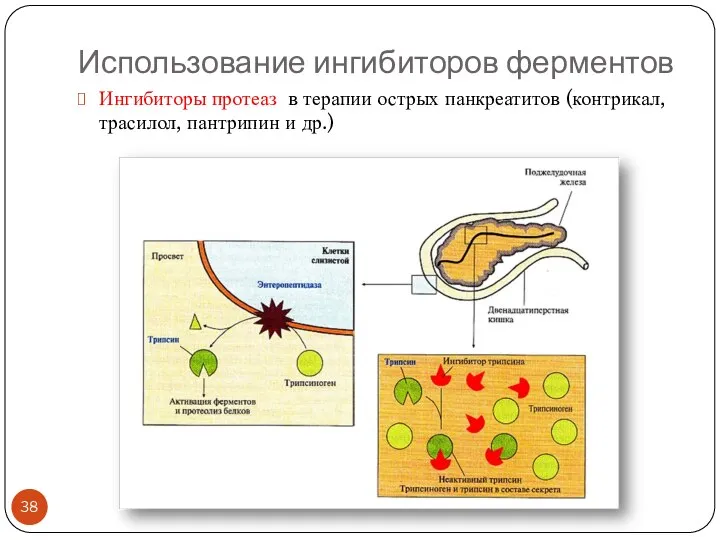
- 38. Использование ингибиторов ферментов Ингибиторы протеаз в терапии острых панкреатитов (контрикал, трасилол, пантрипин и др.)
- 39. Использование ингибиторов ферментов Ингибиторы протеаз в терапии HCV инфекции - новый класс препаратов для лечения гепатита
- 40. Использование ингибиторов ферментов Ингибиторы ангиотензин-превращающего фермента – лечение гипертонии (берлиприл, вазолонг и др.) Ингибиторы ксантиноксидазы –
- 41. Энзимопатии Патологические процессы, основанные на нарушении ферментативного катализа по причине мутации генов ферментов или нарушения экспрессии
- 42. Задание № 1 для самостоятельной работы В современной клинической лабораторной диагностике широко используется метод иммуноферментного анализа
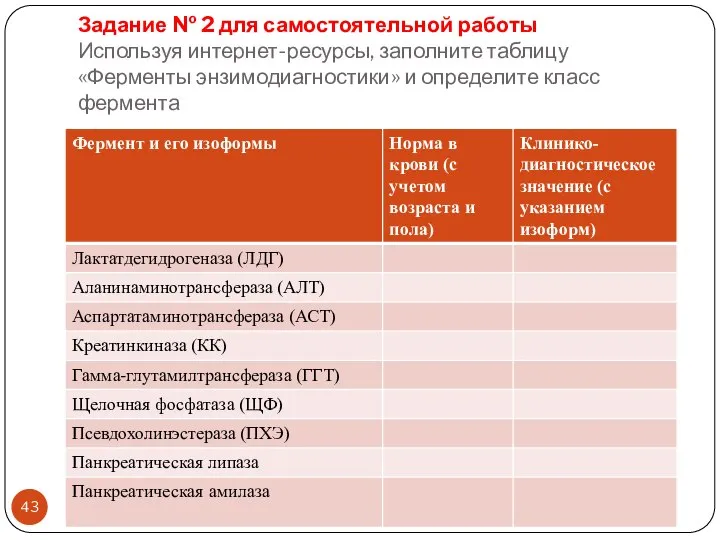
- 43. Задание № 2 для самостоятельной работы Используя интернет-ресурсы, заполните таблицу «Ферменты энзимодиагностики» и определите класс фермента
- 44. ВОПРОСЫ ДЛЯ РАЗМЫШЛЕНИЯ Почему активность аминотрансфераз у детей раннего возраста выше, чем у взрослых? Почему активность
- 45. Заключение Ферменты используются в диагностике заболеваний как специфические реагенты Препараты ферментов используются в заместительной и комплексной
- 47. Скачать презентацию



































 Рабочий чертеж
Рабочий чертеж Метод противодействия несанкционированному доступу к информации, обрабатываемой ЭВМ
Метод противодействия несанкционированному доступу к информации, обрабатываемой ЭВМ Фандрайзинг и мобилизация ресурсов Курс повышения квалификации Москва, 03 – 24 июня 2010
Фандрайзинг и мобилизация ресурсов Курс повышения квалификации Москва, 03 – 24 июня 2010 Провести профориентационную работу среди учащихся
Провести профориентационную работу среди учащихся Администрация Константиновского городского поселения Исполнение бюджета Константиновского городского поселения Константинов
Администрация Константиновского городского поселения Исполнение бюджета Константиновского городского поселения Константинов Порядок надання адміністративних послуг, насамперед базових, і параметри якості послуг
Порядок надання адміністративних послуг, насамперед базових, і параметри якості послуг Расчет аккумулирующей способности последнего участка газопровода
Расчет аккумулирующей способности последнего участка газопровода Цветы - светильники на заказ
Цветы - светильники на заказ Как делать покупки женщинам
Как делать покупки женщинам Синусоидалы токтың тізбектеріндегі энергетикалық процестер. Толық қуат. Ваттметр
Синусоидалы токтың тізбектеріндегі энергетикалық процестер. Толық қуат. Ваттметр Презентация "Павел Петрович Бажов" - скачать презентации по МХК
Презентация "Павел Петрович Бажов" - скачать презентации по МХК Сущность и задачи статистического анализа данных правовой статистики
Сущность и задачи статистического анализа данных правовой статистики Презентация на тему: «Принципы ухода при поражении органов равновесия»
Презентация на тему: «Принципы ухода при поражении органов равновесия»  Изменение пошлин с учетом вступления в ВТО
Изменение пошлин с учетом вступления в ВТО Леся Українка - геніальна донька українського народу
Леся Українка - геніальна донька українського народу Патентоведение / защита интеллектуальной собственности
Патентоведение / защита интеллектуальной собственности Сущность и социальная роль конфликта
Сущность и социальная роль конфликта Семинар по подготовке судей по гребному слалому 3 категории
Семинар по подготовке судей по гребному слалому 3 категории Продольный разрез паровой турбины Т-250/300-240
Продольный разрез паровой турбины Т-250/300-240 Обработка прерываний
Обработка прерываний Презентация на тему "2-A klasss" - скачать презентации по Педагогике
Презентация на тему "2-A klasss" - скачать презентации по Педагогике Язык программирования Pascal. Ветвление
Язык программирования Pascal. Ветвление Виды моделей
Виды моделей Система согласных
Система согласных Оператор ветвления (условный оператор)
Оператор ветвления (условный оператор) Волейбол сидячий
Волейбол сидячий Государство и его функции (обществознание)
Государство и его функции (обществознание) Непрерывные случайные величины: законы распределения, числовые характеристики
Непрерывные случайные величины: законы распределения, числовые характеристики