Содержание
- 2. Энергетические изменения при химических реакциях
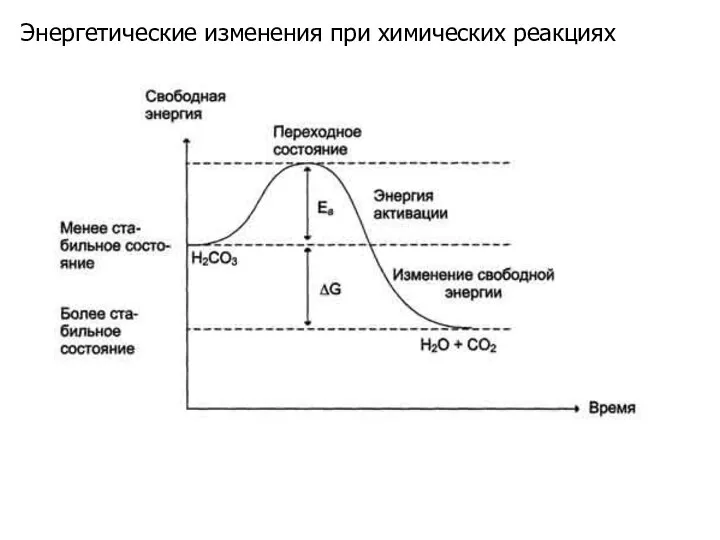
- 3. Скорость любой химической реакции определяется энергетическим барьером, который необходимо преодолеть реагирующим молекулам. По Аррениусу, химическая реакция
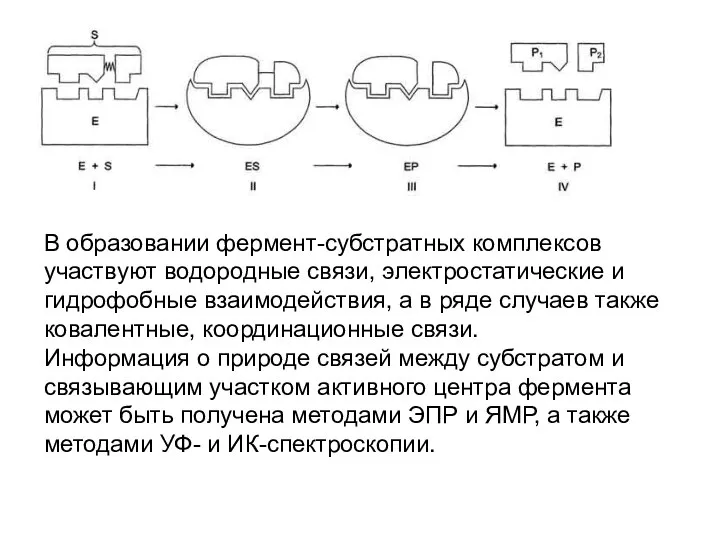
- 5. В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также
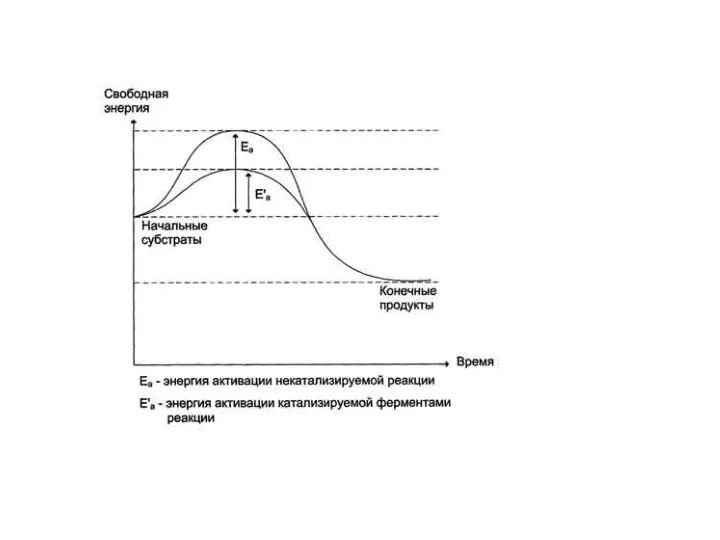
- 6. Как катализируемая ферментом, так и не катализируемая им реакция независимо от ее пути имеет одинаковую величину
- 7. В 1894 г. немецкий химик Эмиль Герман Фишер «теория замка и ключа». Между ферментом и субстратам
- 8. Схема, предложенная Фишером, живёт уже более ста лет и не стареет. Но, к сожалению, она объясняет
- 9. В 1925 г. шведский биохимик Ханс Карл Август Симон фон Эйлер выдвинул теорию деформации субстрата, названную
- 10. Для того чтобы связь возникла, субстраты прежде всего должны оказаться рядом, причём в заданном положении друг
- 11. Молекулярные механизмы ферментативного катализа
- 12. Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в
- 13. 1. Кислотно-основной катализ Концепция кислотно-основного катализа объясняет ферментативную активность участием в химической реакции кислотных групп (доноры
- 14. К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят цистеин, тирозин, серин, лизин, глутаминовая кислота,
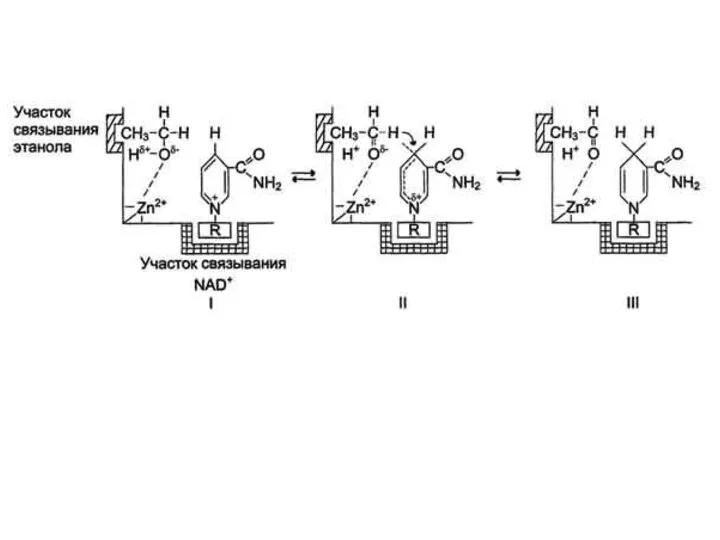
- 15. Примером кислотно-основного катализа, в котором кофакторами являются ионы Zn2+, а в качестве кофермента используется молекула NAD+,
- 17. 2. Ковалентный катализ Ковалентный катализ основан на атаке нуклеофильных (отрицательно заряженных) или электрофильных (положительно заряженных) групп
- 18. Действие сериновых протеаз, таких как трипсин, химотрипсин и тромбин, - пример механизма ковалентного катализа, когда ковалентная
- 19. Рассмотрим механизм ковалентного катализа на примере химотрипсина, осуществляющего гидролиз пептидных связей при переваривании белков в двенадцатиперстной
- 21. Скачать презентацию














 Dzieci uczą się tego, w czym i z czym żyją
Dzieci uczą się tego, w czym i z czym żyją Реформы П.А. Столыпина
Реформы П.А. Столыпина Пример поддержки проектной деятельности
Пример поддержки проектной деятельности Indo-european family of languages
Indo-european family of languages ИММУНО-БИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ
ИММУНО-БИОЛОГИЧЕСКИЕ ПРЕПАРАТЫ  Основы продаж Hoff - товары для дома. Тренинг
Основы продаж Hoff - товары для дома. Тренинг Севастопольская городская молодежная организация
Севастопольская городская молодежная организация Портрет инопланетянина. Викторина
Портрет инопланетянина. Викторина Einkaufen
Einkaufen Кинематика
Кинематика Владимир Высоцкий. Интересные факты из его жизни
Владимир Высоцкий. Интересные факты из его жизни ФУНКЦИИ ПРАВА
ФУНКЦИИ ПРАВА Respect Party
Respect Party Из кожи, глины и бумаги
Из кожи, глины и бумаги Інтернет-ефективність
Інтернет-ефективність Кошка гулявшая сама по себе - презентация для начальной школы
Кошка гулявшая сама по себе - презентация для начальной школы Саморегулируемая межрегиональная ассоциация специалистов-оценщиков СРО НП
Саморегулируемая межрегиональная ассоциация специалистов-оценщиков СРО НП «НЕ МАХАЙ НА ВСЕ РУКОЮ, НЕ ЛІНУЙСЯ , А УЧИСЬ, БО ЧОГО НАВЧАТЬ В ЛІЦЕЇ, ЗНАДОБИТЬСЯ ЩЕ КОЛИСЬ!»
«НЕ МАХАЙ НА ВСЕ РУКОЮ, НЕ ЛІНУЙСЯ , А УЧИСЬ, БО ЧОГО НАВЧАТЬ В ЛІЦЕЇ, ЗНАДОБИТЬСЯ ЩЕ КОЛИСЬ!» Презентация Граждане (физические лица) как субъекты гражданского права Учебные вопросы: Гражданин как индивидуальный субъект гр
Презентация Граждане (физические лица) как субъекты гражданского права Учебные вопросы: Гражданин как индивидуальный субъект гр matematicheskiy_breyn_2019
matematicheskiy_breyn_2019 Презентация "Ценообразование на предприятии" - скачать презентации по Экономике
Презентация "Ценообразование на предприятии" - скачать презентации по Экономике Сортировка строкового массива на Delphi
Сортировка строкового массива на Delphi Презентация РЕЧЬ ОРАТОРА В СУДЕ!!!
Презентация РЕЧЬ ОРАТОРА В СУДЕ!!! Поляризация света при отражении (закон Брюстера)
Поляризация света при отражении (закон Брюстера) Економіка україни в умовах ринкової трансформації
Економіка україни в умовах ринкової трансформації  Как построить компанию мирового уровня
Как построить компанию мирового уровня Власть как политический институт
Власть как политический институт ТЕМА 2 ШКОЛА НАУЧНОГО УПРАВЛЕНИЯ
ТЕМА 2 ШКОЛА НАУЧНОГО УПРАВЛЕНИЯ