Содержание
- 2. Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы
- 3. Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени:
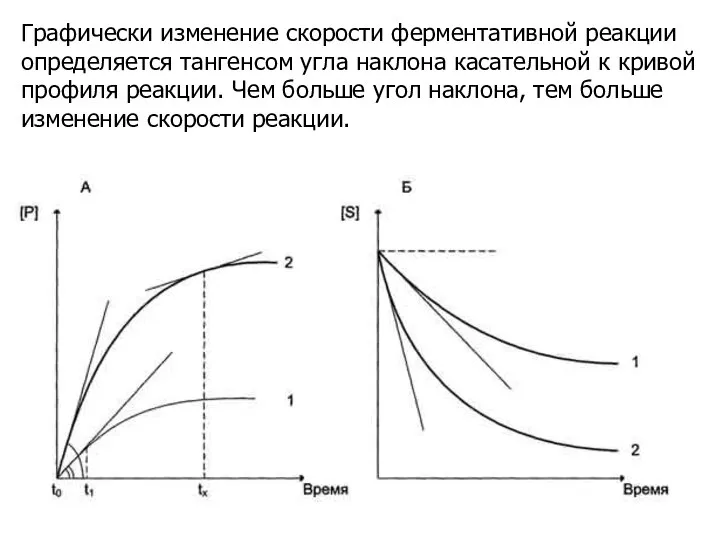
- 4. Графически изменение скорости ферментативной реакции определяется тангенсом угла наклона касательной к кривой профиля реакции. Чем больше
- 5. Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура
- 6. Зависимость скорости ферментативной реакции от количества ферментов При проведении ферментативной реакции в условиях избытка субстрата скорость
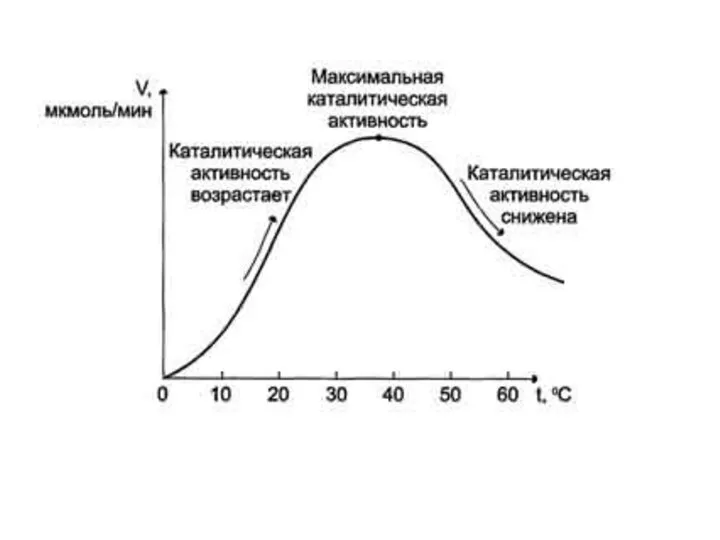
- 7. Зависимость скорости ферментативной реакции от температуры среды Повышение температуры до определённых пределов оказывает влияние на скорость
- 8. Правило Вант-Гоффа Уравнение Аррениуса: k = Ae-Ea/RT, где k – константа скорости реакции; Ea – энергия
- 10. Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например,
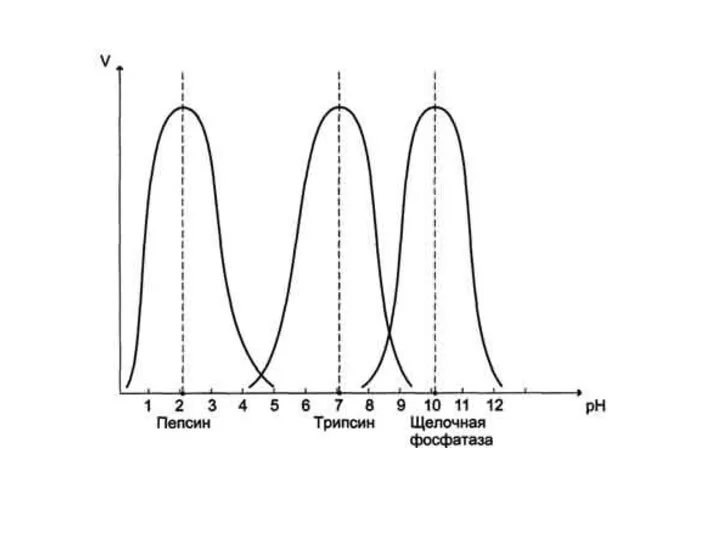
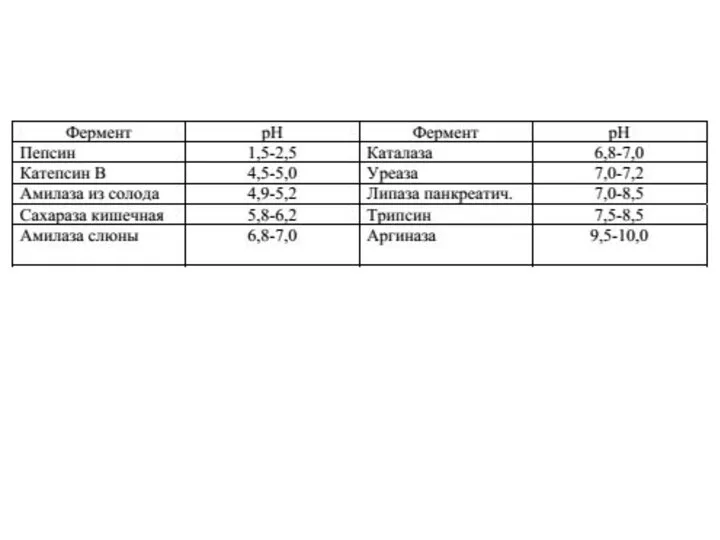
- 11. Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает
- 12. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную
- 13. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет
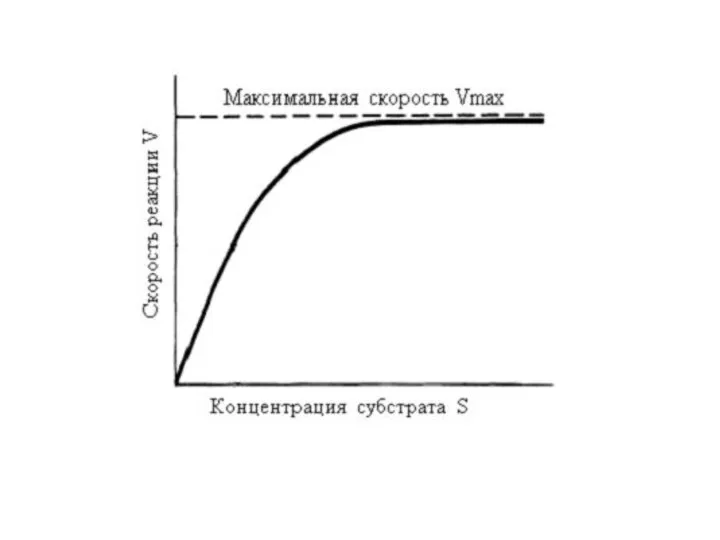
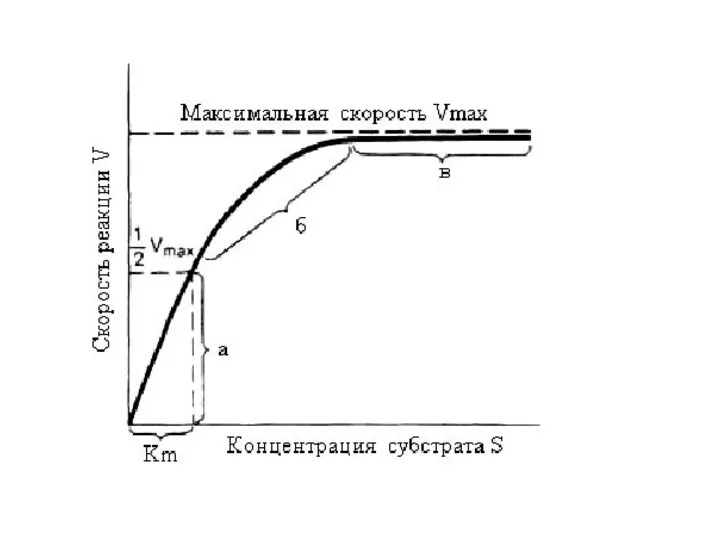
- 16. Зависимость скорости ферментативной реакции от количества субстрата Одним из наиболее существенных факторов, определяющих скорость ферментативной реакции,
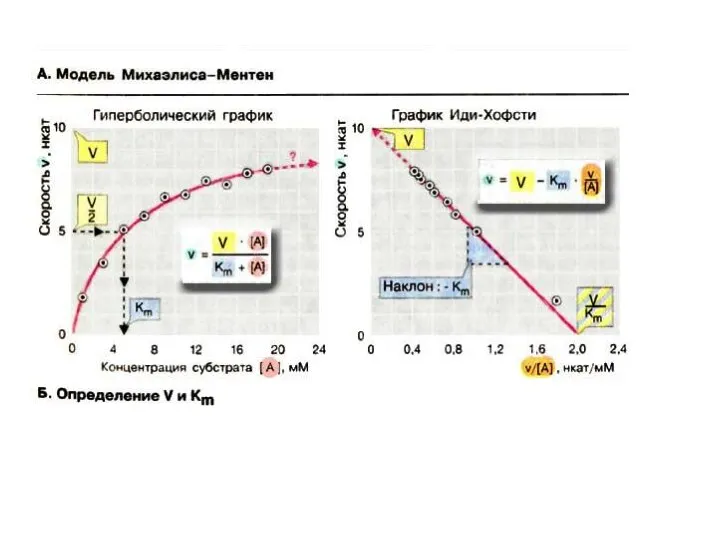
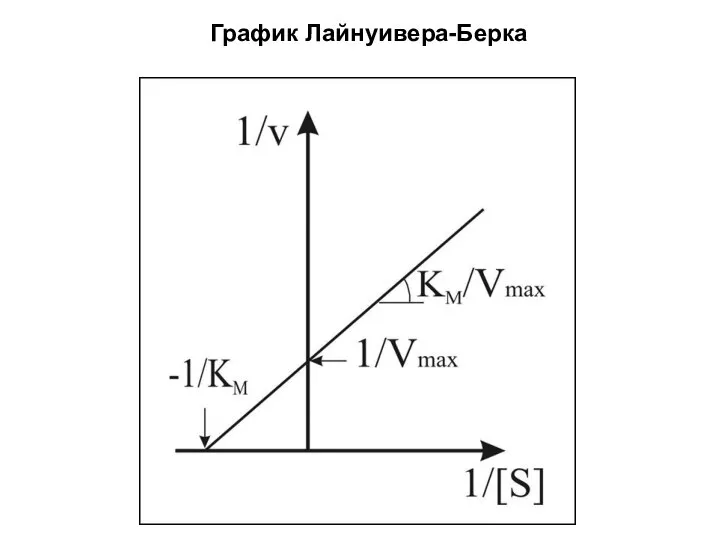
- 22. График Лайнуивера-Берка
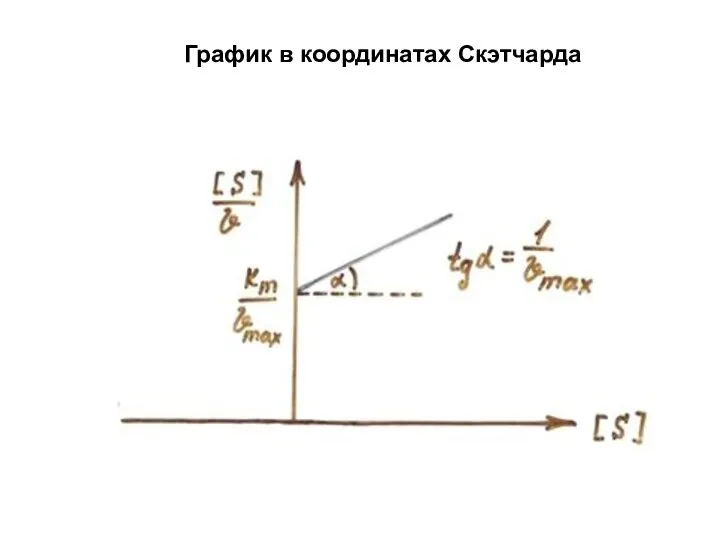
- 23. График в координатах Скэтчарда
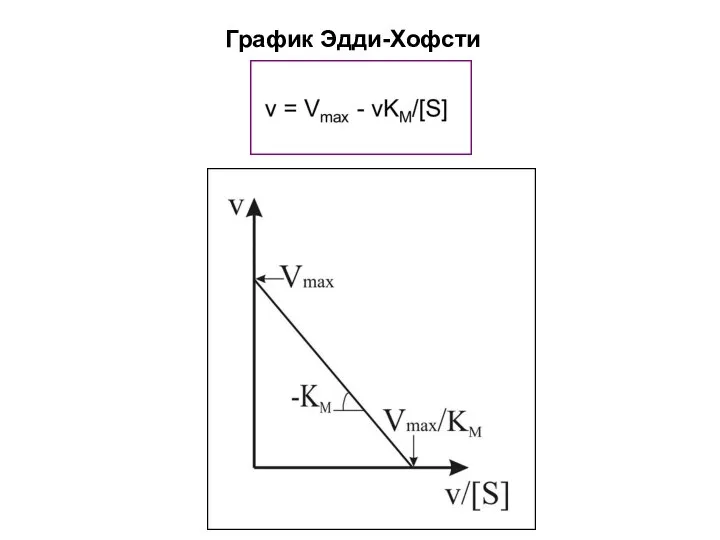
- 24. График Эдди-Хофсти
- 26. Скачать презентацию












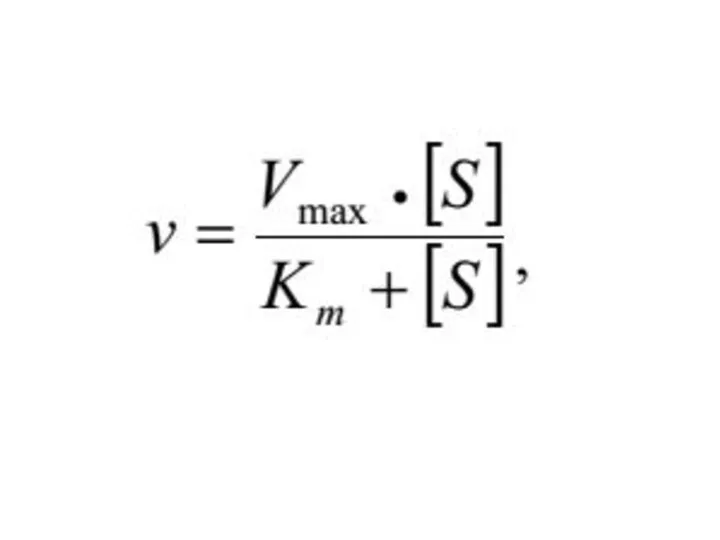
 Провідникові матеріали. Класифікація провідникових матеріалів
Провідникові матеріали. Класифікація провідникових матеріалів Иновационные методы проектирования и производства корпусной мебели, как один из видов социокультурной практики
Иновационные методы проектирования и производства корпусной мебели, как один из видов социокультурной практики Цивилизация Древнего Междуречья и древнего Египта
Цивилизация Древнего Междуречья и древнего Египта Биохимический метод изучения генетики человека
Биохимический метод изучения генетики человека Конструкторская документация. Стандарты оформления чертежей.
Конструкторская документация. Стандарты оформления чертежей. Теоретические основы и организационные принципы медицинского страхования в Российской Федерации
Теоретические основы и организационные принципы медицинского страхования в Российской Федерации 1. Роль государства в экономика 2. Инфляция 3. Безработица
1. Роль государства в экономика 2. Инфляция 3. Безработица Инженерная графика. Общие правила оформления чертежей
Инженерная графика. Общие правила оформления чертежей Современные подходы в спортивной деятельности – психологический аспект
Современные подходы в спортивной деятельности – психологический аспект Across Time and Distance…
Across Time and Distance… Производство кваса и безалк.напитков
Производство кваса и безалк.напитков Самостоятельная работа по программированию
Самостоятельная работа по программированию Камалян А.К., д.э.н., профессор, зав. кафедрой налогов и права ВГАУ
Камалян А.К., д.э.н., профессор, зав. кафедрой налогов и права ВГАУ  Договор комиссии Подготовила: студентка 4 курса Омельченко Марина
Договор комиссии Подготовила: студентка 4 курса Омельченко Марина Дезинфекция, ПСО и стерилизация медицинских инструментов.
Дезинфекция, ПСО и стерилизация медицинских инструментов. Святой Георгий- Победоносец в битве со змием
Святой Георгий- Победоносец в битве со змием Работа с внешними устройствами Linux
Работа с внешними устройствами Linux Художественная культура XIX столетия
Художественная культура XIX столетия Коньки (для дошкольников)
Коньки (для дошкольников)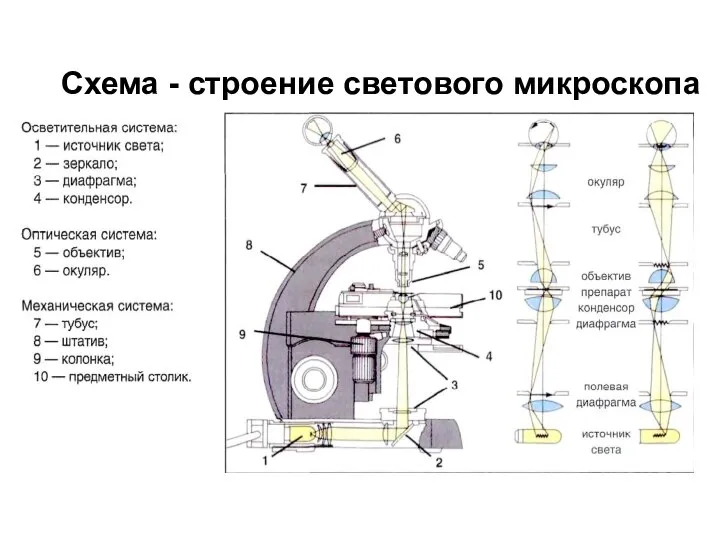 Схема - строение светового микроскопа
Схема - строение светового микроскопа Типичные ошибки кадастровых инженеров при подготовке технических планов
Типичные ошибки кадастровых инженеров при подготовке технических планов Вредные вещества в косметике Подготовили: студентки 1-ого курса ФТД группы Т-116с Цьопа Даша и Федина Юля
Вредные вещества в косметике Подготовили: студентки 1-ого курса ФТД группы Т-116с Цьопа Даша и Федина Юля ЛИДЕРСТВО В 21 ВЕКЕ ЛИДЕРСТВО В 21 ВЕКЕ LEADERSHIP MANAGEMENT UKRAINE Development & coaching
ЛИДЕРСТВО В 21 ВЕКЕ ЛИДЕРСТВО В 21 ВЕКЕ LEADERSHIP MANAGEMENT UKRAINE Development & coaching Отсечение невидимых частей объектов(Clipping)
Отсечение невидимых частей объектов(Clipping) Организация предупредительного и текущего санитарного надзора в области ХПВ
Организация предупредительного и текущего санитарного надзора в области ХПВ Технологический процесс смесеприготовления
Технологический процесс смесеприготовления Степ аэробика. Фитнес-студия "Body Balance"
Степ аэробика. Фитнес-студия "Body Balance" Схема помещений второго этажа (оборудование ЦОУ)
Схема помещений второго этажа (оборудование ЦОУ)