Содержание
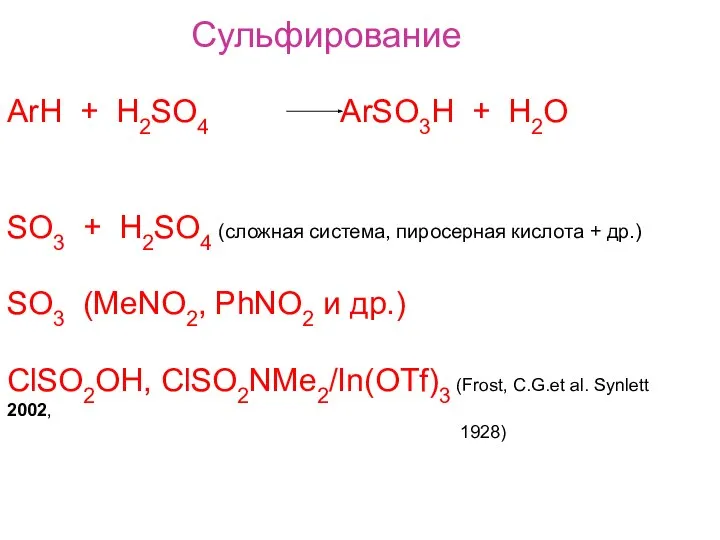
- 2. Сульфирование ArH + H2SO4 ArSO3H + H2O SO3 + H2SO4 (сложная система, пиросерная кислота + др.)
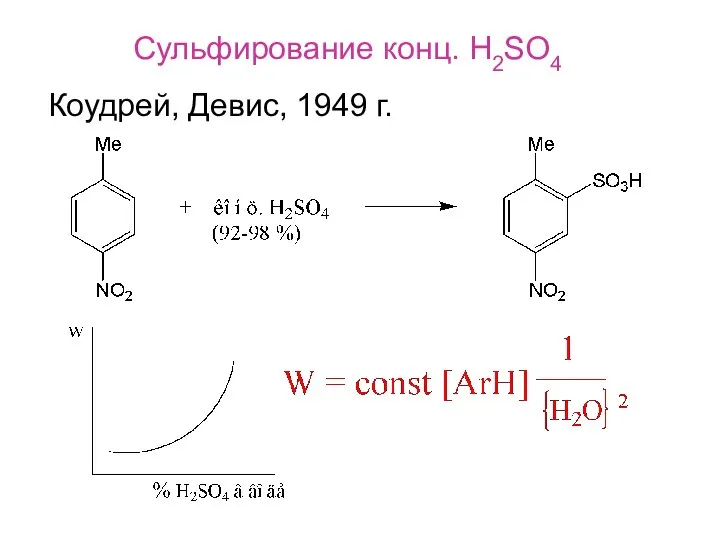
- 3. Сульфирование конц. H2SO4 Коудрей, Девис, 1949 г.
- 4. 2H2SO4 H3SO4+ + HSO4- [H3SO4+] = 2H2SO4 SO3 + H2O + HSO4- [SO3] = 3H2SO4 HSO3+
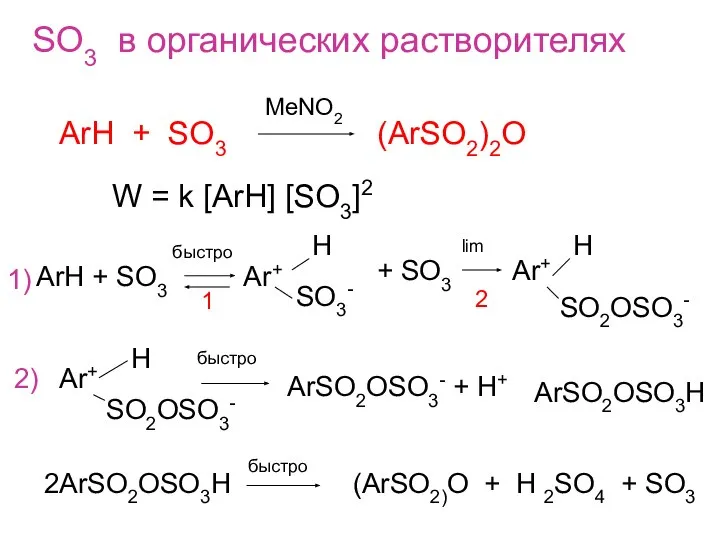
- 5. SO3 в органических растворителях ArH + SO3 (ArSO2)2O MeNO2 W = k [ArH] [SO3]2 ArH +
- 6. Кинетические изотопные эффекты п-СlC6H4D п-ClC6H4SO3H 97% H2SO4 kH / kD = 3.2 Реакция сульфирования обратима !
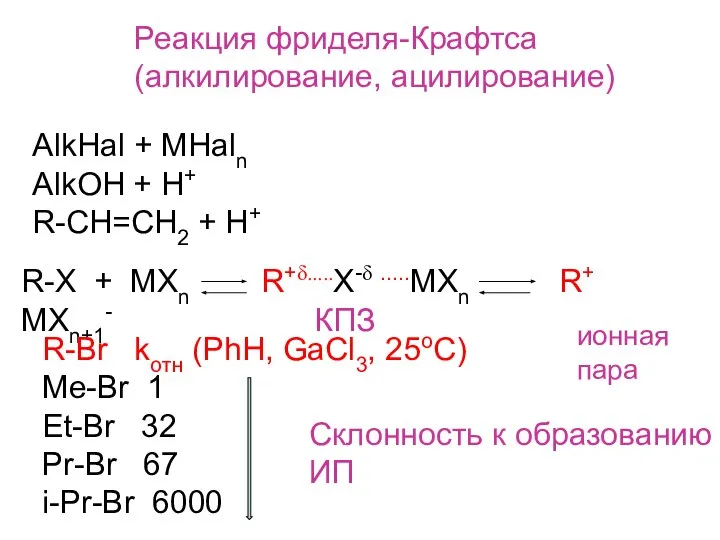
- 7. Реакция фриделя-Крафтса (алкилирование, ацилирование) AlkHal + MHaln AlkOH + H+ R-CH=CH2 + H+ R-X + MXn
- 8. Природа MX4 + С*H3CD2F BF3 CD2C*H3 + С*H3CH2F - [HOBF3-] C*H2C*H3 50% ПГ ! Нет ПГ
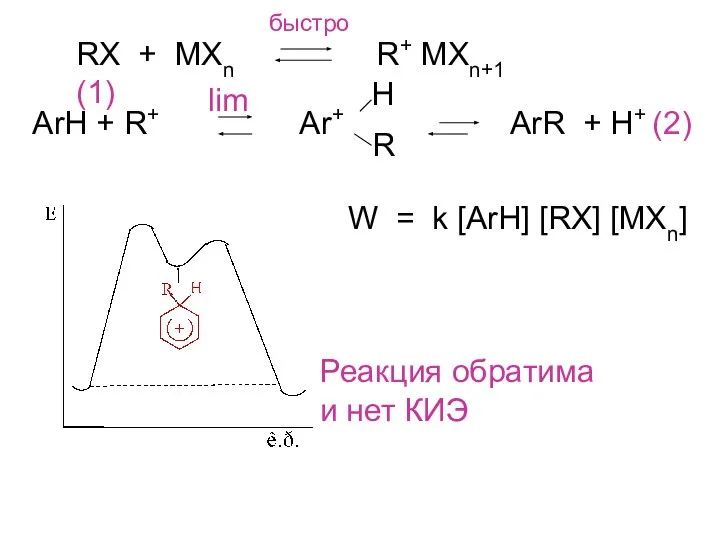
- 9. RX + MXn R+ MXn+1 (1) быстро ArH + R+ Ar+ ArR + H+ (2) H
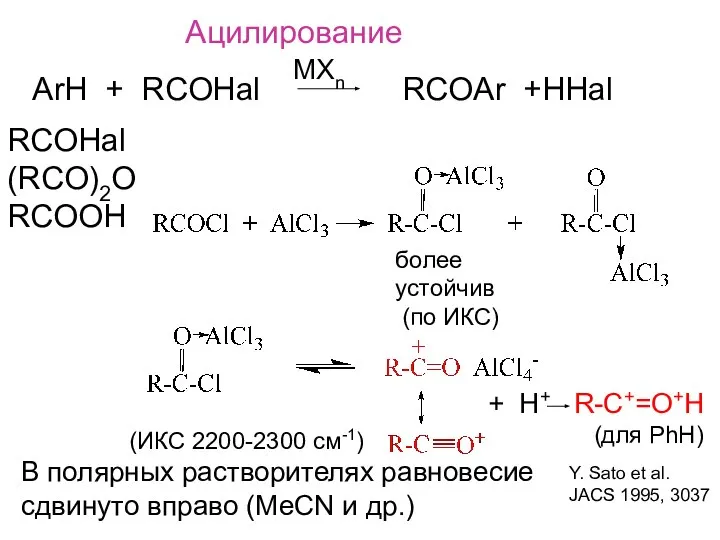
- 10. Ацилирование ArH + RCOHal RCOAr +HHal MXn RCOHal (RCO)2O RCOOH более устойчив (по ИКС) В полярных
- 11. A B B 1) Обычно: W = k[ArH] [RCOX] [MXn] 2) MeCOF, MeCOCl, MeCOBr реагируют с
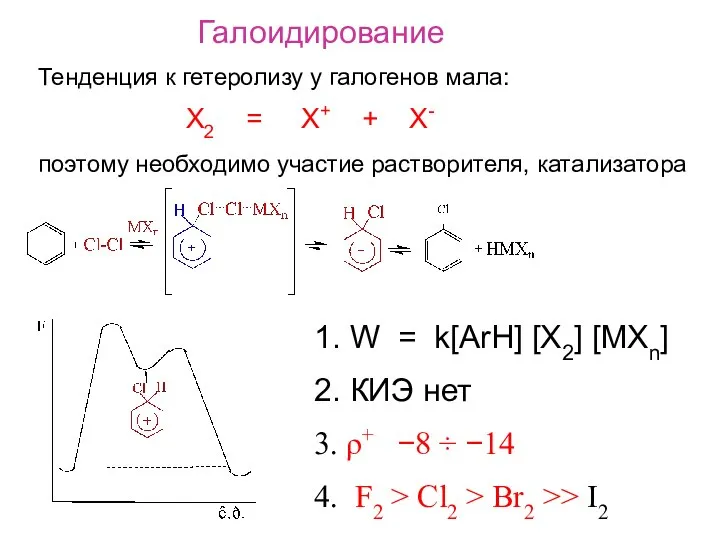
- 12. Галоидирование Тенденция к гетеролизу у галогенов мала: X2 = X+ + X- поэтому необходимо участие растворителя,
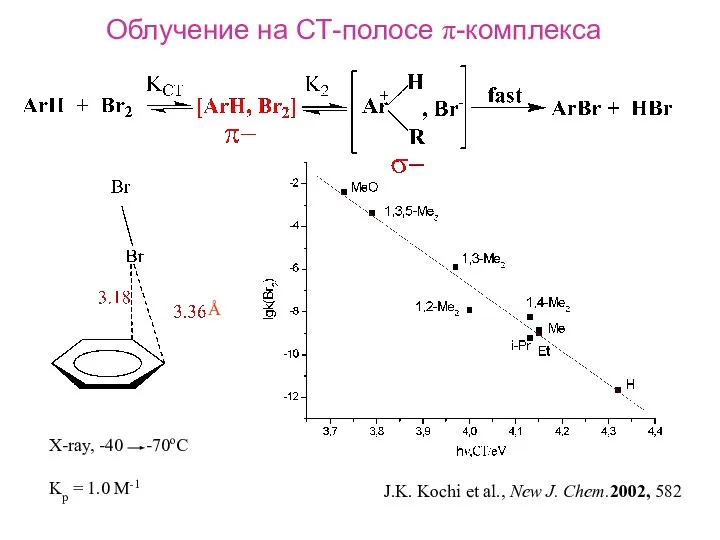
- 13. J.K. Kochi et al., New J. Chem.2002, 582 Å X-ray, -40 -70oC Kp = 1.0 M-1
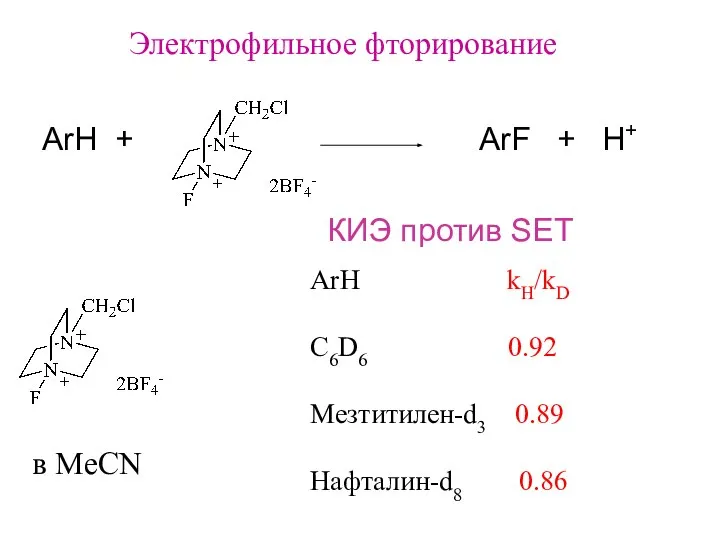
- 14. Электрофильное фторирование ArH kH/kD C6D6 0.92 Мезтитилен-d3 0.89 Нафталин-d8 0.86 в MeCN ArH + ArF +
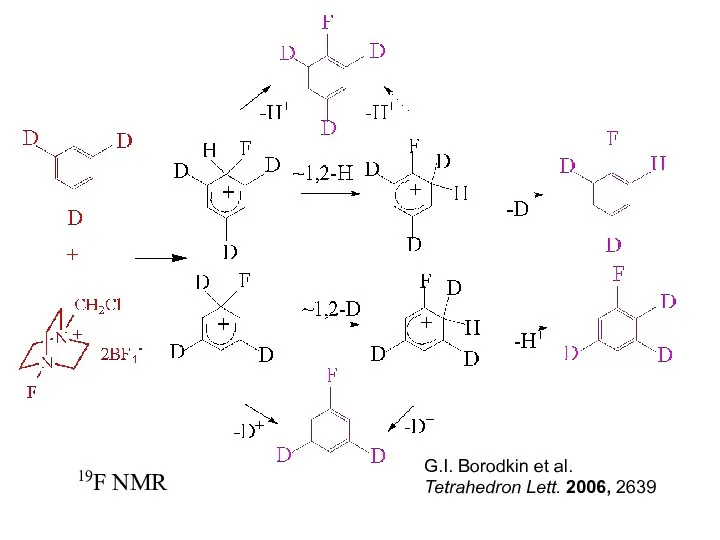
- 15. G.I. Borodkin et al. Tetrahedron Lett. 2006, 2639 19F NMR
- 16. Влияние природы заместителей PhH + X+ PhX + H+ PhY + X+ YC6H4X + H+ kPhH
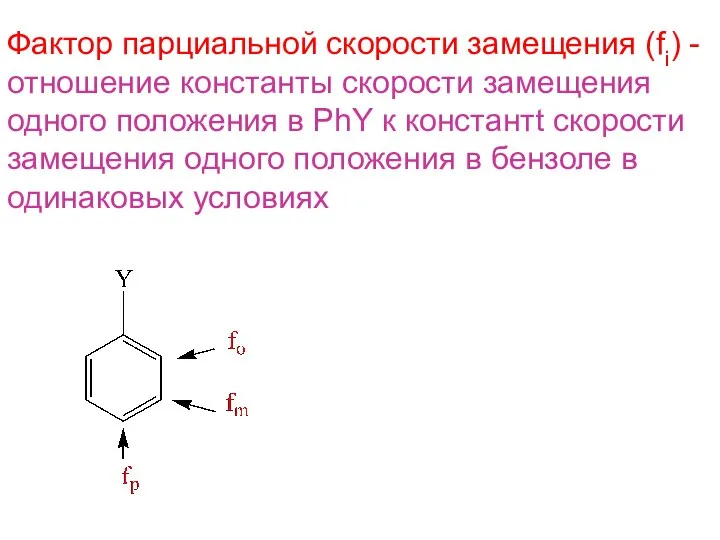
- 17. Фактор парциальной скорости замещения (fi) - отношение константы скорости замещения одного положения в PhY к константt
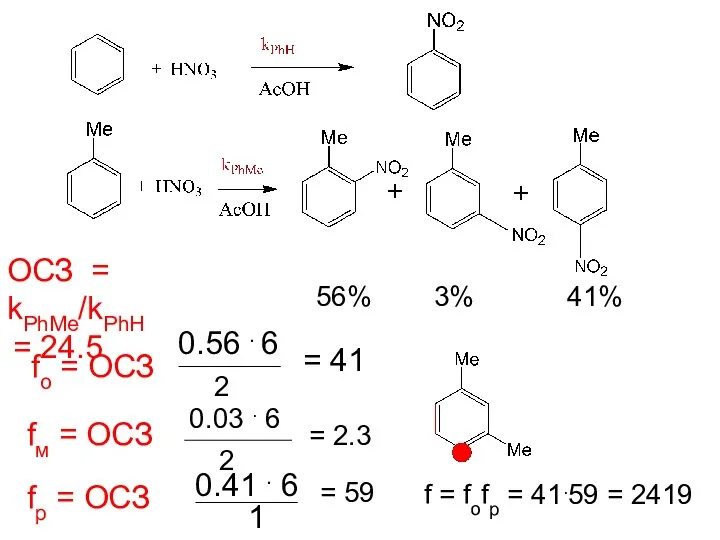
- 18. 56% 3% 41% ОСЗ = kPhMe/kPhH = 24.5 fo = ОСЗ 0.56 . 6 2 =
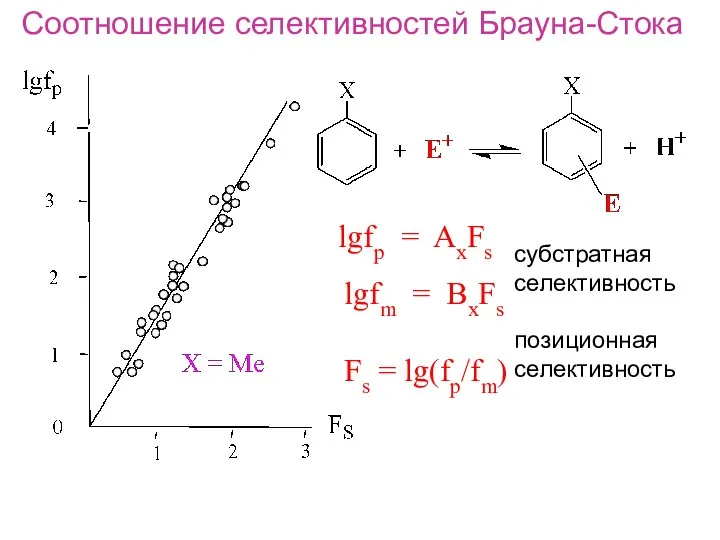
- 19. Соотношение селективностей Брауна-Стока lgfp = AxFs lgfm = BxFs Fs = lg(fp/fm) субстратная селективность позиционная селективность
- 20. Соотношение селективностей Брауна-Стока и уравнение Гаммета fp = kp-X/kH fm = km-X/kH lgfp = σp+ρ lgfm
- 22. Скачать презентацию
![2H2SO4 H3SO4+ + HSO4- [H3SO4+] = 2H2SO4 SO3 + H2O +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304042/slide-3.jpg)

![Природа MX4 + С*H3CD2F BF3 CD2C*H3 + С*H3CH2F - [HOBF3-] C*H2C*H3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304042/slide-7.jpg)
![A B B 1) Обычно: W = k[ArH] [RCOX] [MXn] 2)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304042/slide-10.jpg)


 Модульная технология возведения высотных каркасных зданий из стальных элементов
Модульная технология возведения высотных каркасных зданий из стальных элементов Накшатры Водолея и Рыб
Накшатры Водолея и Рыб История донорства и переливаний крови
История донорства и переливаний крови  Презентация "Иван Константинович Айвазовский (1817-1900)" - скачать презентации по МХК
Презентация "Иван Константинович Айвазовский (1817-1900)" - скачать презентации по МХК Настоящие рекомендации являются временными и действуют до выхода Примерных основных общеобразовательных программ дошкольного о
Настоящие рекомендации являются временными и действуют до выхода Примерных основных общеобразовательных программ дошкольного о Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение)
Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение) Решение тригонометрических уравнений
Решение тригонометрических уравнений  Атрибуты иудаизма
Атрибуты иудаизма Положение о государственной (итоговой)аттестации выпускников 9 классов общеобразовательных учреждений РФ
Положение о государственной (итоговой)аттестации выпускников 9 классов общеобразовательных учреждений РФ  Лингвистический релятивизм
Лингвистический релятивизм Школа правозащитников
Школа правозащитников Презент_№2_Подход_информ
Презент_№2_Подход_информ Основные понятия ООП
Основные понятия ООП Изучение английского онлайн Уроки по Skype
Изучение английского онлайн Уроки по Skype Левый поворот в Перу
Левый поворот в Перу Основные режимы нераспространения оружия массового поражения
Основные режимы нераспространения оружия массового поражения Льготное кредитование для ряда отраслей сельского хозяйства Презентацию подготовил Кузнецов Павел
Льготное кредитование для ряда отраслей сельского хозяйства Презентацию подготовил Кузнецов Павел Mumbai terrorist attack
Mumbai terrorist attack Предикативность vs. Предикация
Предикативность vs. Предикация Презентация Подведение итогов за май 2016
Презентация Подведение итогов за май 2016 Правовой статус человека и гражданина. Соотношение прав, свобод и обязанностей человека и гражданина. Тема 2
Правовой статус человека и гражданина. Соотношение прав, свобод и обязанностей человека и гражданина. Тема 2 Системы связи и сети передачи информации Виды модуляции сигналов. Детектирование
Системы связи и сети передачи информации Виды модуляции сигналов. Детектирование Информационные и автоматизированные информационные системы и их специфика в таможенной сфере
Информационные и автоматизированные информационные системы и их специфика в таможенной сфере Первичное и вторичное вскрытие продуктивных пластов
Первичное и вторичное вскрытие продуктивных пластов python (2)
python (2) Деревянная посуда
Деревянная посуда In der Stadt. Akkusativ. Dativ
In der Stadt. Akkusativ. Dativ Примеры применения производной - презентация по Алгебре
Примеры применения производной - презентация по Алгебре