Содержание
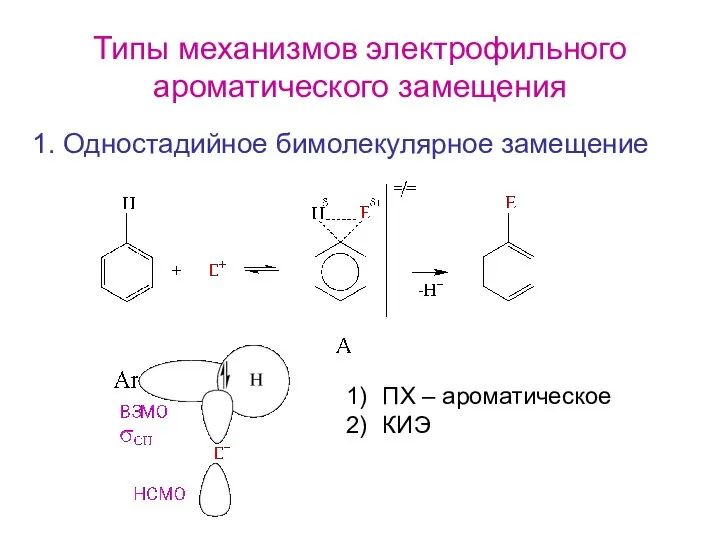
- 2. Типы механизмов электрофильного ароматического замещения 1. Одностадийное бимолекулярное замещение ПХ – ароматическое КИЭ
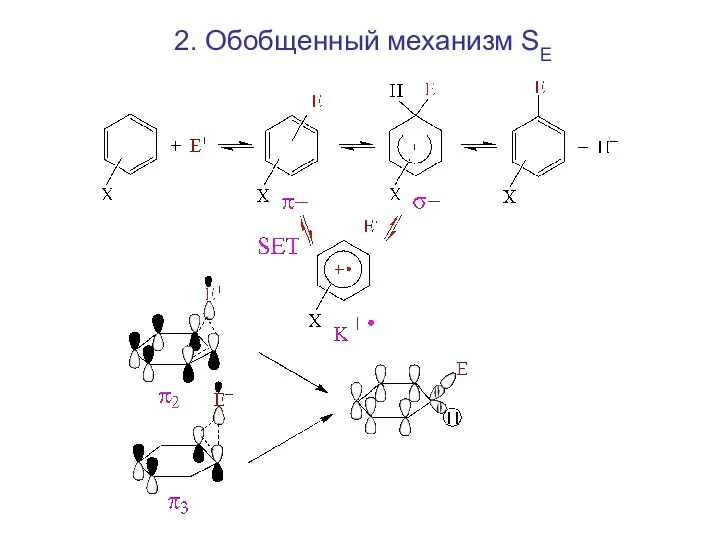
- 3. 2. Обобщенный механизм SE
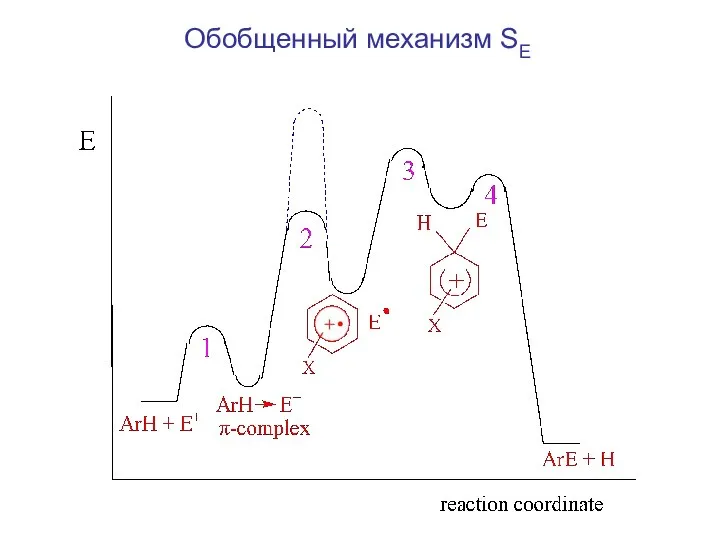
- 4. Обобщенный механизм SE
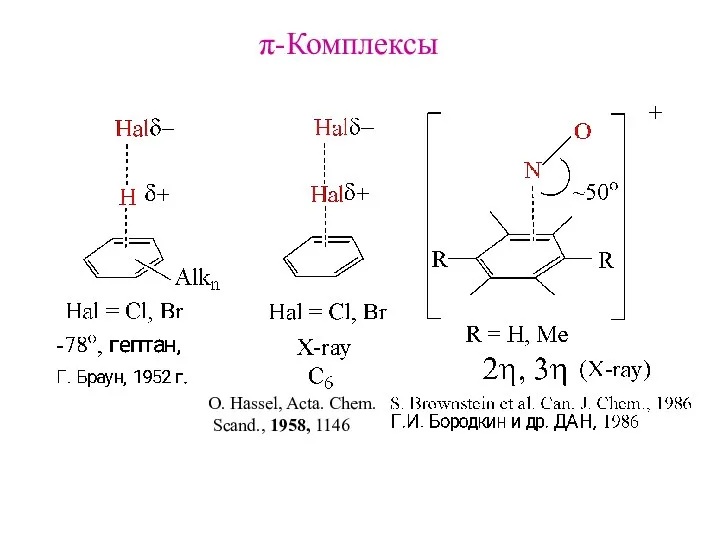
- 5. π-Комплексы O. Hassel, Acta. Chem. Scand., 1958, 1146
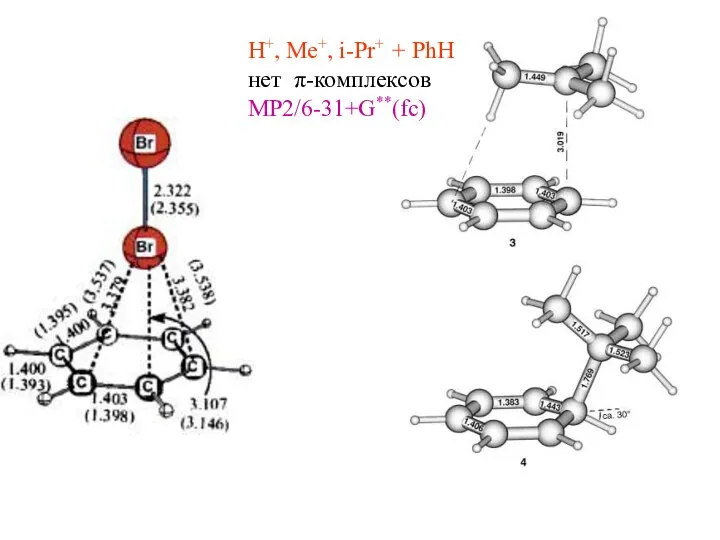
- 6. H+, Me+, i-Pr+ + PhH нет π-комплексов MP2/6-31+G**(fc)
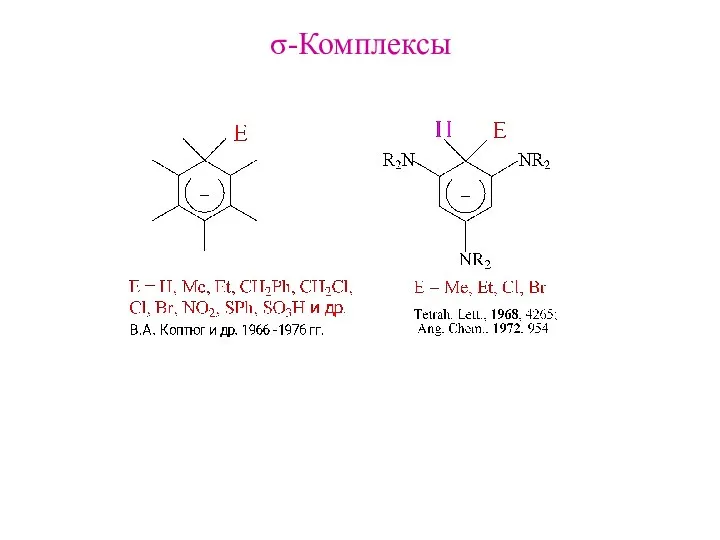
- 7. σ-Комплексы
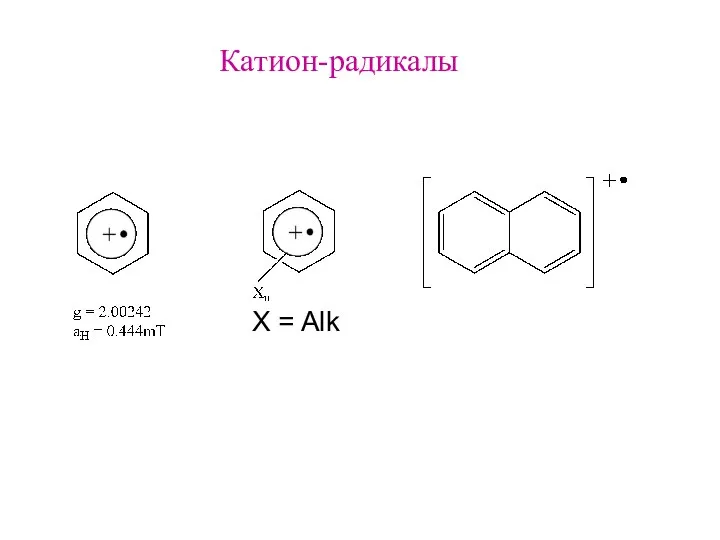
- 8. Катион-радикалы X = Alk
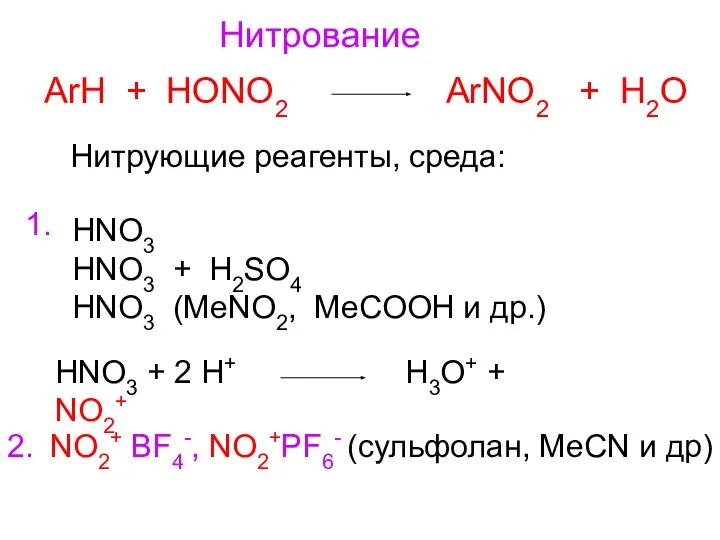
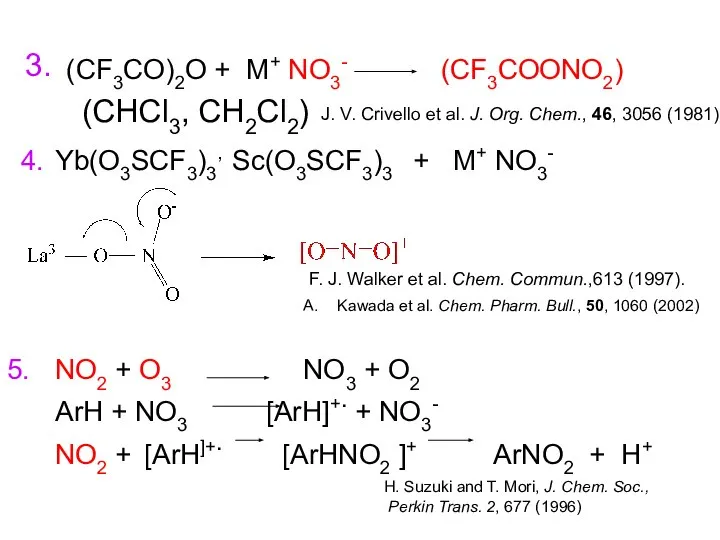
- 9. Нитрование ArH + HONO2 ArNO2 + H2O HNO3 HNO3 + H2SO4 HNO3 (MeNO2, MeCOOH и др.)
- 10. Kawada et al. Chem. Pharm. Bull., 50, 1060 (2002) (CF3CO)2O + M+ NO3- 4. H. Suzuki
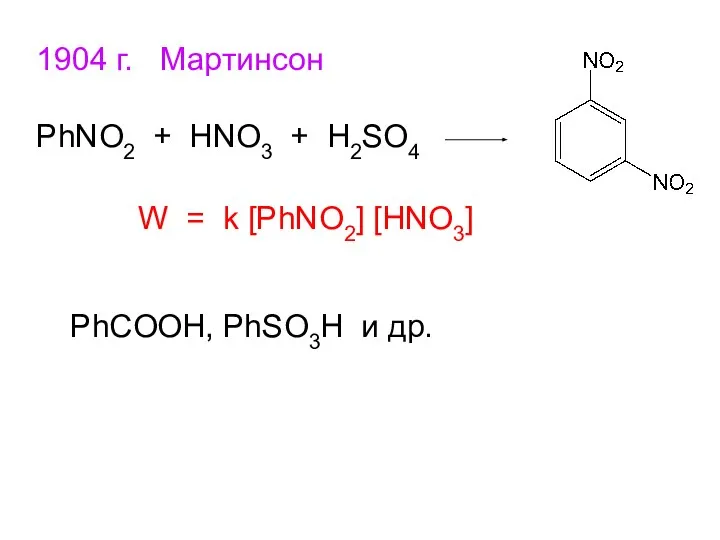
- 11. 1904 г. Мартинсон PhNO2 + HNO3 + H2SO4 W = k [PhNO2] [HNO3] PhCOOH, PhSO3H и
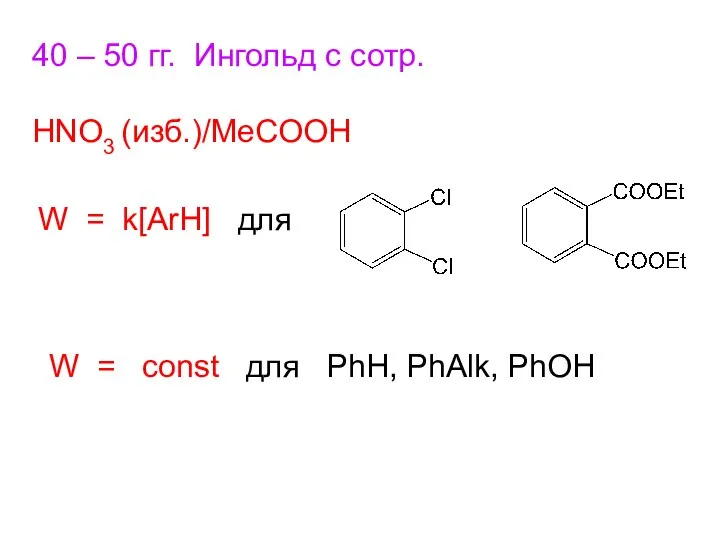
- 12. 40 – 50 гг. Ингольд с сотр. HNO3 (изб.)/MeCOOH W = k[ArH] для W = const
- 13. HNO3 X истинный нитрующий агент ArH + X ArNO2 [X] = Kp [HNO3] a b c
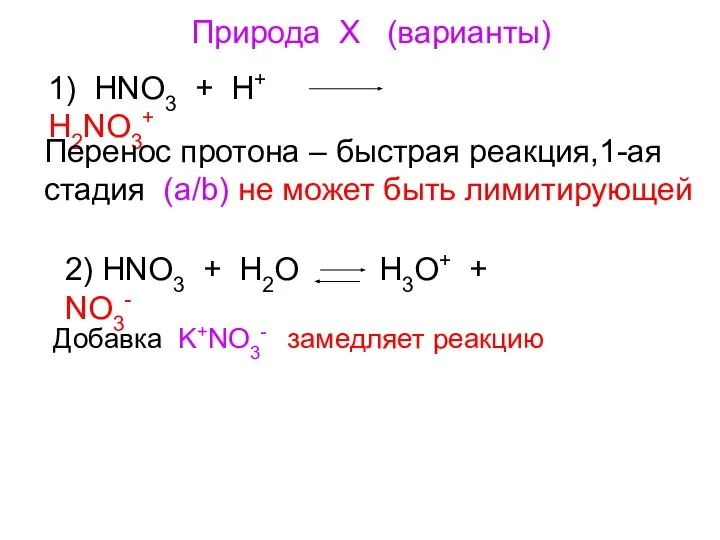
- 14. Природа Х (варианты) 1) HNO3 + H+ H2NO3+ Перенос протона – быстрая реакция,1-ая стадия (a/b) не
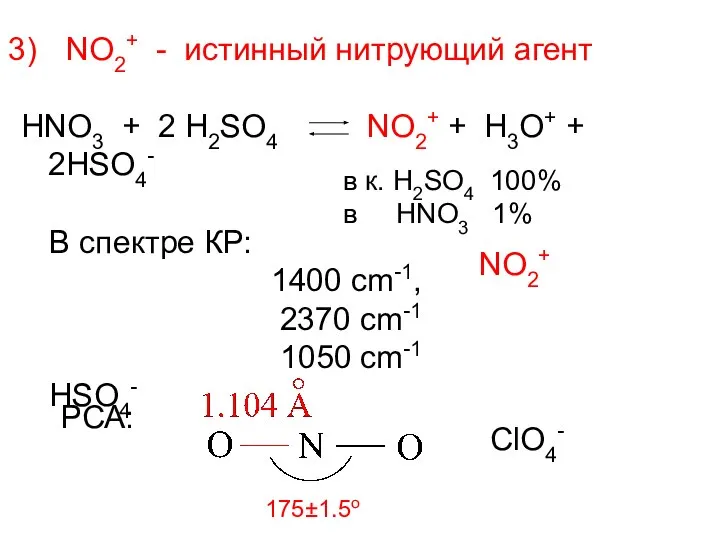
- 15. NO2+ - истинный нитрующий агент HNO3 + 2 H2SO4 NO2+ + H3O+ + 2HSO4- В спектре
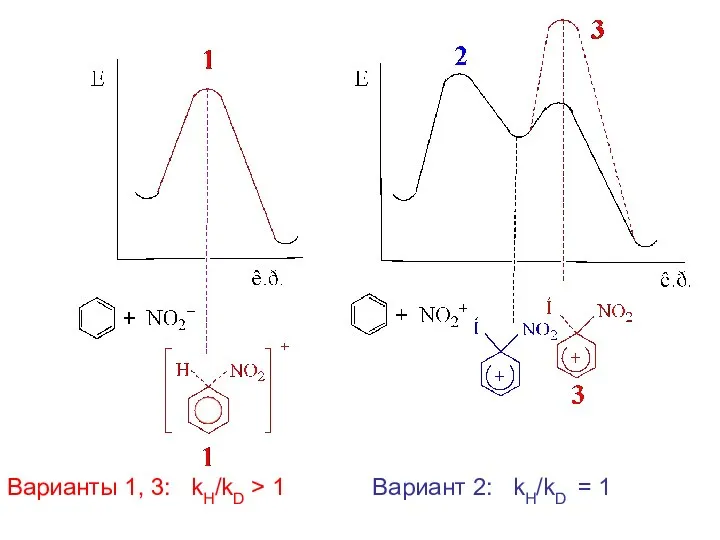
- 16. kH/kD > 1 Варианты 1, 3: Вариант 2: kH/kD = 1
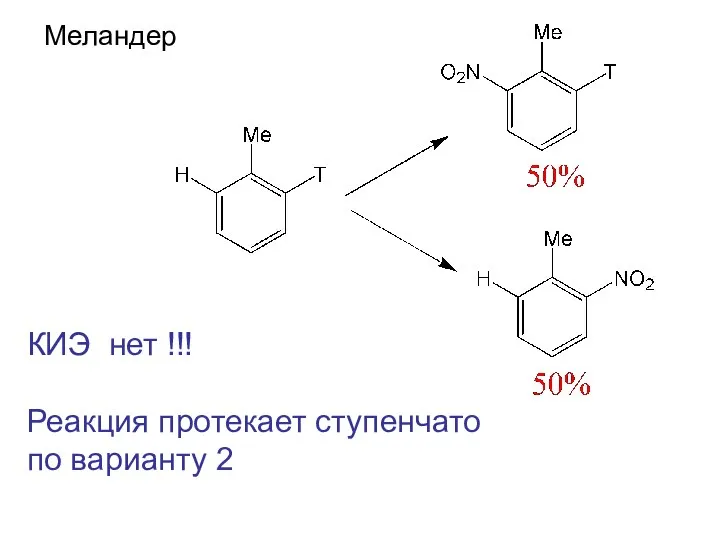
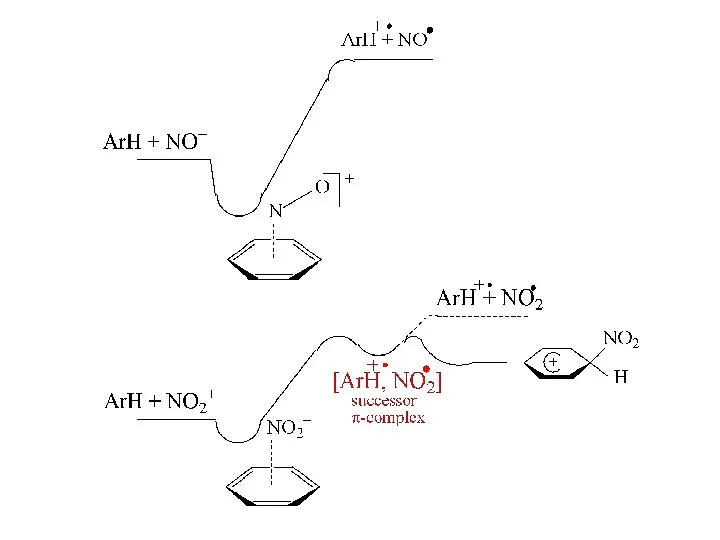
- 17. Меландер КИЭ нет !!! Реакция протекает ступенчато по варианту 2
- 18. История SET в SE Pfeiffer P., Wizinger R., 1928 г.: предположили участие катион-радикалов в нитровании Kenner
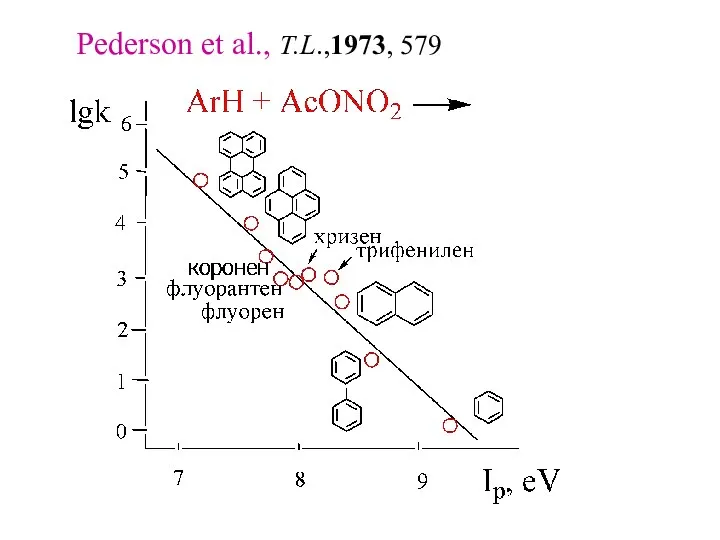
- 19. Pederson et al., T.L.,1973, 579
- 20. Энергетика SET в нитровании Анодные потенциалы (MeCN, Ag [0.01 M AgClO4), V 1.82 NO2 1.34 нафталин
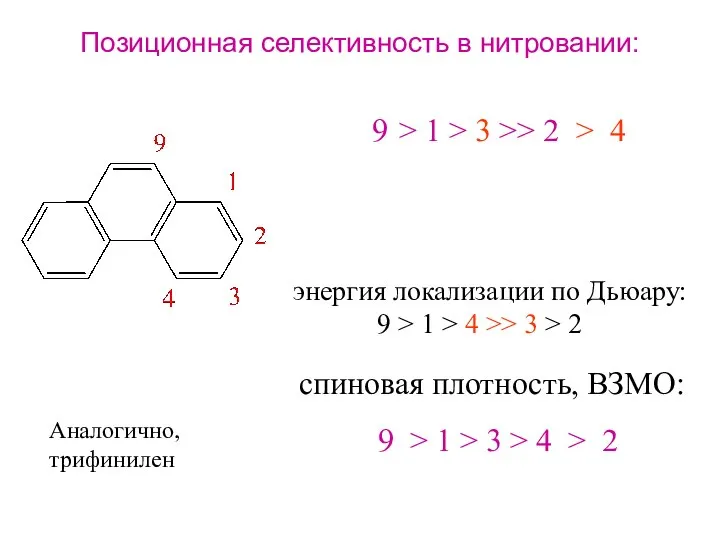
- 21. Позиционная селективность в нитровании: > 1 > 3 >> 2 > 4 спиновая плотность, ВЗМО: 9
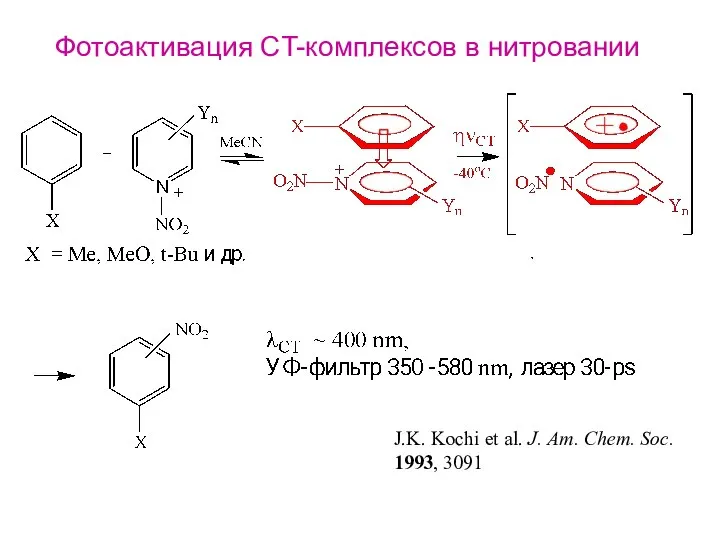
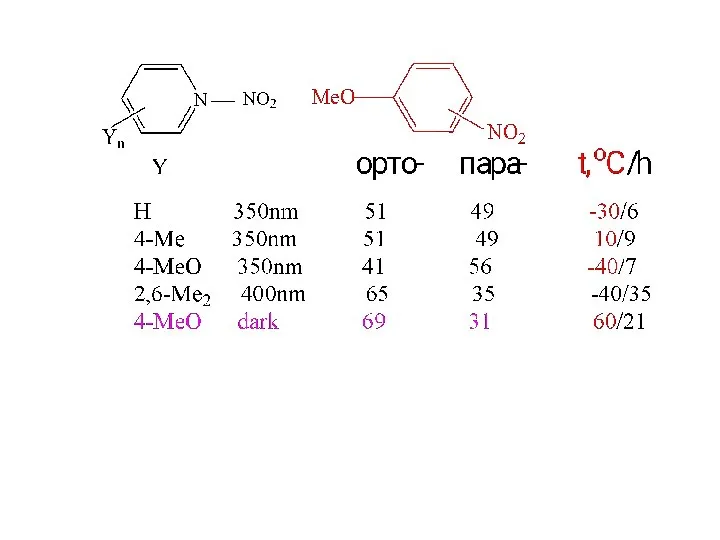
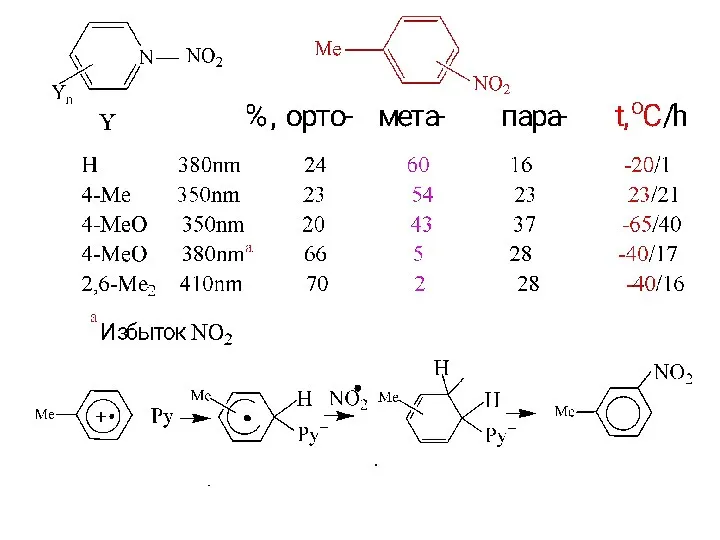
- 22. Фотоактивация CT-комплексов в нитровании J.K. Kochi et al. J. Am. Chem. Soc. 1993, 3091
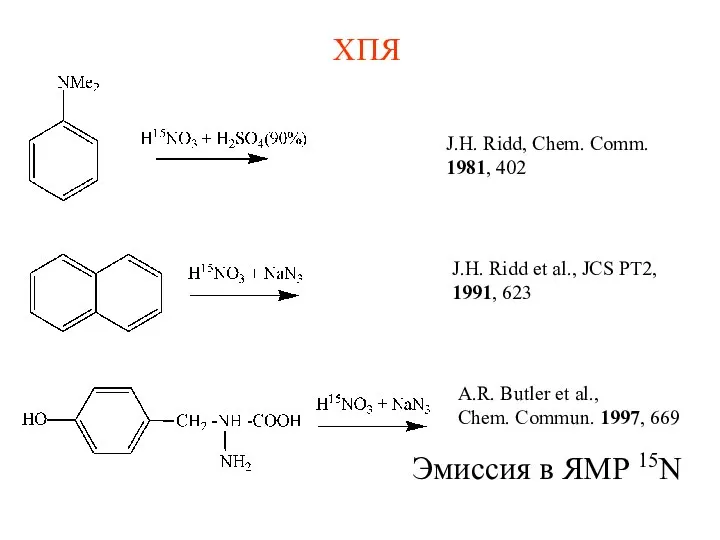
- 25. ХПЯ J.H. Ridd, Chem. Comm. 1981, 402 J.H. Ridd et al., JCS PT2, 1991, 623 Эмиссия
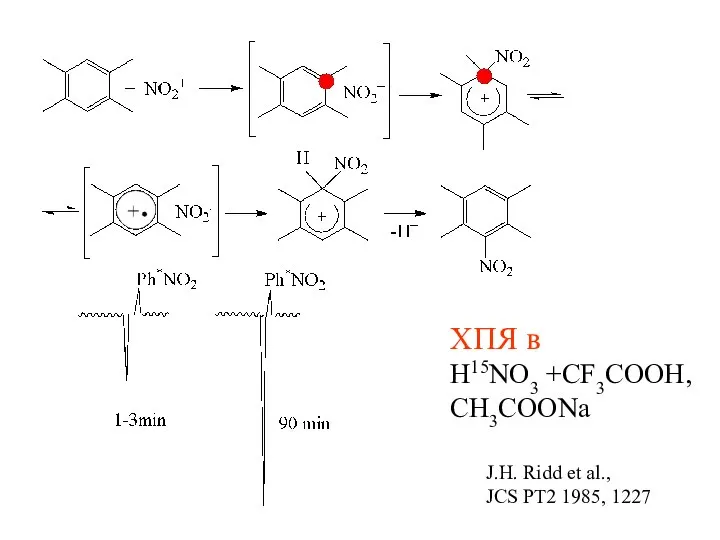
- 26. ХПЯ в H15NO3 +CF3COOH, CH3COONa J.H. Ridd et al., JCS PT2 1985, 1227
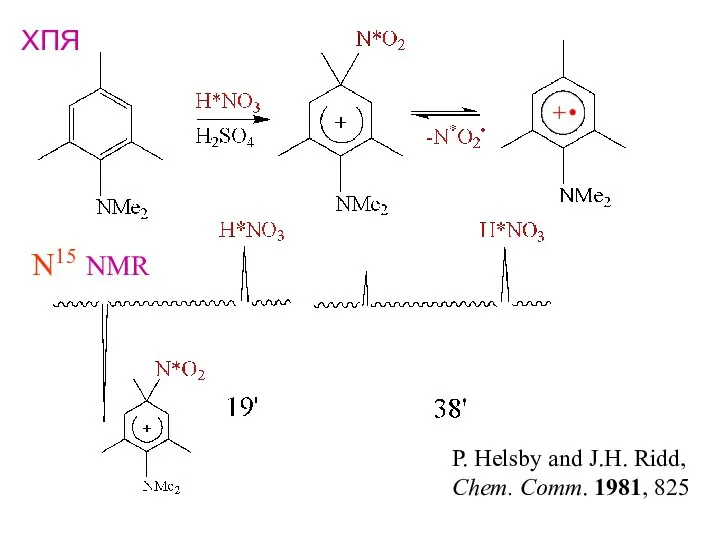
- 27. ХПЯ P. Helsby and J.H. Ridd, Chem. Comm. 1981, 825 N15 NMR
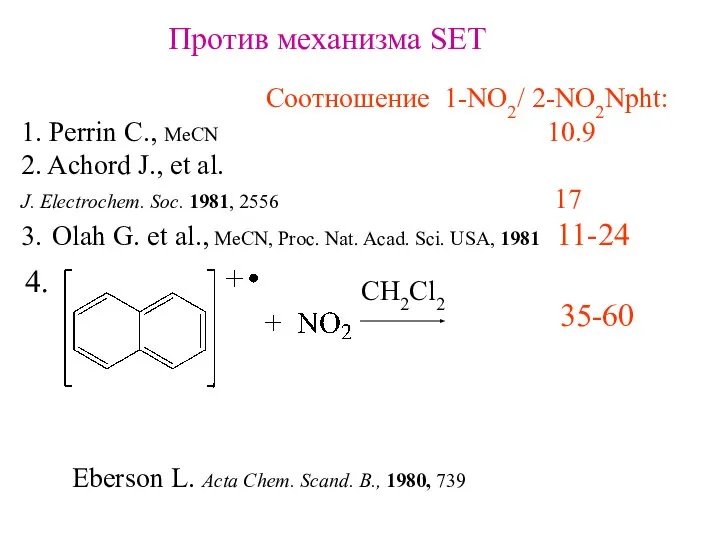
- 28. Против механизма SET Соотношение 1-NO2/ 2-NO2Npht: 1. Perrin C., MeCN 10.9 2. Achord J., et al.
- 29. Против механизма SET 2. Корреляция aH Е+лок. 3. Катализ NO+ и ХПЯ 4. Большая энергия реорганизации
- 30. G.A. Olah et al. J. Am. Chem. Soc., 2003, 4836 Кинетические изотопные эффекты Газовая фаза, ICR
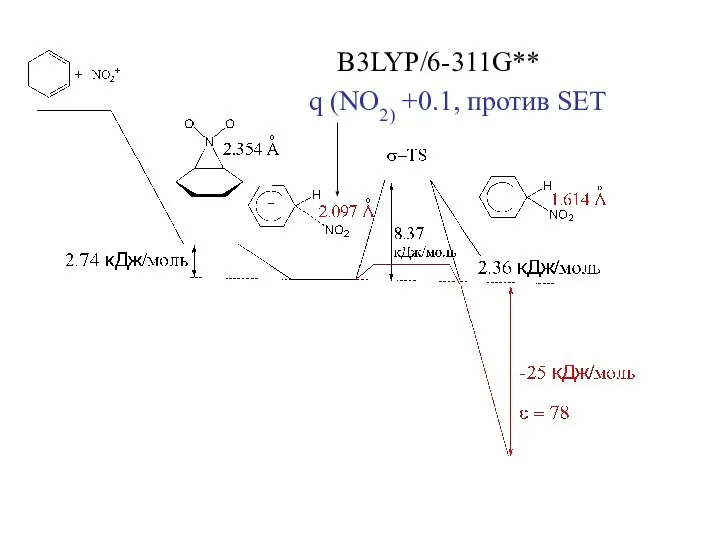
- 32. B3LYP/6-311G** q (NO2) +0.1, против SET
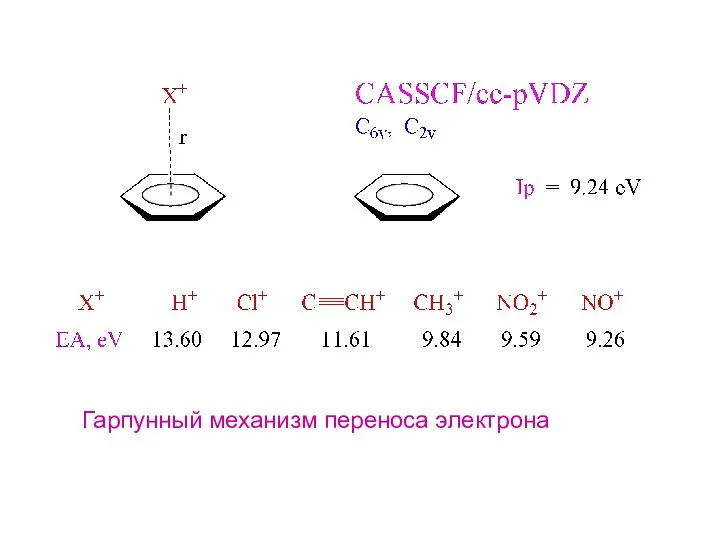
- 33. Гарпунный механизм переноса электрона
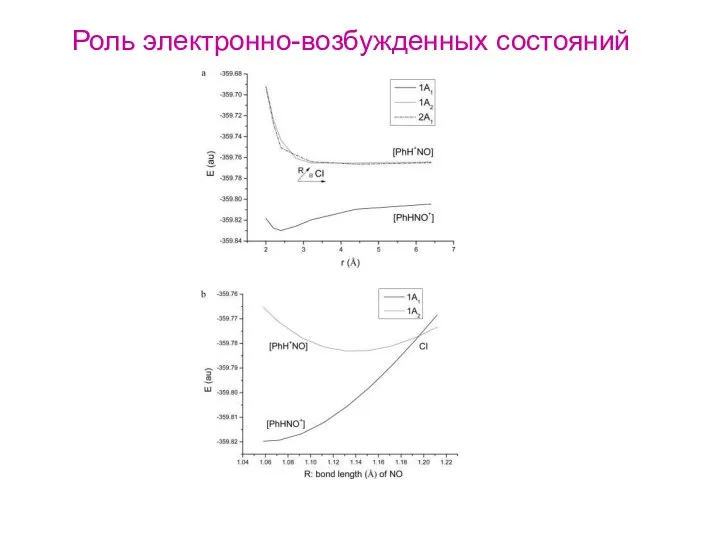
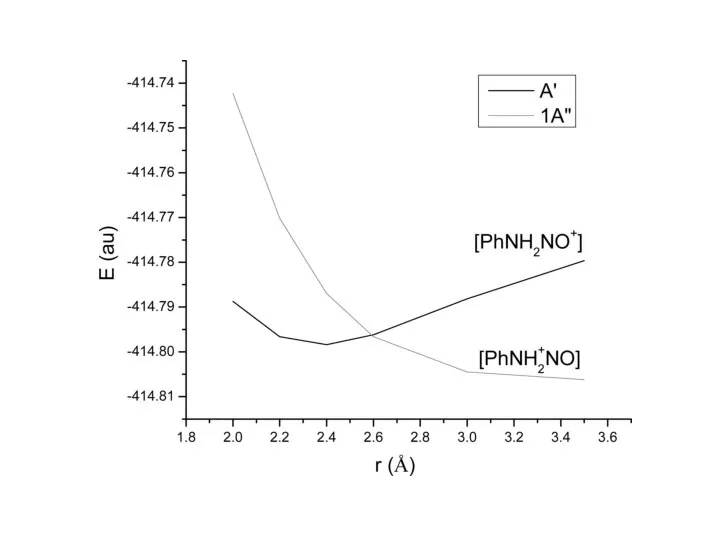
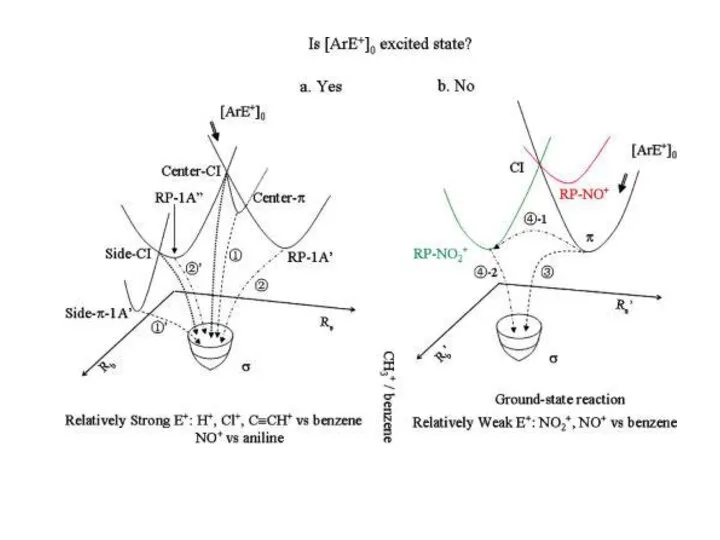
- 34. Роль электронно-возбужденных состояний
- 38. Скачать презентацию
![HNO3 X истинный нитрующий агент ArH + X ArNO2 [X] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304041/slide-12.jpg)




 Фармаконадзор
Фармаконадзор Программирование на языке высокого уровня
Программирование на языке высокого уровня О комнатных растениях - презентация для начальной школы
О комнатных растениях - презентация для начальной школы Минеральные вяжущие вещества. Химические процессы при получении вяжущих веществ
Минеральные вяжущие вещества. Химические процессы при получении вяжущих веществ 1 урок
1 урок Факторы, влияющие на ЭМС технических средств
Факторы, влияющие на ЭМС технических средств Товарные знаки и знаки обслуживания
Товарные знаки и знаки обслуживания Организационный аудит и проектирование
Организационный аудит и проектирование Свята в вересні
Свята в вересні Возникновение и исторические этапы развития научного менеджмента
Возникновение и исторические этапы развития научного менеджмента Морально-этические принципы работы юриста уголовно-правовой специализации
Морально-этические принципы работы юриста уголовно-правовой специализации Защита прав и законных интересов детей в учебно-воспитательном процессе образовательной организации
Защита прав и законных интересов детей в учебно-воспитательном процессе образовательной организации Спрос. Закон спроса. Эластичность спроса
Спрос. Закон спроса. Эластичность спроса  Сказка о царе Салтане
Сказка о царе Салтане Поверка средств измерений
Поверка средств измерений Гостиничная сеть Choice Hotels International
Гостиничная сеть Choice Hotels International  Розробка пасток в ОС Windows
Розробка пасток в ОС Windows Автор материалов: Безруких Марьяна Михайловна Трудности обучения письму и чтению в начальной школе. Род
Автор материалов: Безруких Марьяна Михайловна Трудности обучения письму и чтению в начальной школе. Род Фронт змін
Фронт змін Праздник «Новый Год». В гости к Деду Морозу
Праздник «Новый Год». В гости к Деду Морозу Мышление
Мышление ГОУ ВПО "САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ Н.Г. ЧЕРНЫШЕВСКОГО» (ФКНИИТ) ТЬЮТОРИАДА Intel® «Обучение для будущего» 2011 Обучающая площадка Тьютор: - презентация
ГОУ ВПО "САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ Н.Г. ЧЕРНЫШЕВСКОГО» (ФКНИИТ) ТЬЮТОРИАДА Intel® «Обучение для будущего» 2011 Обучающая площадка Тьютор: - презентация Художественная культура первой половины XIX века
Художественная культура первой половины XIX века Согласование реакции. правило Вудворда-Гоффмана
Согласование реакции. правило Вудворда-Гоффмана  « Юные исследователи» 3 класса МОУ «Рассветовская СОШ» Руководитель: Абдуллина Елена Валерьевна
« Юные исследователи» 3 класса МОУ «Рассветовская СОШ» Руководитель: Абдуллина Елена Валерьевна Reciprocating engines, their types
Reciprocating engines, their types Научная разработка стилистики в 20 в. Юлий Абрамович Бельчиков
Научная разработка стилистики в 20 в. Юлий Абрамович Бельчиков Внебюджетные фонды государства
Внебюджетные фонды государства