Содержание
- 2. Бактериологические исследования мяса Отбор проб Подготовка образцов к исследованию и проведение Методы обнаружения аэробов — Выявление
- 3. Бактериологические исследования мяса При различных заболеваниях животных и птицы мышцы и внутренние органы нередко обсеменены микроорганизмами.
- 4. при подозрении на остропротекающие инфекционные заболевания (сибирская язва, эмфизематозный карбункул и др.); при ящуре в случае
- 5. 11. при пироплазмидозах в случае исчезновения желтушности в течение двух суток; 12. при маститах, эндометритах, параметритах
- 6. 23. при обнаружении серозных и фибринозных, перикардитов у свиней; 24. при септикопиемических заболеваниях; 25. при гнойных
- 7. В зависимости от предполагаемого диагноза и характера патологоанатомических изменений для бактериологического исследования в ветеринарную лабораторию направляют:
- 8. Пробы берут стерильными инструментами. Каждую пробу в отдельности заворачивают в пергаментную бумагу или полиэтиленовую пленку и
- 9. Схема бактериологического исследования мяса Пробы: мясо, лимфатические узлы, внутренние органы, костный мозг Бактериоскопия мазков-отпечатков Посевы Реакция
- 10. Образцы освобождают от жировой и соединительной ткани, погружают на 2—3 мин. в спирт и два раза
- 11. Посев в среду обогащения производят следующим образом: в одну колбу со средой вносят 10 г измельченной
- 12. Колонии, подозрительные на Вас. anthracis, отвивают на поверхность скошенного МПА и МПБ для получения чистой культуры,
- 13. Обнаружение бацилл сибирской язвы. Сущность метода выявления бацилл сибирской язвы заключается в определении их характерной морфологии
- 14. Bacillus anthracis
- 16. Рост Вас. Anthracis на кровяном МПА
- 17. Споры Вас. Anthracis, окраска по Ауеске Мазок из чистой культуры Вас. Anthracis (РИФ)
- 18. На МПБ сибиреязвенные бациллы растут в виде крупных хлопьев, оседающих на дно пробирки к концу первых
- 19. Из исследуемого материала готовят взвесь на физиологическом растворе. 0,5 мл этой взвеси вводят двум белым мышам
- 20. 2 г исследуемого материала мелко нарезают, помещают в пробирку и заливают 10 мл карболинизированного 0,5%-ного физиологического
- 21. Для дифференциации необходимо сделать посевы на МПБ с кровью, МПЖ и исследовать культуру микроорганизма на подвижность.
- 22. В две пробирки с МПА, содержащими 0,5 и 0,05 ед. пенициллина, и в контрольную пробирку без
- 23. Для постановки этого теста применяют фаг «Гамма МВА». Исследуемую культуру высевают в 3 пробирки на скошенный
- 24. Свертываемость желтка куриного яйца определяют следующим образом. Исследуемую культуру высевают в пробирку со средой Дрожжевкиной. Посевы
- 25. Выявление возбудителей рожи свиней, листериоза, пастереллеза и других инфекций Наличие в чашках с МПА прозрачных колоний
- 26. Erysipelothrix rhusiopathiae
- 27. Listeria monocytogenes
- 28. Pasteurella multocida
- 29. Если в мазках, приготовленных из мелких прозрачных колоний, обнаруживают коккообразные грамотрицательные палочки, расположенные в виде диплококка,
- 31. Наличие на чашках с МПА мелких прозрачных или слегка мутноватых колоний, образующих иногда различные пигменты, дает
- 32. Staphylococcus epidermidis
- 33. Staphylococcus aureus
- 34. Род Streptococcus
- 35. На дифференциально-диагностических средах (Эндо, Левина) учитывают подозрительные колонии, характерные для сальмонелл. В случае отсутствия роста колоний,
- 36. Сначала культуру испытывают в реакции агглютинации с одной из О-сывороток. Выбирают сыворотку, исходя из вида животного,
- 37. На предметное стекло из ампулы наносят каплю неразведенной сыворотки. Затем платиновой петлей берут испытуемую 20-часовую агаровую
- 38. В случае отрицательной реакции агглютинации, но при характерном росте на элективной среде и соответствующих морфологических признаках
- 39. Для идентификации сальмонеллезных культур предлагается использовать О-фаготест — определение фагочувствительности сальмонелл к О-бактериофагу. О-фаготест позволяет дифференцировать
- 40. Род Salmonella
- 41. Сущность метода заключается в изучении морфологических, культуральных, ферментативных свойств этих бактерий. Наличие на средах в чашках
- 42. Сущность выявления анаэробов заключается в определении их морфологии, способности расти на питательных средах в отсутствие кислорода
- 43. Диагноз на анаэробные инфекции ставят на основании бактериоскопии, посева материала на питательные среды и биопробы на
- 44. Clostridium botulinum
- 45. Cl. perfringens — короткая, спорообразующая, неподвижная, грамположительная палочка, анаэроб. Существуют 6 типов Cl. perfringens, обозначаемых начальными
- 46. При подозрении на Cl. botulinum для выявления типа Е пробирки — одну непрогретую и одну прогретую
- 47. Аналогичный эксперимент можно провести с 6—7-месячной культурой, выращенной на печеночном бульоне. Пастеровской пипеткой отсасывают верхний слой
- 48. Clostridium perfringens
- 52. Микобактерии — это микроорганизмы, обладающие способностью при культивировании на питательных средах образовывать длинные нити со вздутиями
- 53. В лаборатории из присланного материала (кусочки печени, селезенки, легких и лимфоузлов) делают мазки, фиксируют их на
- 54. Для получения культур микобактерий туберкулеза материал перед посевом обрабатывают по методу Л, П. Аликаевой или Гона.
- 55. Mycobacterium tuberculosis
- 56. Mycobacterium bovis
- 58. Скачать презентацию
Бактериологические исследования мяса
Отбор проб
Подготовка образцов к исследованию и проведение
Методы обнаружения аэробов
Бактериологические исследования мяса
Отбор проб
Подготовка образцов к исследованию и проведение
Методы обнаружения аэробов
— Выявление возбудителей рожи свиней, листериоза, пастереллеза
— Выявление бактерий кокковой группы
— Выявление бактерий рода Salmonella
— Выявление бактерий рода Proteus
Методы обнаружения анаэробов
Методы обнаружения микобактерий
Содержание
Бактериологические исследования мяса
При различных заболеваниях животных и птицы мышцы и внутренние
Бактериологические исследования мяса
При различных заболеваниях животных и птицы мышцы и внутренние
Цель бактериологического анализа — подтверждение или исключение диагноза на инфекционные болезни, а также выяснение вопроса о наличии в мясе микробов, вызывающих пищевые токсикоинфекции и токсикозы.
Бактериологическое исследование проводят в случаях, предусмотренных действующими Правилами ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов (1983 г.) и нормативно-технической документацией (ГОСТ 21237— 75. Мясо. Методы бактериологического анализа).
при подозрении на остропротекающие инфекционные заболевания (сибирская язва, эмфизематозный карбункул и
при подозрении на остропротекающие инфекционные заболевания (сибирская язва, эмфизематозный карбункул и
при ящуре в случае обнаружения в мышцах единичных некротических очагов;.
при чуме свиней, роже, пастереллезе и болезни Ауески в случае отсутствия патологических изменений в мускулатуре туши и во внутренних органах;
при некробактериозе в случае поражения нескольких органов и удовлетворительной упитанности туши;
при лейкозе. в случае поражения отдельных лимфатических узлов или органов и отсутствия изменений в скелетной мускулатуре;
при мыте;
при беломышечной болезни и кетозах, если изменения в мускулатуре слабо выражены (цвет бело-розовый) или при патологоанатомических изменениях в органах или части скелетной мускулатуры;
при инфекционном ринотрахеите, парагриппе-3, вирусной диарее, аденовирусной инфекции с наличием патологоанатомических изменений в туше и во внутренних органах;
при стахиботриотоксикозе в случае отсутствия патологоанатомических изменений (некротических участков);
при осложненном течении онхоцеркоза с признаками гнойно-некротических процессов;
Бактериологический анализ проводят в следующих случаях:
11. при пироплазмидозах в случае исчезновения желтушности в течение двух суток;
12.
11. при пироплазмидозах в случае исчезновения желтушности в течение двух суток;
12.
13. во всех случаях вынужденного убоя животных независимо от причин убоя и принадлежности животных;
14. при отравлении или подозрении на отравление ядовитыми веществами химического или растительного происхождения;
15. при подозрении на сальмонеллезные заболевания или на обсеменение мяса сальмонеллами;
16. при желудочно-кишечных заболеваниях;
17. при тяжело протекающих заболеваниях органов дыхания;
18. при обширных ожогах, кровоизлияниях с воспалительными явлениями в лимфатических узлах и признаках септического процесса или при небольших кровоизлияниях в подкожной клетчатке, во внутренних органах, на слизистых оболочках;
19. при отеках внутренних органов и частей туши;
20. при жировом перерождении печени;
при наличии гнойных очагов в печени, почках, селезенке и легких;
при желтушном окрашивании всех тканей туши, исчезающем в течение двух суток;
23. при обнаружении серозных и фибринозных, перикардитов у свиней;
24. при септикопиемических
23. при обнаружении серозных и фибринозных, перикардитов у свиней;
24. при септикопиемических
25. при гнойных нефритах, нефрозах;
26. при удалении кишечника из туши позднее чем через 2 ч. после убоя животного;
27. при обнаружении в паренхиматозных органах множественных абсцессов;
28. при доставке на колхозный рынок неклейменого мяса без головы и внутренних органов или без справки ветеринарного врача (фельдшера);
29. при сомнительной свежести мяса или других продуктов и невозможности установить их доброкачественность органолептическим путем, а также во всех других случаях, когда санитарная оценка не может быть дана по результатам ветеринарного осмотра;
30. по требованию органов ветеринарного и санитарного надзора;
31. при обнаружении в сырокопченых колбасах бактерий группы кишечной палочки или протея после дополнительной выдержки в течение 10—12 сут. в случае сохранения нормальных органолептических свойств.
В зависимости от предполагаемого диагноза и характера патологоанатомических изменений для
В зависимости от предполагаемого диагноза и характера патологоанатомических изменений для
две пробы мышц — часть сгибателя или разгибателя передней и задней конечности или кусок другой мышцы имеете с покрывающей его фасцией размером не менее 8 х 6 х 6 см;
лимфатические узлы (не менее двух) — поверхностный шейный или собственно подкрыльцовый и наружном подвздошный; от свиных туш — подчелюстной и поверхностный шейный дорсальный или подкрыльцовый первого ребра и подколенной складки. Лимфатические узлы берут целиком вместе с окружающими их соединительной и жировой тканью;
внутренние органы — целиком селезенку и почку, долю печени с печеночным лимфатическим узлом или опорожненным желчным пузырем. Поверхность разреза доли печени прижигают до образования струпа;
трубчатую кость (посылают для уточнения диагноза с целью выделения более чистой культуры возбудителя). При исследовании полутуш или четвертин туш в лабораторию направляют кусок мышцы, лимфатические узлы и трубчатую кость.
Отбор проб
Пробы берут стерильными инструментами. Каждую пробу в отдельности заворачивают в
Пробы берут стерильными инструментами. Каждую пробу в отдельности заворачивают в
Если же лаборатория находится на большом расстоянии от места взятия материала и его невозможно доставить в течение 24—30 ч., то для предупреждения размножения гнилостной микрофлоры пробы консервируют. Для этого их помещают в 30 %-ный водный раствор глицерина. Воду предварительно стерилизуют кипячением. Материал можно консервировать в стерильном вазелиновом масле. Консервирующую жидкость заливают в количестве, в 4—5 раз превышающем объем материала.
Обработанный материал укладывают в оцинкованный ящик и пересыпают опилками, смоченными дезинфицирующим средством. При необходимости тару с образцами опечатывают или пломбируют.
В сопроводительном документе указывают: вид мяса, его принадлежность, перечень пересылаемых проб и их количество, причину направления материала, краткие патологоанатомические данные, предполагаемый диагноз, дату взятия образцов и подпись лица, направившего их на исследования.
Кроме того, следует сообщить данные осмотра туши и внутренних органов, основное содержание ветеринарного документа с места доставки туш и какое требуется провести исследование.
Схема бактериологического исследования мяса
Пробы: мясо, лимфатические узлы, внутренние органы, костный мозг
Бактериоскопия
Схема бактериологического исследования мяса
Пробы: мясо, лимфатические узлы, внутренние органы, костный мозг
Бактериоскопия
Посевы
Реакция преципитации на сибирскую
язву (при подозрении)
Мясо-пептонный
агар
Элективные
среды
Среды обогащения (для
накопления сальмонелл)
Скошенный агар по
Шукевичу и агар
Плоскирева (для
обнаружения протея)
Среда
Китта-Тароцци
(на анаэробы)
Изучение характера роста,
микроскопия мазков из
подозрительных колоний
Отсевы
Проба на каталазу (для
обнаружения листерий)
Определение подвижности
Реакция агглютинации с моноре-
цепторными О- и Н-адсорбиро-
ванными сыворотками
Трехсахарный агар Крумвиде-Олькеницкого
в модификации Ковальчука
Элективные среды
(агар Эндо,
агар Левина)
Изучение характера
роста, микроскопия
мазков из
подозрительных
колоний
Определение
подвижности
Пестрый ряд
Изучение характера
роста. Мик-
роскопия мазков
Определение
подвижности
Пестрый ряд
Изучение
характера
роста,
микроскопия
мазков
Биопроба
Реакция
агглютинации с
монорецептор-
ными О- и Н-
адсорбированными
сыворотками
МПА
МПБ
Желатин
МПА с
кровью
Углеводная среда
с салицином
Мясо-пептонный
печеночный агар
Пестрый
ряд
Биопроба
Образцы освобождают от жировой и соединительной ткани, погружают на 2—3
Образцы освобождают от жировой и соединительной ткани, погружают на 2—3
Для посева составляют две пробы по 15 г каждая (одна —из кусочков мышц и лимфатических узлов; другая — из кусочков печени, почек, селезенки. Каждую пробу помещают в стерильные стаканы гомогенизатора, куда добавляют по 15 мл физиологического раствора (1 мл полученной взвеси содержит 0,5 г продукта) и отстаивают 10 мин. Затем петлей или пастеровской пипеткой из верхнего слоя надосадочной жидкости каждой взвеси делают посевы на поверхность подсушенного МПА для обнаружения возбудителей некоторых зооантропонозов (сибирская язва, рожа свиней, листериоз, пастереллез, а также кокковые инфекции); на поверхность элективной среды (среда Эндо или Левина) — для обнаружения сальмонелл и бактерий группы кишечных палочек; в среду Киллиана—для выделения Salmonella cholerae suis; в одну из сред обогащения (селенитовый Ф-бульон, Мюллера, Кауфмана и др.) —для накопления сальмонелл; в среду Б или Хейфеца— для обнаружения бактерий группы кишечных палочек; в конденсационную воду свежескошенного МПА (метод Шукевича) —для обнаружения бактерий рода Proteus; в среду Китта-Тароцци—при подозрении на анаэробные инфекции.
Подготовка образцов к исследованию и проведение
Посев в среду обогащения производят следующим образом: в одну колбу
Посев в среду обогащения производят следующим образом: в одну колбу
Посевы помещают в термостат при температуре 37°С. Через 18 ч. их просматривают визуально, при необходимости — через лупу или под микроскопом при малом увеличении.
Если роста не наблюдается через 18 ч., то посевы выдерживают в термостате дополнительно 6 ч. В зависимости от результатов бактериоскопии и характера роста на питательных средах проводят исследование на наличие возбудителя определенной инфекции.
Колонии, подозрительные на Вас. anthracis, отвивают на поверхность скошенного МПА
Колонии, подозрительные на Вас. anthracis, отвивают на поверхность скошенного МПА
Методы обнаружения аэробов
Выявление возбудителя сибирской язвы
Обнаружение бацилл сибирской язвы. Сущность метода выявления бацилл сибирской язвы
Обнаружение бацилл сибирской язвы. Сущность метода выявления бацилл сибирской язвы
Бациллы сибирской язвы неподвижны, в организме образуют капсулы, а во внешней среде при доступе кислорода и температуре 12—42 °С — споры. При микроскопии мазков из патологического материала обнаруживают крупные грамположительные палочки, соединенные в короткие цепочки, а иногда цепочки имеют форму бамбуковой трости.
При окраске 2 %-ным раствором сафранина сибиреязвенные бациллы окрашиваются в кирпично-красный цвет, а капсулы и теки (следы распада бактерий) — в светло-желтый.
При окраске раствором Ребигера бациллы антракса окрашиваются в темно-фиолетовый цвет, а капсулы — в красно-фиолетовый.
На МПА через 16—24 ч бациллы растут в виде серо-белых, шероховатых с бахромчатыми краями колоний, напоминающих при осмотре с лупой «головку медузы» Или «львиную гриву». Из подозрительной колонии делают посев в пробирку с МПБ.
Bacillus anthracis
Bacillus anthracis
Рост Вас. Anthracis
на кровяном МПА
Рост Вас. Anthracis
на кровяном МПА
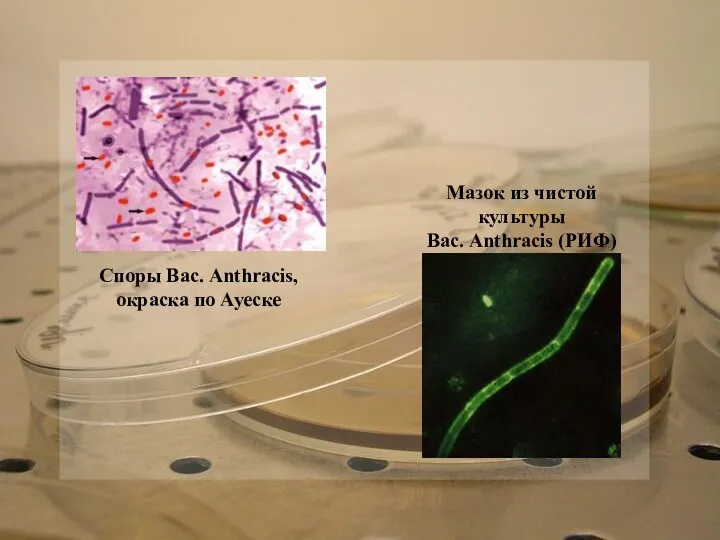
Споры Вас. Anthracis,
окраска по Ауеске
Мазок из чистой культуры
Вас. Anthracis (РИФ)
Споры Вас. Anthracis,
окраска по Ауеске
Мазок из чистой культуры
Вас. Anthracis (РИФ)
На МПБ сибиреязвенные бациллы растут в виде крупных хлопьев, оседающих
На МПБ сибиреязвенные бациллы растут в виде крупных хлопьев, оседающих
Иногда возникает необходимость дифференцировать сибиреязвенные бациллы от сапрофитных бацилл, которые морфологически очень сходны. В этом случае чистую культуру, выросшую на МПА или МПБ, исследуют: на капсулообразование in vitro, на гемолитическую активность, на тест «жемчужное ожерелье», на чувствительность к сибиреязвенному фагу или на свертываемость желтка куриного яйца.
Для возбудителя сибирской язвы в отличие от сапрофитных бацилл характерно отсутствие гемолиза как вокруг колоний на МПА, так и в МПБ с кровью.
Из исследуемого материала готовят взвесь на физиологическом растворе. 0,5 мл
Из исследуемого материала готовят взвесь на физиологическом растворе. 0,5 мл
Постановка биологической пробы
2 г исследуемого материала мелко нарезают, помещают в пробирку и
2 г исследуемого материала мелко нарезают, помещают в пробирку и
Основанием для постановки диагноза на сибирскую язву являются наличие капсул в мазках из органов, а в мазках из культуры — грамположительных палочек, расположенных в виде цепочек; концы палочек, обращенные друг к другу, резко обрублены; характерный рост на МПА, МПБ, МПЖ; положительная РП и положительный результат биологической пробы.
При бактериологическом исследовании на сибирскую язву, особенно несвежего материала, часто обнаруживают большое количество посторонней микрофлоры. В этом случае трудно дифференцировать Вас. anthracis от антракоидов, псевдоантраксных палочек и других спорообразующих сапрофитных аэробов, положительно красящихся по Граму и имеющим колонии, сходные с колониями сибиреязвенного микроба.
Постановка РП
Для дифференциации необходимо сделать посевы на МПБ с кровью, МПЖ
Для дифференциации необходимо сделать посевы на МПБ с кровью, МПЖ
Экспресс-методы дифференциации
Вас. anthracis и почвенных
спорообразующих бактерий
В две пробирки с МПА, содержащими 0,5 и 0,05 ед.
В две пробирки с МПА, содержащими 0,5 и 0,05 ед.
При положительной реакции теста «жемчужное ожерелье» бациллы сибирской язвы, засеянные на МПА с пенициллином, приобретают шарообразную форму, а цепочки их имеют вид ожерелья. Споровые сапрофитные аэробы (контроль) имеют обычную форму палочек.
Феномен «жемчужное ожерелье»
Для постановки этого теста применяют фаг «Гамма МВА». Исследуемую культуру
Для постановки этого теста применяют фаг «Гамма МВА». Исследуемую культуру
Испытуемую культуру засевают на среду ГКИ и помещают в термостат при 37°С. Через 30—120 мин наблюдается образование капсул у отдельных сибиреязвенных палочек, а через 16—18 ч. — у большинства.
При хронических сибиреязвенных процессах, сопровождающихся некрозом ткани, обнаруживают лишь слабоокрашенные тени, напоминающие сибиреязвенные бациллы.
Чувствительность к сибиреязвеннному фагу
Феномен капсулообразования
Свертываемость желтка куриного яйца определяют следующим образом. Исследуемую культуру
Свертываемость желтка куриного яйца определяют следующим образом. Исследуемую культуру
Ее определяют путем засева культуры на чашки с кровяным агаром или на МПБ с кровью. Посевы помещают в термостат при 37оС на 20—24 ч.
Гемолитическая активность
Свертываемость желтка куриного яйца
Выявление возбудителей рожи свиней,
листериоза, пастереллеза и других инфекций
Наличие в
Выявление возбудителей рожи свиней,
листериоза, пастереллеза и других инфекций
Наличие в
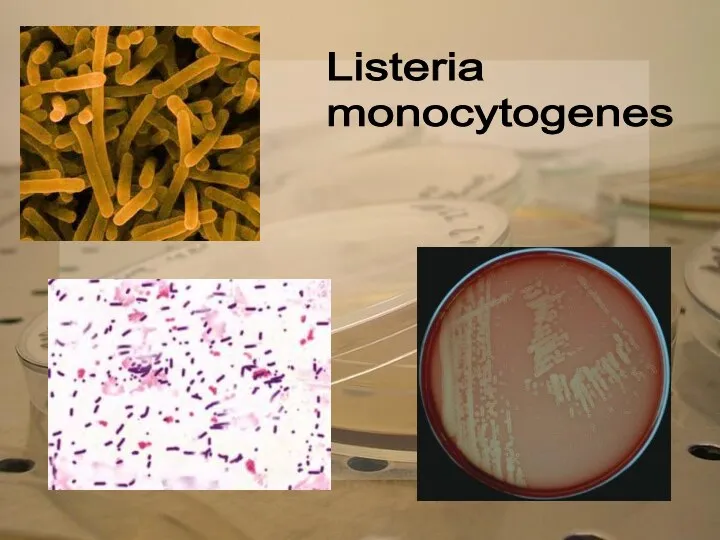
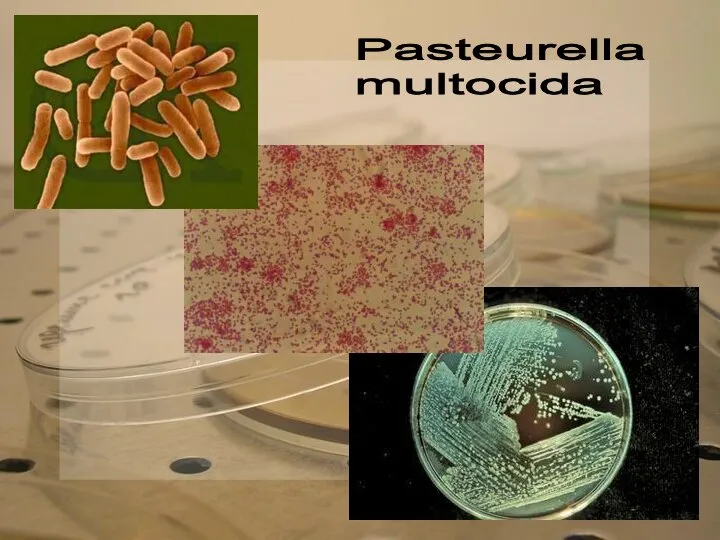
Из подозрительных колоний готовят мазки, окрашивают их по Граму. Микробы исследуют на подвижность и делают посев на МПА, МПБ, МПЖ, молоко, полужидкие углеводные среды с индикатором ВР, на агар с 4% пептона и 0,25% уксуснокислого свинца.
Листерии и рожистые палочки дифференцируют на основании морфологических, культуральных и ферментативных свойств. Иногда ставят биопробу.
Erysipelothrix rhusiopathiae
Erysipelothrix rhusiopathiae
Listeria
monocytogenes
Listeria
monocytogenes
Pasteurella
multocida
Pasteurella
multocida
Если в мазках, приготовленных из мелких прозрачных колоний, обнаруживают коккообразные
Если в мазках, приготовленных из мелких прозрачных колоний, обнаруживают коккообразные
Существует метод ускоренной идентификации возбудителей рожи свиней, листериоза, сальмонеллеза с помощью флюоресцирующих (люминесцирующих)" антител. Сущность метода заключается в определении способности антител иммунных сывороток при соединении через карбомидные группы со специальными красителями (флюорохромами) вступать в специфическую связь с соответствующими антигенами. Образующийся при этом комплекс антиген—антитело флюоресцирует, и его легко можно обнаружить при люминесцентной микроскопии. Применение метода люминесцирующих сывороток для идентификации выделенной культуры микробов ускоряет исследование, так как исключает в ряде случаев необходимость определения культуральных, ферментативных, антигенных и других свойств микроорганизмов.
Наличие на чашках с МПА мелких прозрачных или слегка мутноватых
Наличие на чашках с МПА мелких прозрачных или слегка мутноватых
Дифференциальный диагноз ставят на основании микроскопического исследования (грамположительные, неподвижные, неспорообразующие круглые клетки, располагающиеся одиночно, цепочками, гроздями, в виде ланцетовидных диплококков), а также определения характера роста на питательных средах. На МПБ стафилококки и диплококки дают равномерное помутнение, на дно пробирки выпадает осадок. При росте стрептококков в МПБ с 2% глюкозы бульон остается прозрачным, а на дно пробирки выпадает осадок. Патогенность стафилококков определяют реакцией коагулирования плазмы крови. Для этой цели берут 2 пробирки с плазмой крови кроликов. В одну из них бактериологической петлей вносят суточную агаровую культуру испытуемого стафилококка и тщательно перемешивают. Другая пробирка является контрольной. Пробирки помещают в термостат при 37°С. Результаты реакции учитывают через 2—4 и 24 ч. Штаммы стафилококка, продуцирующие фермент плазмокоагулазу, свертывают плазму, вследствие чего она превращается в студнеобразную массу. Положительная реакция указывает на наличие в мясе патогенных стафилококков.
Выявление бактерий кокковой группы
Staphylococcus
epidermidis
Staphylococcus
epidermidis
Staphylococcus aureus
Staphylococcus aureus
Род
Streptococcus
Род
Streptococcus
На дифференциально-диагностических средах (Эндо, Левина) учитывают подозрительные колонии, характерные для
На дифференциально-диагностических средах (Эндо, Левина) учитывают подозрительные колонии, характерные для
Пересевы со сред обогащения целесообразно производить на среду Плоскирева, так как число случаев выделения сальмонелл на этой среде наибольшее. Эта среда ингибирует рост вульгарного протея, или он вырастает на ней в О-форме.
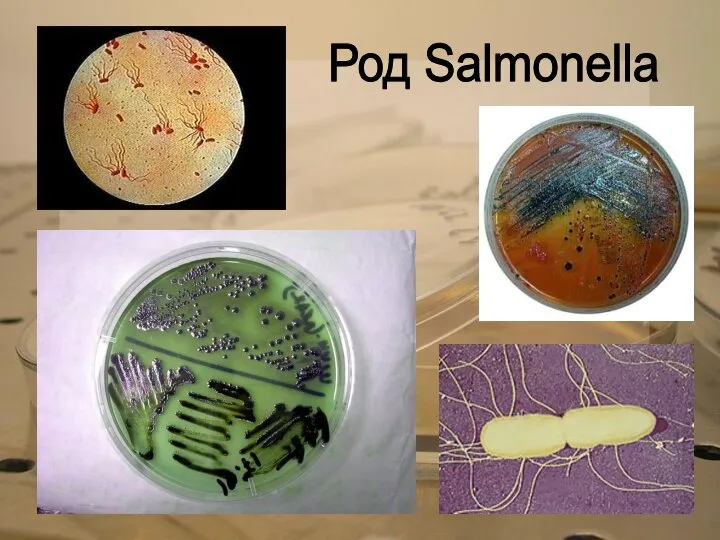
При обнаружении на среде Эндо или Левина подозрительных на сальмонелл колоний готовят мазки, окрашивают их по Граму, исследуют подвижность микробов. Одновременно с микроскопией ставят реакцию агглютинации на предметном стекле с поливалентной агглютинирующей сальмонеллсзной сывороткой пяти основных групп (B1, C 1, С 2, D 1, E 1). В ветеринарной практике чаще всего встречаются бактерии этих групп. Отрицательная реакция с поливалентной сывороткой указывают на то, что испытуемая культура не принадлежит к группам В 1, С 1, С 2, D 1, E 1. Если испытуемая культура дает положительную агглютинацию с поливалентной сывороткой, то это позволяет отнести ее к роду Salmonella одной из пяти групп. Такую культуру окончательно идентифицируют в РА с монорецепторными агглютинирующими сальмонеллезными О- и Н-сыворотками, устанавливая в ней наличие не всех присущих ей антигенов, а лишь основных, имеющих значение для дифференциации.
Выявление бактерий рода Salmonella
Сначала культуру испытывают в реакции агглютинации с одной из О-сывороток.
Сначала культуру испытывают в реакции агглютинации с одной из О-сывороток.
Затем культуру испытывают в РА ,с Н-сыворотками первой и второй фазы. В выборе сывороток для реакции исходят из антигенной структуры сальмонелл той группы, к которой отнесена определенная культура, с учетом вида животного, от которого она выделена. При положительной РА с определенными О- и Н-сыворотками испытуемую культуру относят к одному из серотипов.
При идентификации сальмонелл по антигенной структуре иногда возникает трудность в определении Н-антигеиа или одной из его фаз, что может быть обусловлено угнетением или утратой Н-антигена (потеря подвижности) либо преобладанием какой-либо одной фазы.
Для восстановления агглютинабильности и выявления специфической фазы Н-антигена можно использовать метод роения в чашках по Свену Гарду. Принцип этого феномена основан на том, что при добавлении к агару гомологичной Н-сыворотки подавляется подвижность бактерий, зависящая от этой фазы. Фаза, не подвергающаяся влиянию сыворотки, разрастается и может быть выделена из краевой части колонии.
На предметное стекло из ампулы наносят каплю неразведенной сыворотки. Затем
На предметное стекло из ампулы наносят каплю неразведенной сыворотки. Затем
При положительной реакции (через 1—2 мин.) образуется агглютинат, который можно наблюдать в виде плотных комочков, зернышек (О-агглютинация) или крупных, рыхлых, легко разбивающихся хлопьев (Н-агглютинация). С образованием агглютината жидкость становится прозрачной. При отрицательной реакции культура распределяется в капле в виде гомогенной взвеси.
Если выделенная культура типична по морфологии (грамотрицательные подвижные палочки), имеет характерный рост па элективной среде, дает положительную реакцию агглютинации, то ее относят к роду Salmonella.
Постановка реакции агглютинации
В случае отрицательной реакции агглютинации, но при характерном росте на
В случае отрицательной реакции агглютинации, но при характерном росте на
Если по ферментативным свойствам культура принадлежит к роду Salmonella, а реакция агглютинации отрицательна, то микроб относят к неагглютинабильным штаммам сальмонелл. Для уточнения вида выделенного штамма сальмонелл можно поставить биологическую пробу.
Биологическую пробу проводят обычно на белых мышах путем введения культуры peros. За животными наблюдают в течение 10 — 12 сут. Культура патогенна, если зараженные мыши погибают. В этом случае производят высевы из внутренних органов животных на элективную среду.
При нетипичности выделенной культуры по ферментативным свойствам (отклонения в ферментации тех или иных углеводов и спиртов), но избирательно агглютинирующей монорецепторные сыворотки, ее относят к бактериям рода Salmonella.
Если по ферментативным свойствам культура нетипична и агглютинируется несколькими монорецепторными сыворотками разных серологических групп (явление параагглютинации), то культуру не относят к роду Salmonella.
При невозможности полной типизации выделенную культуру сальмонелл направляют в соответствующий научно-исследовательский институт.
Для идентификации сальмонеллезных культур предлагается использовать О-фаготест — определение фагочувствительности
Для идентификации сальмонеллезных культур предлагается использовать О-фаготест — определение фагочувствительности
Для испытания культур на чувствительность к О-бактериофагу на пластинке хорошо подсушенного мясопептонного агара (рН 7,2— 7,4) стерильной пробиркой с ровным краем делают 5—6 насечек. На каждую насечку наносят тонкой пастеровской пипеткой по 2 капли 4- или 18-часовой бульонной культуры испытуемого штамма. После подсыхания культуры наносят каплю О-бактериофага, на другую в качестве контроля наносят каплю бульона (фаг наносят в 10- или 100-кратном разведении в зависимости от указанного на этикетке). Чашки помещают в термостат при 37°С на 18—20 ч. При положительном результате на месте нанесения фага видна четко очерченная зона лизиса. При отрицательной реакции лизис культуры отсутствует. Контроль также отрицательный: отмечен рост культуры микроорганизма.
Фаготипизирование
Род Salmonella
Род Salmonella
Сущность метода заключается в изучении морфологических, культуральных, ферментативных свойств этих
Сущность метода заключается в изучении морфологических, культуральных, ферментативных свойств этих
Наличие на средах в чашках Петри вуалеобразного налета (Н-форма), при микроскопии которого обнаруживают полиморфные грамотрицательные подвижные палочки, указывает на присутствие вульгарного протея. Для подтверждения наличия протея (Н-форма) производят посев в конденсационную воду свежескошенного агара (способ Шукевича). Присутствие изолированных колоний средней величины, нежных, полупрозрачных, с розоватым центром, свидетельствует о наличии нероящихся О-форм протея. При микроскопии этих колоний обнаруживают грамотрицательные неподвижные палочки. Для подтверждения наличия О-форм протеуса производят посев на агар Плоскирева. О-форма протеуса образует на этой среде прозрачные колонии с характерным запахом. Среда вокруг колоний приобретает желтый цвет в результате ее подщелачивания. Старые колонии нередко мутнеют и принимают белую окраску.
Выявление бактерий рода Proteus
Сущность выявления анаэробов заключается в определении их морфологии, способности расти
Сущность выявления анаэробов заключается в определении их морфологии, способности расти
Удовлетворительные анаэробные условия создаются в жидких питательных средах, в которых используют печень и мясо в качестве восстановления и источника питания.
Бактериологическое исследование на присутствие возбудителей анаэробных инфекций проводят при подозрении на следующие заболевания: ботулизм, энтеротоксемия овец, дизентерия ягнят, некробактериоз, столбняк, эмфизематозный карбункул (эмкар), злокачественный отек и брадзот овец.
В зависимости от подозреваемого заболевания отбор проб в лабораторию может быть различен. Так, для исследования направляют: при ботулизме — селезенку, кусочек печени, головной мозг и содержимое желудка; при энтеротоксемии овец и дизентерии ягнят — пораженную ; почку и содержимое кишечника; при некробактериозе — некротические фокусы паренхиматозных органов; при столбняке — кусочки тканей из глубоких слоев пораженных участков, гной (при наличии) и раневой секрет; при эмкаре и злокачественном отеке — кусочки пораженных мышц, лимфатические узлы, селезенку, кусочек печени и отечные ткани; при брадзоте овец — инфильтрированные ткани, подкожной клетчатки, кровь из сердца, слизистые оболочки сычуга и тонкого отдела кишечника. Материал заворачивают в целлофан или пергаментную бумагу, а жидкость (кровь, содержимое желудка и кишечника) помещают во флаконы, плотно закрывают резиновыми пробками и заливают сургучом. Кровь разрешается запаивать в пипетки.
Методы обнаружения анаэробов
Диагноз на анаэробные инфекции ставят на основании бактериоскопии, посева материала
Диагноз на анаэробные инфекции ставят на основании бактериоскопии, посева материала
К анаэробам, представляющим большую опасность для людей и животных, относят Cl. botulinum и Сl. реrfringers.
Cl. botulinum — слабо подвижная палочка длиной 4—8 мкм и шириной 0,6—0,8 мкм, по Граму окрашивается положительно. Спора обычно располагается на конце палочки, в связи с чем споровые формы микроба имеют вид теннисной ракетки или короткой свечи с пламенем. Вегетативные формы Cl. botulinum инактивируются при 80°С течение 30 мин., а споры, не погибают при кипячении даже в течение 4—5 ч. Cl. botulinum относят к группе сапрофитных почвенных микробов, широко расространенных в природе. Различают шесть серотипов этого возбудителя (А, В, С, Е, D, F), которые обладают различной патогенностью по отношению к животным и человеку. Последние заболевают ботулизмом только при проникновении в их организм токсинов, накопившихся в продуктах и кормах.
Clostridium
botulinum
Clostridium
botulinum
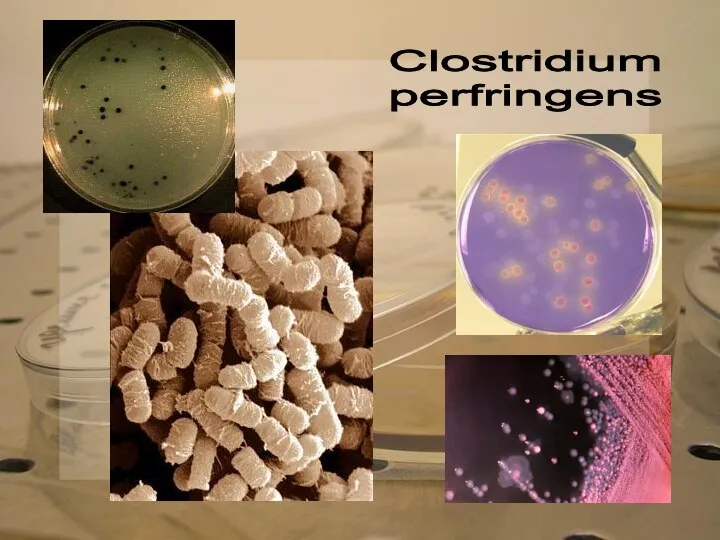
Cl. perfringens — короткая, спорообразующая, неподвижная, грамположительная палочка, анаэроб. Существуют
Cl. perfringens — короткая, спорообразующая, неподвижная, грамположительная палочка, анаэроб. Существуют
В отличие от ботулизма пищевые заболевания, связанные с заражением продуктов Cl. perfringens, по-видимому, следует отнести к токсикоинфекциям.
Для бактериоскопии готовят 2—5 мазков-отпечатков Из каждой присланной пробы и окрашивают по Граму Или метиленовой синью, а при необходимости — на споры или капсулы. При микроскопировании обращают внимание на форму, наличие спор и капсул и расположение отдельных микроорганизмов.
Для посева на питательные среды пробы обжигают и навеску массой около 10 г растирают в стерильной ступке с физиологическим раствором в соотношении 1 : 2.
По 3—5 мл приготовленной взвеси засевают в четыре большие пробирки с мясной средой типа Тароцци, залитой слоем вазелинового масла толщиной 0,5 см, предварительно прогретой в кипящей водяной бане в течение 20—30 мин., а затем быстро охлажденной до температуры не ниже 50 °С. Посевы перед термостатированием прогревают при температуре 80°С в течение 20 мин. (две пробирки); при исследовании на Cl. botulinum типа Е одну пробирку прогревают при температуре 60 °С в течение 15 мин. (при этом сохраняются споры Cl. botulinum E), а другую при 80 °С в течение 20 мин. Остальные пробирки оставляют непрогретыми.
При подозрении на Cl. botulinum для выявления типа Е пробирки
При подозрении на Cl. botulinum для выявления типа Е пробирки
Другие пробирки (непрогретую и прогретую при 80 °С) инкубируют при температуре 37 °С для выявления остальных анаэробов.
Термостатирование проводят в течение 5—10 сут.; наблюдают за ростом ежедневно. При обнаружении роста осуществляют микроскопическое исследование.
Для биологической пробы можно использовать присланный материал, а также чистую культуру. При подозрении на ботулизм биопробу ставят на белых мышах (реакция нейтрализации токсина противоботулинической сывороткой). Для этого исходный материал растирают в ступке со стерильным физиологическим раствором в соотношении 1 :2, для экстрагирования токсина выдерживают 1 —1,5 ч при комнатной температуре, а затем фильтруют через ватно-марлевый фильтр или центрифугируют при 3000 об/мин в течение 15—20 мин.
Далее проводят реакцию нейтрализации токсина; к 0,5—0,8 мл фильтрата (центрифугата) добавляют 0,24 мл смеси диагностических, моновалентных, противоботулинических сывороток типа А, В, С, D, E, F (по 0,04 мл каждого типа).
Двум мышам вводят внутривенно или внутрибрюшинно по 0,5—0,8 мл исследуемого фильтрата. Центрифугат вводят в такой же дозе только внутривенно. Другим двум мышам вводят смесь фильтрата (центрифугата) и сыворотки, где токсин находится в нейтрализованном состоянии (контроль).
Аналогичный эксперимент можно провести с 6—7-месячной культурой, выращенной на печеночном
Аналогичный эксперимент можно провести с 6—7-месячной культурой, выращенной на печеночном
Если при введении необработанного противоботулинической сывороткой фильтрата мыши погибли, биопроба считается положительной, то есть в исследуемом материале имеется токсин. Мыши, которым вводили смесь фильтрата (центрифугата) с сывороткой, выживают.
В случае гибели всех четырех мышей повторяют реакцию нейтрализации токсина в фильтрате (центрифугате) в разведении в 5, 10, 20 и более раз и вновь ставят биопробу.
При обнаружении в присланных пробах ботулинического токсина сразу же ставят развернутую реакцию нейтрализации с типоспецифическими диагностическими сыворотками для определения типа токсина.
При подозрении на энтеротоксемию овец и дизентерию ягнят взвесь в дозе 0,5—1 мл вводят внутримышечно кроликам или морским свинкам (гибель в течение суток); при подозрении на некробактериоз заражают подкожно кролика в область уха или мышь в область живота (появляются некрозы); при подозрении на столбняк — вводят подкожно фильтрат из культуры в дозе 0,5—0,8 мл белым мышам в область корня хвоста (погибают на третьи-четвертые сутки); при подозрении на эмкар — заражают внутримышечно взвесью в дозе 0,5—1 мл морскую свинку (погибает через 16—96 ч.); при подозрении на злокачественный отек — вводят внутримышечно взвесь. в дозе 1 мл морской свинке или мышке (погибают через 12—24 ч.); при подозрении на брадзот овец заражают взвесью подкожно или внутримышечно морскую свинку в дозе 1 мл (погибает через одни-двое суток).
Clostridium
perfringens
Clostridium
perfringens
Микобактерии — это микроорганизмы, обладающие способностью при культивировании на питательных
Микобактерии — это микроорганизмы, обладающие способностью при культивировании на питательных
Патогенные микобактерии — возбудители ряда инфекционных заболеваний животных и человека. Они вызывают туберкулез многих видов сельскохозяйственных животных, а также паратуберкулез крупного рогатого скота.
Обнаружение возбудителя туберкулеза. Существует пять видов микобактерий туберкулеза: М. tuberculosis, М. bovis, M. avium, M. murium, M. poykilothermorum. Сущность метода выявления этих микроорганизмов и их видовая типизация заключается в определении по мор фологии, скорости и характеру роста на питательных средах, по патогенности и другим свойствам. Микобактерии туберкулеза — тонкие, прямые или слегка изогнутые палочки с закругленными краями. Располагаются изолированно или группами. Спор и капсул не образуют, неподвижны, кислото- и спиртоустойчивы.
Ввиду гидрофобности оболочек грамокраску микобактерий проводят модифицированным методом (по Грам — Мухе). Вначале мазок окрашивают карболовым метилвиолетом с подогреванием до появления паров, затем Краску сливают, а мазок обрабатывают раствором Люголя с последующим обесцвечиванием поочередно 5%-ной азотной кислотой, 3 %-ной соляной кислотой и смесью ацетона и алкоголя. Дополнительно препарат окрашивают сафранином или разведенным фуксином. При микроскопии на красном фоне видны фиолетовые микобактерии.
Методы обнаружения микобактерий
В лаборатории из присланного материала (кусочки печени, селезенки, легких и
В лаборатории из присланного материала (кусочки печени, селезенки, легких и
Если в исследуемом материале туберкулезных микобактерий слишком мало, то прибегают к обогащению — центрифугированию или флотации. Для этого материал измельчают, растирают в ступке, заливают 1 %-ным раствором едкого натра, размешивают и переносят в колбу, которую встряхивают 10—15 мин. Затем содержимое центрифугируют 10 мин., надосадочную жидкость сливают, осадок нейтрализуют кислотой и из него делают мазки.
Метод флотации основан на адсорбции углеводородами (ксилолом, бензином, лигроином) микобактерий туберкулеза и всплывании последних вместе с ними. Этот метод применяют при исследовании молока и мокроты, реже — бронхиальной слизи, экссудата, суспензий из растертых органов и тканей.
Питательные среды для культивирования микобактерий делят на: глицериносодержащие (простые) и элективные (белковые и безбелковые). К первым относят глицериновый мясо-пептонный бульон и агар, а также глицериновый картофель. Ко вторым относят среды: Петраньяни, Гельберга, Левенштейна — Йенсена, а так же безбелковые среды: Сотона, Моделя и др.
Для получения культур микобактерий туберкулеза материал перед посевом обрабатывают по
Для получения культур микобактерий туберкулеза материал перед посевом обрабатывают по
На жидких питательных средах с глицерином рост микобактерий туберкулеза проявляется в виде пленки только через 30—30 сут., а иногда и позже.
На плотных питательных средах они образуют вначале едва заметные микроколонии, которые затем увеличиваются и приобретают различные размеры. Они могут быть мелкими, крупными, блестящими или матовыми, гладкими или шероховатыми. Располагаются колонии единично, однако может быть и сплошной рост.
Для биологического исследования используют тот же материал, который был приготовлен для посева на питательные среды, а серную кислоту, находящуюся в нем, необходимо нейтрализовать стерильным 10 %-ным раствором двууглекислой соды. Заражают кроликов, морских свинок, а при необходимости и кур. Биопроба наряду с бактериоскопическим, культуральным и биохимическим методами позволяет определить вид микобактерий туберкулеза.
Mycobacterium
tuberculosis
Mycobacterium
tuberculosis
Mycobacterium
bovis
Mycobacterium
bovis


















































 Эффективные методы по управлению персоналом Работу выполнил Студент группы 21 О Красюк С.И.
Эффективные методы по управлению персоналом Работу выполнил Студент группы 21 О Красюк С.И. Организационные структуры в проектах. Управление проектами
Организационные структуры в проектах. Управление проектами Информационные технологии в защите баз данных таможенных органов в свете вступления России в ВТО Студентка 2 курса Экономическо
Информационные технологии в защите баз данных таможенных органов в свете вступления России в ВТО Студентка 2 курса Экономическо Шрифты чертежные. Начертание строчных и прописных букв
Шрифты чертежные. Начертание строчных и прописных букв Гипотеза де-Бройля.Опыты по дифракции электронов
Гипотеза де-Бройля.Опыты по дифракции электронов Состояние международного миграционного движения Подготовил: Майстренко Денис Козлов Артур Группа Т-115
Состояние международного миграционного движения Подготовил: Майстренко Денис Козлов Артур Группа Т-115 Презентация Место и роль трудового права в системе Российской системы права
Презентация Место и роль трудового права в системе Российской системы права Политический режим. Всеобщий контроль за жизнью общества
Политический режим. Всеобщий контроль за жизнью общества Национальные праздники и традиции Беларуси
Национальные праздники и традиции Беларуси Фестиваль практики 2010
Фестиваль практики 2010 Настройка интернета
Настройка интернета г.Днепропетровск, 2007
г.Днепропетровск, 2007  Условные обозначения наиболее часто встречающихся элементов электрических схем электронных устройств
Условные обозначения наиболее часто встречающихся элементов электрических схем электронных устройств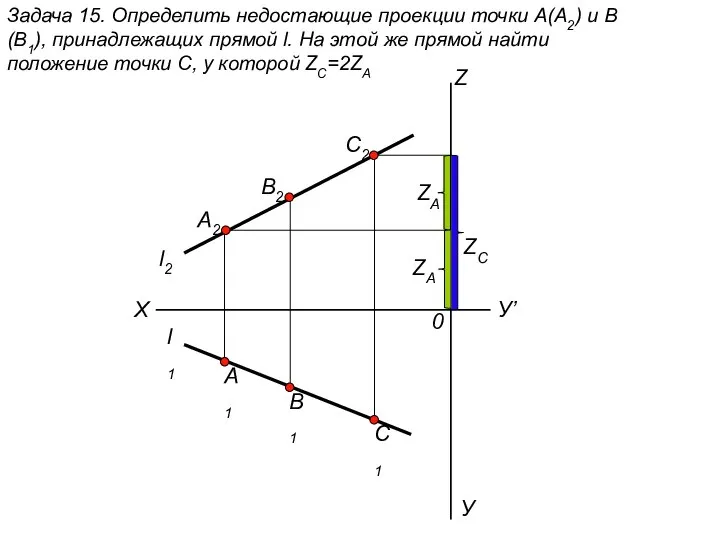 Определить недостающие проекции точки А(А2) и В(В1). (задача 15)
Определить недостающие проекции точки А(А2) и В(В1). (задача 15) Система подготовки спортсмена
Система подготовки спортсмена Биохимические закономерности адаптации к мышечной работе
Биохимические закономерности адаптации к мышечной работе Опухоли почки
Опухоли почки Особенности и специфика религиозно-политического экстремизма
Особенности и специфика религиозно-политического экстремизма Безопасность детей в интернете
Безопасность детей в интернете Влияние физических нагрузок на сердечно - сосудистую систему
Влияние физических нагрузок на сердечно - сосудистую систему Общие условия главного судебного разбирательства
Общие условия главного судебного разбирательства Культура в меняющемся мире. (9, 11 класс)
Культура в меняющемся мире. (9, 11 класс) Всемирная паутина. Электронная почта
Всемирная паутина. Электронная почта КАДРЫ ПРЕДПРИЯТИЯ
КАДРЫ ПРЕДПРИЯТИЯ 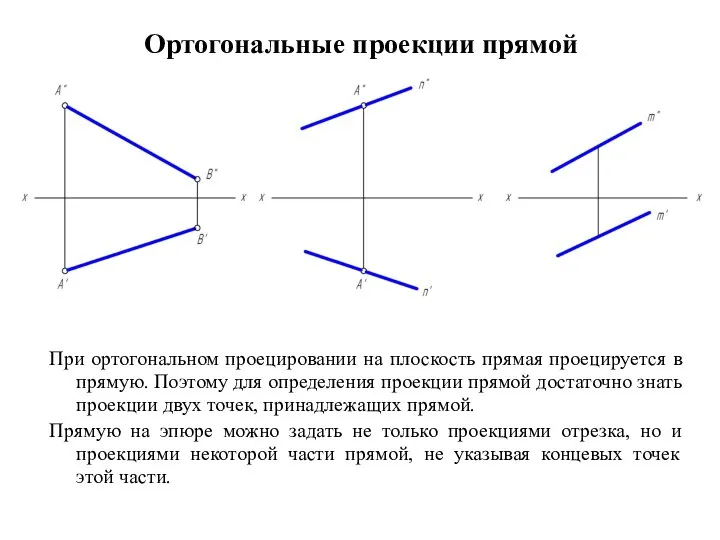 Ортогональные проекции прямой
Ортогональные проекции прямой Государственное устройство и его формы
Государственное устройство и его формы Плоские железобетонные перекрытия (монолитное перекрытие)
Плоские железобетонные перекрытия (монолитное перекрытие) Презентация "Стилевое многообразие искусства XVII-XVIII веков" - скачать презентации по МХК
Презентация "Стилевое многообразие искусства XVII-XVIII веков" - скачать презентации по МХК