Содержание
- 2. Трансляция Это синтез белка на рибосомах. Матрицей является и РНК. Продукт трансляции – полипептидная цепь (первичная
- 3. Посттрансляционная модификация (ПТМ) Это и есть созревание белка после трансляции. В ходе ПТМ происходит внедрение в
- 4. Как правило, в ходе посттрансляционной модификации происходит частичное ОКИСЛЕНИЕ определенных аминокислот Часто к белку присоединяются углеводные
- 5. Условия успешной трансляции 1. Наличие в клетке малых и больших субъединиц рибосом 2. Поступление в цитоплазму
- 6. Закон «все или ничего» Если в клетке отсутствует хотя бы 1 незаменимая аминокислота, трансляция обрывается. Поэтому
- 7. Основные этапы трансляции 1. Инициация синтеза полипептидной цепи 2. Элонгация полипептидной цепи 3. Терминация синтеза полипептидной
- 8. Инициация трансляции Малая и большая субъединицы рибосомы в присутствии иона магния с затратой АТФ садятся на
- 9. Рибосома на этапе инициации
- 10. Элонгация Происходит удлинение полипептидной цепи на 1 аминокислоту, принесенную в рибосому новой молекулой тРНК За счет
- 11. Рибосома на этапе элонгации
- 12. Терминация В конце иРНК, перед полиаденилатным хвостом, всегда содержится «бессмысленный» кодон, не соответствующий ни одной тРНК.
- 13. Антибиотики и трансляция Многие «классические» антибиотики ингибируют один из этапов трансляции Поскольку рибосомы человека и бактерий
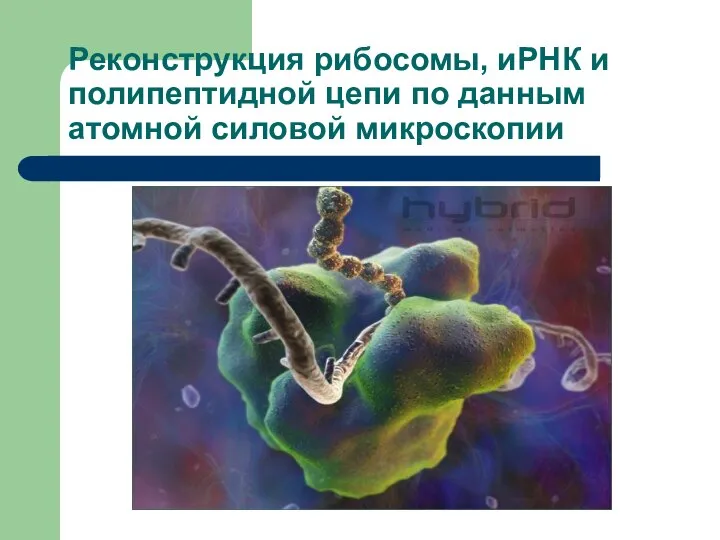
- 14. Реконструкция рибосомы, иРНК и полипептидной цепи по данным атомной силовой микроскопии
- 15. Примеры антибиотиков – ингибиторов трансляции
- 16. Коллаген и его роль Коллаген – структурный белок, один из наиболее распространенных белков организма. Имеет фибриллярную
- 17. Виды соединительной ткани (световая микроскопия)
- 18. Особенности аминокислотного состава коллагена (первичная структура) высокое содержание глицина отсутствие триптофана около 21 % аминокислот приходится
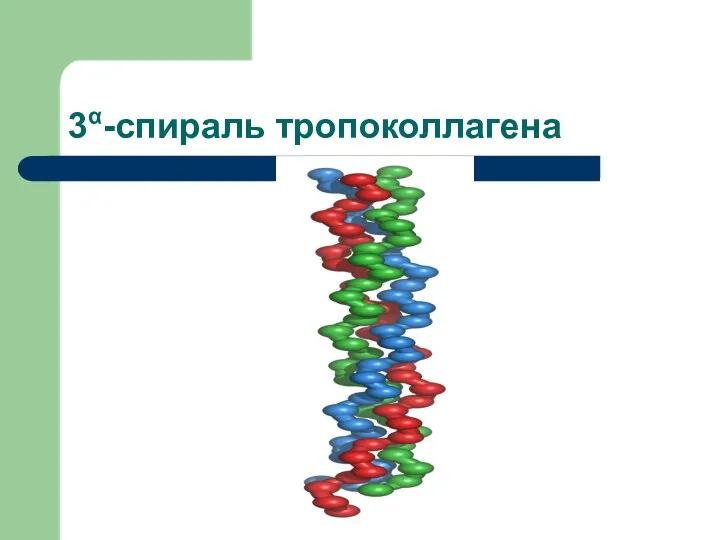
- 19. Вторичная структура β-складчатый лист (подобие «гармошки») 3 такие нити закручиваются в 3α-спираль Эта структура называется ТРОПОКОЛЛАГЕН
- 20. 3α-спираль тропоколлагена
- 21. Свойства тропоколлагена Это незрелый коллаген Легко вымывается водой Формирует фибриллу коллагена в присутствии ионов кальция
- 22. Основные этапы созревания коллагена (ПТМ) 1. Отщепление сигнальных пептидов от первичной последовательности 2. Гидроксилирование остатков пролина
- 24. После гликозилирования тропоколлаген становится высокоантигенным белком, уникальным для каждого человека Одна из причин отторжения органов после
- 25. Формирование коллагеновой фибриллы Коллагеновая фибрилла — это полукристаллическая структурная единица коллагена Состоит из молекул тропоколлагена, прикрепленных
- 26. Формирование коллагеновой фибриллы В фибриллах молекулы тропоколлагена смещены относительно друг друга примерно на 67нм (единица, которая
- 27. Формирование коллагеновой фибриллы Для правильной укладки молекул тропоколлагена нужны ионы кальция При дефиците кальция тропоколлаген укладывается
- 28. Коллагеновые фибриллы в электронном микроскопе
- 29. Взаимодействие молекул тропоколлагена при формировании фибриллы
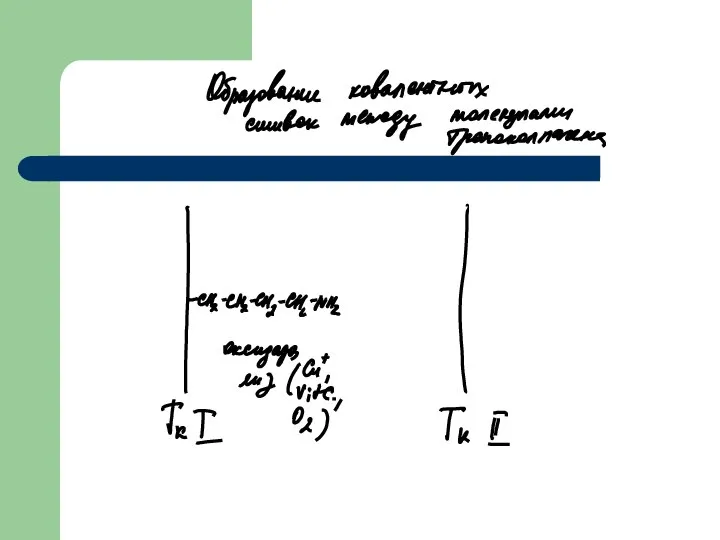
- 30. Придание коллагену прочностных свойств Внутри тропоколлагенов существует ковалентная связь между цепями Эти связи формируются между остатками
- 31. Нарушения синтеза коллагена Врожденные аномалии (дефицит гидроксилаз пролина и лизина) – синдром Эллерса-Данлоса Приобретенные аномалии –
- 32. Стоматологические проявления Ослабление связок зуба Расшатывание и самопроизвольное выпадение зубов Деструкция десневой ткани Разрушение тканей височно-нижнечелюстного
- 34. Основные типы коллагенов в организме человека (всего 28 видов) I тип Повсеместно в мягких и твердых
- 36. II тип Хрящи, стекловидное тело, межпозвоночные диски Ранний остеохондроз, ахондрогенез, высокая степень миопии (близорукости)
- 37. III тип Мягкие ткани и полые органы Синдром Элерса-Данлоса, фиброзно- мышечная дисплазия, аневризма аорты, варикозная болезнь
- 38. IV тип Базальные мембраны в легких, почках и др. органах Синдром Альпорта, синдром Гудпасчера (нарушение транспорта
- 40. Скачать презентацию


































 Позитивизм
Позитивизм  Виклики, практики та стратегія реалізації реформ у регіонах
Виклики, практики та стратегія реалізації реформ у регіонах Маркетинг - promotion ( продвижение) 2
Маркетинг - promotion ( продвижение) 2 Понятия культуры и цивилизации. Виды и функции культуры
Понятия культуры и цивилизации. Виды и функции культуры России славные сыны…
России славные сыны… Цикл передачи системы ИКМ-30
Цикл передачи системы ИКМ-30 Узкополосный случайный процесс
Узкополосный случайный процесс Әмирхан Еники. Тормыш юлы һәм иҗаты
Әмирхан Еники. Тормыш юлы һәм иҗаты ВКР: Ручное изготовление изделия из группы сервировки стола с использованием традиционных материалов
ВКР: Ручное изготовление изделия из группы сервировки стола с использованием традиционных материалов Одежда говорит о человеке. 5 класс
Одежда говорит о человеке. 5 класс Дух предпринимательства преобразует экономику Д/З: § 4, читать, вопросы 1,2,5, пересказ
Дух предпринимательства преобразует экономику Д/З: § 4, читать, вопросы 1,2,5, пересказ Показатели радиоприемных устройств
Показатели радиоприемных устройств Grammaire Production orale Vidéo d’une expérience de voyage. Leçon 9
Grammaire Production orale Vidéo d’une expérience de voyage. Leçon 9 Презентация "Бюджет Российской Федерации" - скачать презентации по Экономике
Презентация "Бюджет Российской Федерации" - скачать презентации по Экономике 3. Essential Java Classes 5. Some Useful Classes
3. Essential Java Classes 5. Some Useful Classes Китай
Китай Бизнес-идея. Шаблон
Бизнес-идея. Шаблон Расчет тягово-динамический автобуса пригородного 5 класса с выполнением реальной части
Расчет тягово-динамический автобуса пригородного 5 класса с выполнением реальной части ФИЗОЛОГИЯ СТАРЕНИЯ Возрастная периодизация Общая характеристика процесса старения Изменения в органах и системах
ФИЗОЛОГИЯ СТАРЕНИЯ Возрастная периодизация Общая характеристика процесса старения Изменения в органах и системах  Java. Переменные и значения. (Лекция1)
Java. Переменные и значения. (Лекция1) Эффект изменения диаметра детали
Эффект изменения диаметра детали Тканевой обмен
Тканевой обмен Картина мира, созданная языком и культурой
Картина мира, созданная языком и культурой ТЕМА: Гнойная инфекция в хирургии Лекции для студентов III курса Кафедра общей хирургии составитель д.м.н., профессор Пушкаре
ТЕМА: Гнойная инфекция в хирургии Лекции для студентов III курса Кафедра общей хирургии составитель д.м.н., профессор Пушкаре Распорные сплошные ДК. Арки и рамы
Распорные сплошные ДК. Арки и рамы Энтропия
Энтропия Образование напряжений, деформаций и перемещений в сварных конструкциях. Лекция № 6
Образование напряжений, деформаций и перемещений в сварных конструкциях. Лекция № 6 Организация и содержание физминутки на уроке
Организация и содержание физминутки на уроке