Содержание
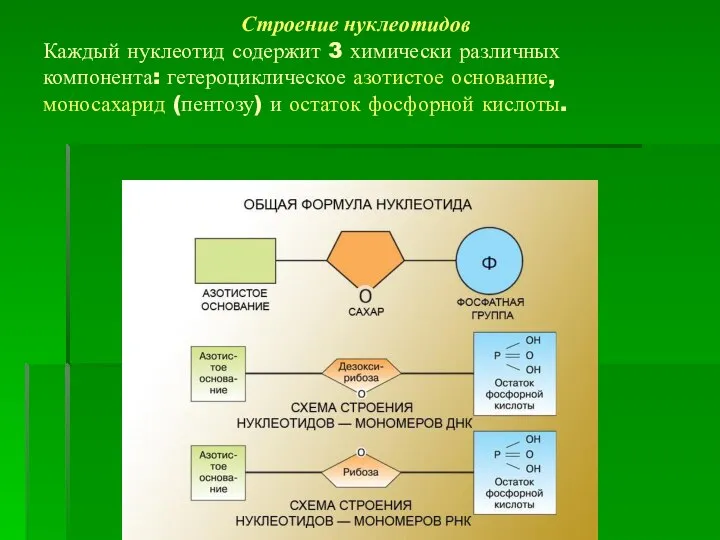
- 2. Строение нуклеотидов Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток
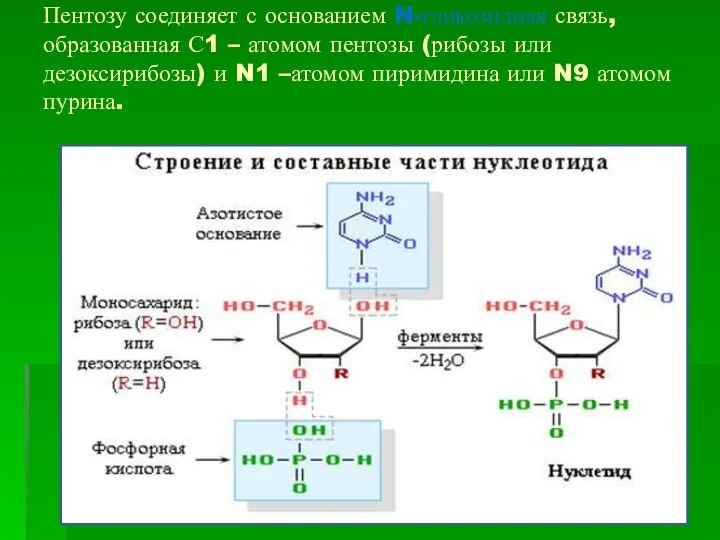
- 4. Пентозу соединяет с основанием N-гликозидная связь, образованная С1 – атомом пентозы (рибозы или дезоксирибозы) и N1
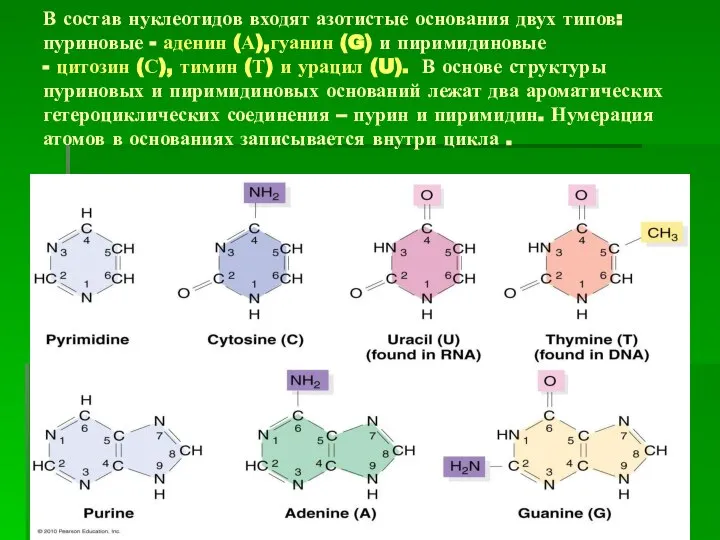
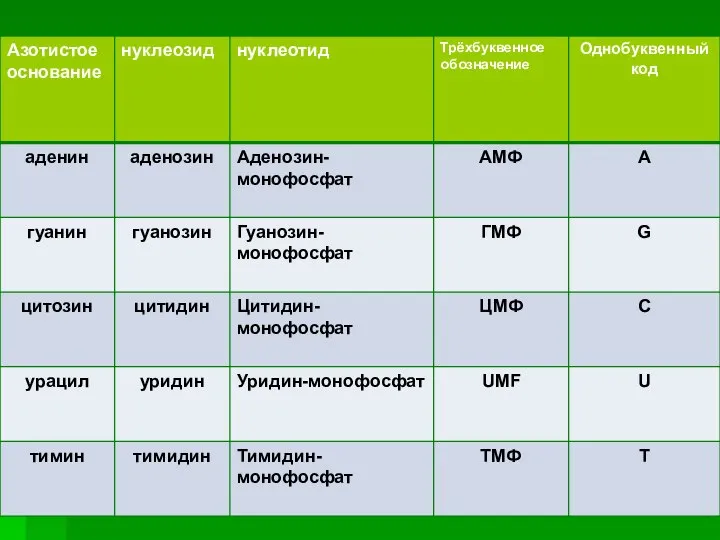
- 5. В состав нуклеотидов входят азотистые основания двух типов: пуриновые - аденин (А),гуанин (G) и пиримидиновые -
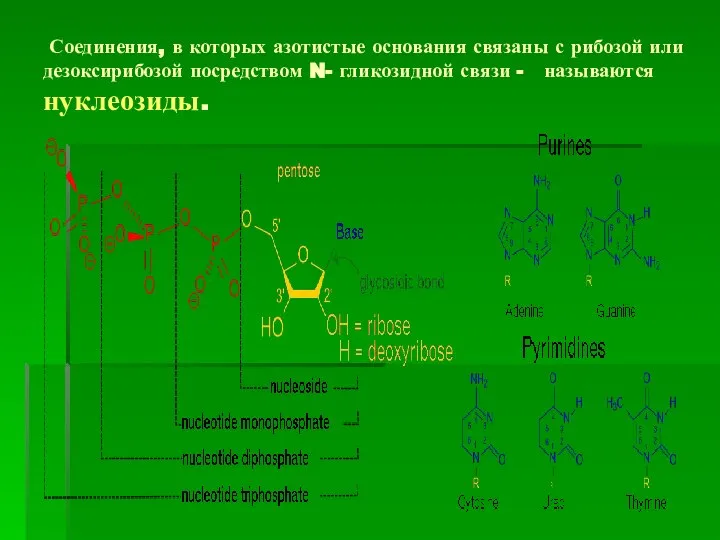
- 6. Соединения, в которых азотистые основания связаны с рибозой или дезоксирибозой посредством N- гликозидной связи - называются
- 8. В организме нуклеотиды и их производные выполняют многообразные функции. 1. Рибонуклеозид- и дезоксирибонуклеозид-фосфаты являются субстратами в
- 9. 3. Производные нуклеотидов участвуют в синтезе гомо- и гетерополисахаридов, липидов и белков. УДФ-глюкоза, УДФ-галактоза, ГДФ-манноза принимают
- 10. 4. АМФ входит в состав коферментов дегидрогеназ (NAD+, NADP+, FAD, FMN) и кофермента (HS-КоА). 5. цАМФ
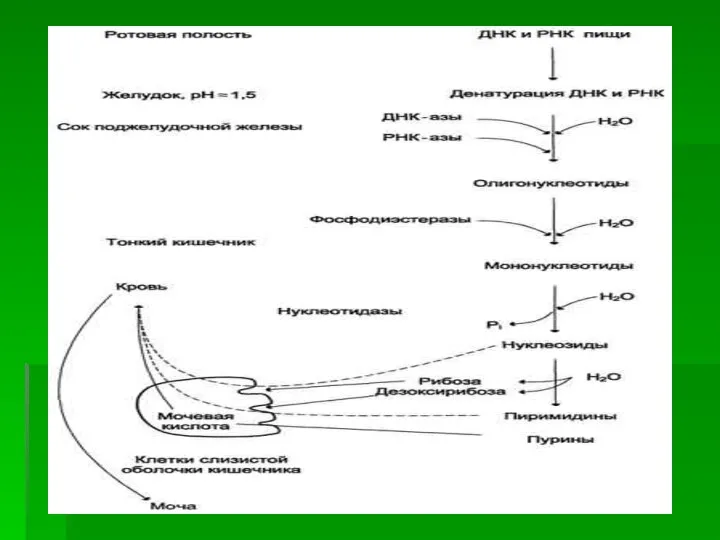
- 11. ПЕРЕВАРИВАНИЕ НУКЛЕИНОВЫХ КИСЛОТ ПИЩИ В ЖКТ Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый
- 12. В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы
- 14. В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую часть пуринов, поступающих в клетки, превращает
- 15. СИНТЕЗ ПУРИНОВЫХ НУКЛЕОТИДОВ В 40-50-х годах XX столетия опытами с мечеными изотопами удалось выяснить происхождение атомов
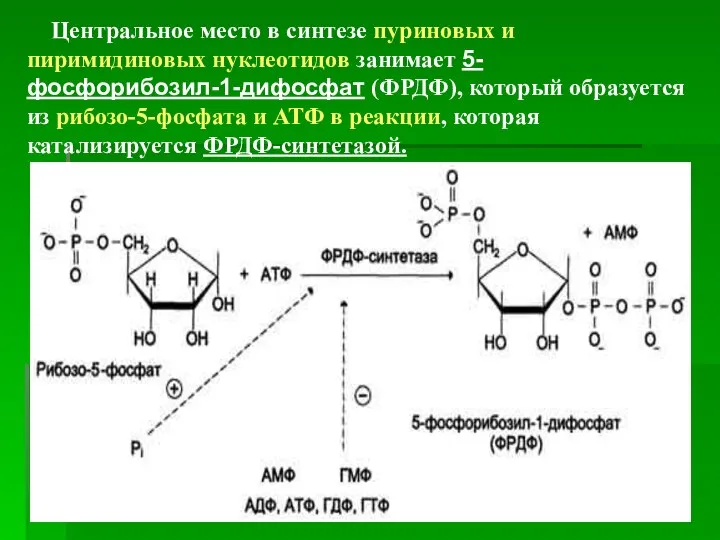
- 16. Центральное место в синтезе пуриновых и пиримидиновых нуклеотидов занимает 5-фосфорибозил-1-дифосфат (ФРДФ), который образуется из рибозо-5-фосфата и
- 17. Источниками рибозо-5-фосфата могут быть: пентозофосфатный путь превращения глюкозы и катаболизм нуклеозидов, в ходе которого под действием
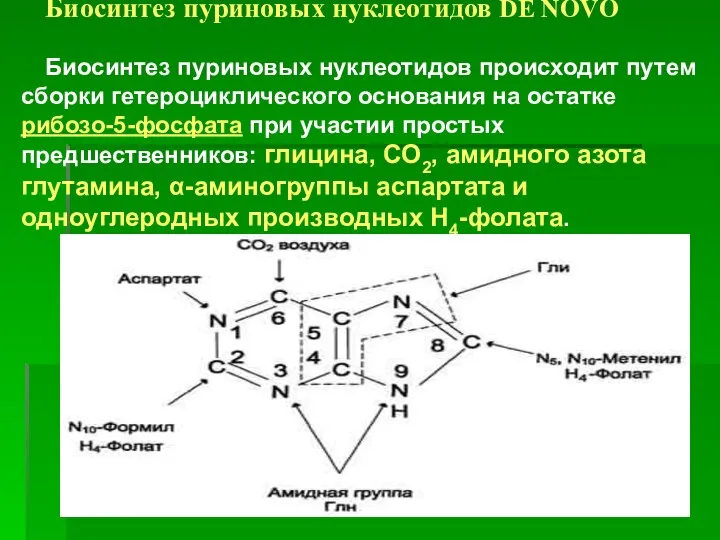
- 18. Биосинтез пуриновых нуклеотидов DE NOVO Биосинтез пуриновых нуклеотидов происходит путем сборки гетероциклического основания на остатке рибозо-5-фосфата
- 19. Первая специфическая реакция образования пуриновых нуклеотидов - перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1
- 20. Результатом этой 10 стадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ), на синтез
- 21. Синтез АМФ и ГМФ из ИМФ АМФ синтезируется при участии аденилосукцинат-синтетазы и аденилосукциназы, ГМФ - при
- 22. Второй пуриновый нуклеотид (ГМФ) образуется также в 2 стадии. Сначала ИМФ окисляется NAD+-зависимой ИМФ-дегидрогеназой с образованием
- 23. При образовании пуриновых нуклеотидов ГТФ расходуется на синтез АМФ, а АТФ - на синтез ГМФ. !!!
- 24. В образовании нуклеиновых кислот, коферментов и во многих синтетических процессах нуклеотиды используются в виде ди -
- 25. Аденилаткиназа активна в печени и мышцах. Функция этого фермента заключается в том, чтобы поддерживать в тканях
- 26. "Запасные" пути синтеза пуриновых нуклеотидов
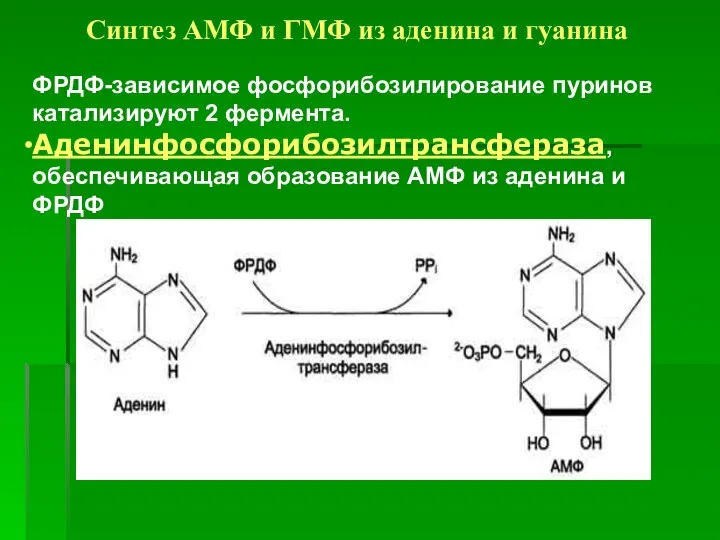
- 27. Синтез АМФ и ГМФ из аденина и гуанина ФРДФ-зависимое фосфорибозилирование пуринов катализируют 2 фермента. Аденинфосфорибозилтрансфераза, обеспечивающая
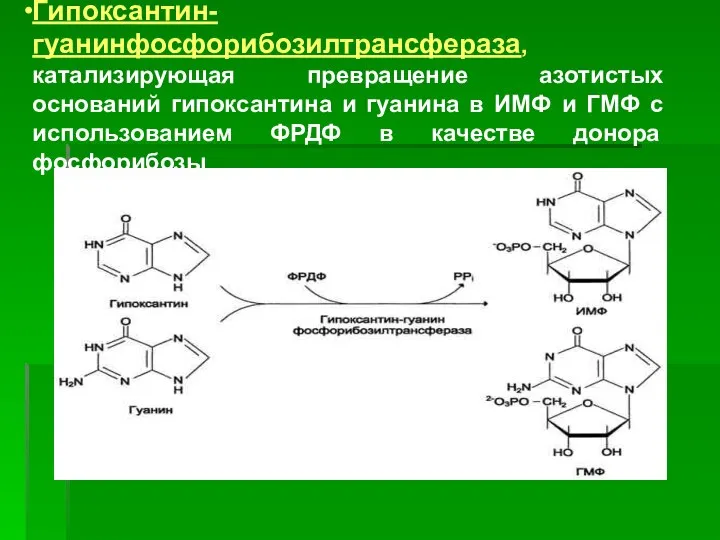
- 28. Гипоксантин-гуанинфосфорибозилтрансфераза, катализирующая превращение азотистых оснований гипоксантина и гуанина в ИМФ и ГМФ с использованием ФРДФ в
- 29. Нуклеозидкиназы Нуклеозиды, получающиеся при катаболизме нуклеиновых кислот из нуклеотидов под действием нуклеотидаз, могут повторно фосфорилироваться, образуя
- 30. Из всех способов реутилизации пуринов наиболее активна гипоксантингуанинфосфорибозилтрансферазная реакция, поскольку ИМФ, образующийся в этой реакции, вовлекается
- 31. Регуляция синтеза пуриновых нуклеотидов осуществляется аллостерически. Регуляторными ферментами являются: ФРДФ-синтаза Амидофосфорибозилтрансфераза ИМФ-дегидрогеназа Аденилосукцинатсинтетаза
- 32. АМФ, ГМФ И ИМФ ингибируют ключевые реакции своего синтеза. ФРДФ синтетаза и амидофосфорибозил-трансфераза – ингибируются при
- 33. КАТАБОЛИЗМ ПУРИНОВЫХ НУКЛЕОТИДОВ
- 34. У человека основной продукт катаболизма пуриновых нуклеотидов - мочевая кислота. Её образование идёт путём гидролитического отщепления
- 35. От АМФ и аденозина аминогруппа удаляется гидролитически аденозиндезаминазой с образованием ИМФ или инозина. ИМФ и ГМФ
- 36. Пуриннуклеозидфосфорилаза катализирует расщепление N-гликозидной связи в инозине и гуанозине с образованием рибозо-1-фосфата и азотистых оснований: гуанина
- 37. Ксантиноксидаза - аэробная оксидоредуктаза, кофакторы - ион молибдена, железа (Fe3+ ) и FAD. Фермент обнаруживается в
- 39. НАРУШЕНИЯ ОБМЕНА ПУРИНОВЫХ НУКЛЕОТИДОВ
- 40. Когда в плазме крови концентрация мочевой кислоты превышает норму, то возникает гиперурикемия. Вследствие гиперурикемии может развиться
- 41. Поскольку лейкоциты фагоцитируют кристаллы уратов, то причиной воспаления является разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты.
- 42. При подагре без образования подагрических узлов, в которых накапливаются ураты натрия и мочевая кислота, количество уратов
- 43. В ряде случаев причиной избыточной экскреции пуринов с мочой и подагры являются нарушения в работе ферментов.
- 44. Синдром Лёша-Нихена - тяжёлая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой, и проявляется
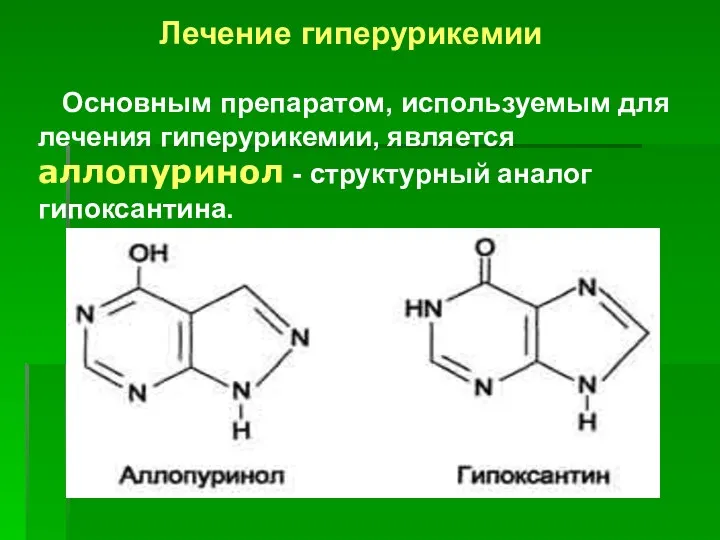
- 45. Лечение гиперурикемии Основным препаратом, используемым для лечения гиперурикемии, является аллопуринол - структурный аналог гипоксантина.
- 46. Аллопуринол ингибирует ксантиноксидазу и останавливает катаболизм пуринов на стадии образования гипоксантина, растворимость которого почти в 10
- 47. БИОСИНТЕЗ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
- 48. Образование пиримидиновых нуклеотидов DE NOVO Пиримидиновое кольцо синтезируется из простых предшественников: глутамина, СО2 и аспарагиновой кислоты
- 49. Образование дигидрооротата У млекопитающих ключевой, регуляторной реакцией является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в
- 50. Карбамоилфосфат является продуктом полифункционального фермента, который наряду с активностью КФС II содержит каталитические центры аспартаттранскарбамоилазы и
- 51. Объединение первых трёх ферментов в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции
- 52. Образование УМФ В цитозоле оротат становится субстратом бифункционального фермента - УМФ-синтазы, которая обнаруживает оротатфосфорибозил-трансферазную и ОМФ-декарбоксилазную
- 53. Биосинтез УДФ, УТФ и цитидиловых нуклеотидов УМФ под действием специфических нуклеозидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ
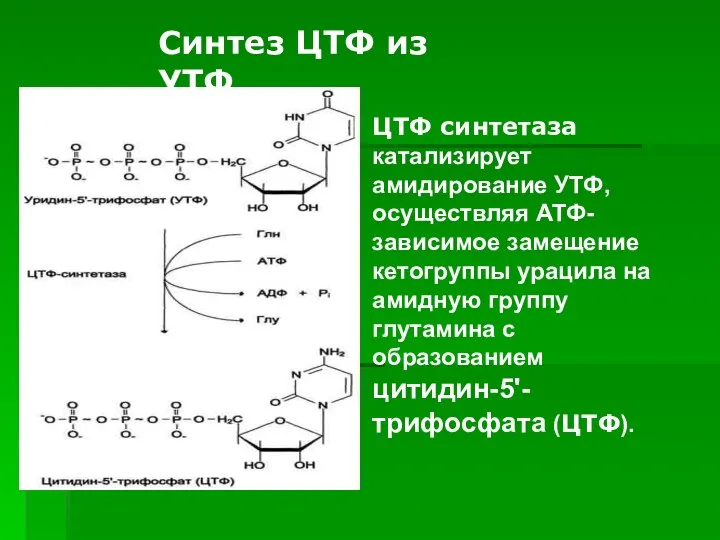
- 54. ЦТФ синтетаза катализирует амидирование УТФ, осуществляя АТФ-зависимое замещение кетогруппы урацила на амидную группу глутамина с образованием
- 55. ). "Запасные" пути синтеза пиримидиновых нуклеотидов Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму
- 56. ). ). Превращение нуклеозидов в нуклеотиды катализирует уридинцитидинкиназа. Часть ЦМФ может превращаться в УМФ под действием
- 57. ). Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является КАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а
- 58. ). Активность регуляторных ферментов синтеза пиримидиновых нуклеотидов контролируется аллостерически по механизму отрицательной обратной связи. УТФ ингибирует
- 59. ). ). КАД-фермент катализирует реакции 1, 2, 3; дигидрооротатдегидрогеназа - реакцию 4; УМФ синтетаза - реакции
- 60. ). КАТАБОЛИЗМ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ Цитидиловые нуклеотиды могут гидролитически терять аминогруппу и превращаться в УМФ. От УМФ
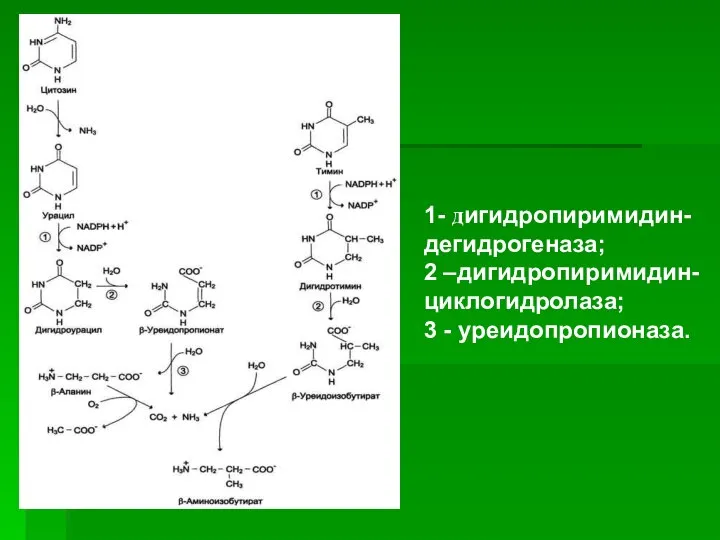
- 61. ). Оба гетероцикла могут взаимодействовать с водой в реакции, катализируемой дигидропиримидинциклогидролазой, и дигидроурацил превращается в β-уреидопропионовую
- 62. ). ). 1- дигидропиримидин-дегидрогеназа; 2 –дигидропиримидин-циклогидролаза; 3 - уреидопропионаза.
- 63. ). ). β-Аланин обнаруживают в плазме крови и многих тканях. Он используется в мышцах на образование
- 64. ). НАРУШЕНИЯ ОБМЕНА ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ Оротацидурия - вызвано дефектом в работе второго бифункционального фермента синтеза нуклеотидов
- 65. ). ). Это единственное нарушение, которое вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ.
- 66. ). Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления
- 67. ). Кроме генетически обусловленных причин, оротацидурия может наблюдаться: при гипераммониемии, вызванной дефектом любого из ферментов орнитинового
- 68. ). БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ Синтез дезоксирибонуклеотидов идёт с заметной скоростью только в тех клетках, которые вступают в
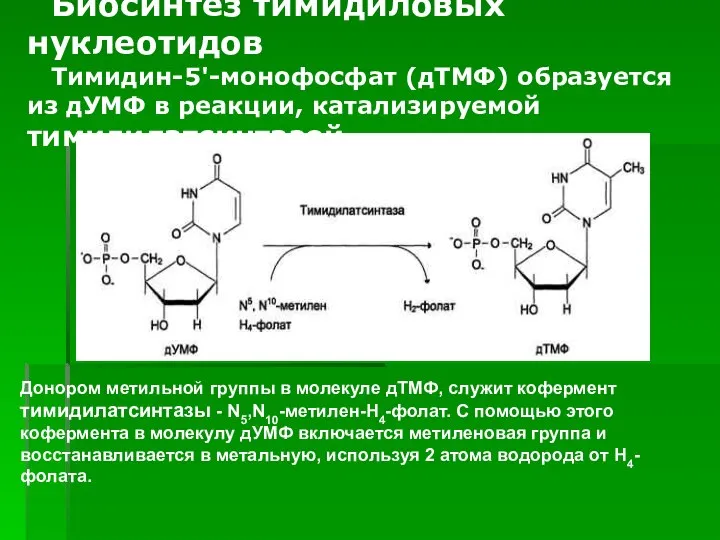
- 69. ). Биосинтез тимидиловых нуклеотидов Тимидин-5'-монофосфат (дТМФ) образуется из дУМФ в реакции, катализируемой тимидилатсинтазой. Донором метильной группы
- 71. Скачать презентацию






















































 Связь теории государства и права с политологией
Связь теории государства и права с политологией Женская стрижка «Боб»
Женская стрижка «Боб» Андрей Николаев Художник, иллюстрирующий всемирно известное произведение литературы, должен быть готов умереть в писателе.
Андрей Николаев Художник, иллюстрирующий всемирно известное произведение литературы, должен быть готов умереть в писателе. Презентация Содержание финансовой политики, ее цели и задачи ФИНАНСЫ
Презентация Содержание финансовой политики, ее цели и задачи ФИНАНСЫ Экономическое развитие России в начале XX века
Экономическое развитие России в начале XX века Презентация "МАРКЕТИНГОВОЕ ИССЛЕДОВАНИЕ" - скачать презентации по Экономике
Презентация "МАРКЕТИНГОВОЕ ИССЛЕДОВАНИЕ" - скачать презентации по Экономике Язык С++. Прикладное программирование
Язык С++. Прикладное программирование Всемирный почтовый союз Подготовили: Студентки 5-го курса Группы ДС 02.2 Зайцева Виктория, Шевченко Наталья
Всемирный почтовый союз Подготовили: Студентки 5-го курса Группы ДС 02.2 Зайцева Виктория, Шевченко Наталья Презентация "Контекстная реклама в Google AdWords" - скачать презентации по Экономике
Презентация "Контекстная реклама в Google AdWords" - скачать презентации по Экономике Модели надежности ПС
Модели надежности ПС Машины переменного тока. Синхронные машины (СМ). Общие сведения. (Лекция 6)
Машины переменного тока. Синхронные машины (СМ). Общие сведения. (Лекция 6) Контроль і гарантія якості
Контроль і гарантія якості Теория возникновения мира по версиям различных религий
Теория возникновения мира по версиям различных религий Межгосударственные конфликты и попытки их решения
Межгосударственные конфликты и попытки их решения Культура Індії
Культура Індії Тема 8 Национальная экономика: результаты и измерения Вопросы: Мера экономического успеха в современных обществах Система
Тема 8 Национальная экономика: результаты и измерения Вопросы: Мера экономического успеха в современных обществах Система  Волны в прозрачных анизотропных средах
Волны в прозрачных анизотропных средах Социальная ответственность бизнеса и реформы социальной политики в современной России
Социальная ответственность бизнеса и реформы социальной политики в современной России  Таможенный устав СССР 1924г. Медведев В. Т-115
Таможенный устав СССР 1924г. Медведев В. Т-115 Устройства сверхвысоких частот и антенны. Типы антенн с плоским излучающим раскрывом. (Лекция 3)
Устройства сверхвысоких частот и антенны. Типы антенн с плоским излучающим раскрывом. (Лекция 3) Мейрамы наурыз
Мейрамы наурыз Рихард Густавович Зорге
Рихард Густавович Зорге Russian superstitions
Russian superstitions Математика "Как я провёл лето" 5 класс - презентация для начальной школы_
Математика "Как я провёл лето" 5 класс - презентация для начальной школы_ День семьи, любви и верности Тюменского муниципального района
День семьи, любви и верности Тюменского муниципального района Физиология крови-2
Физиология крови-2 Автоматизация производственных процессов в машиностроении. Тенденции развития средств автоматизации
Автоматизация производственных процессов в машиностроении. Тенденции развития средств автоматизации Проектирование, техническое перевооружение и реконструкция предприятия легкой промышленности
Проектирование, техническое перевооружение и реконструкция предприятия легкой промышленности