Содержание
- 2. Белки – незаменимые высокомолекулярные соединения в организме человека, они содержат азот и не могут быть синтезированы
- 3. Основные функции белков Структурная Каталитическая (ферментативная) Рецепторная Информационная Гуморальная Иммунологическая
- 4. Белок в организме не депонируется. При его дефиците мобилизуются белки мышц, кожи, костей, а при более
- 5. Азотистый баланс Интегральный показатель общего уровня белкового обмена — азотистый баланс: суточная разница между поступающим в
- 6. Азотистый баланс Нулевой азотистый баланс (количество поступающего и выводящегося азота совпадает). Положительный азотистый баланс (количество азота,
- 7. . По биологической ценности белки классифицируют как полноценные и неполноценные, что связано с количественным и качественным
- 8. Метионин обеспечивает дезинтоксикационные процессы, прежде всего по связыванию тяжелых металлов, эндогенных и экзогенных токсинов, а также
- 9. Триптофан необходим для производства витамина B3 (ниацина) и серотонина-важнейшего нейромедиатора, передающего нервные импульсы. Серотонин нормализует сон,
- 10. Заменимые аминокислоты Аланин нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота и
- 11. Глицин (аминоуксусная кислота) является центральным нейромедиатором тормозного типа действия, оказывает седативное действие, улучшает метаболические процессы в
- 12. Цистеин - серосодержащая аминокислота играет важную роль в процессах формирования тканей кожи. Имеет значение для дезинтоксикационных
- 13. Пути обмена белков в организме Переваривание и всасывание - белки лишаются своей видовой и тканевой специфичности
- 14. Промежуточный обмен аминокислот Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя
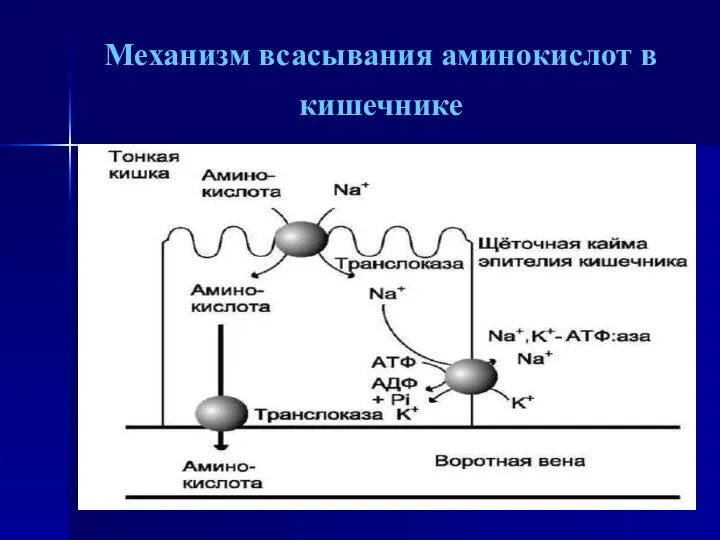
- 15. Механизм всасывания аминокислот в кишечнике
- 16. L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану
- 17. Различная скорость проникновения аминокислот через мембраны клеток указывает на наличие транспортньгх систем, обеспечивающих перенос аминокислот как
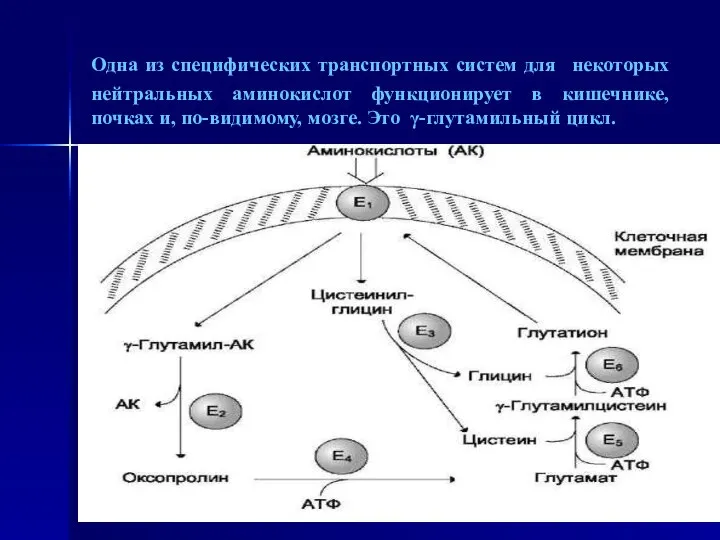
- 18. Одна из специфических транспортных систем для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге.
- 19. γ-Глутамильный цикл: Система состоит из одного мембранного и пяти цитоплазматических ферментов. Перенос аминокислоты внутрь клетки осуществляется
- 20. Аминокислоты как и белки не накапливаются и не запасаются в тканях Промежуточный обмен аминокислот – это
- 21. Общие пути обмена АК Трансаминирование(переаминирование) Прямое окислительное дезаминирование Непрямое окислительное дезаминирование Неокислительное дезаминирование Внутримолекулярное дезаминирование Декарбоксилирование
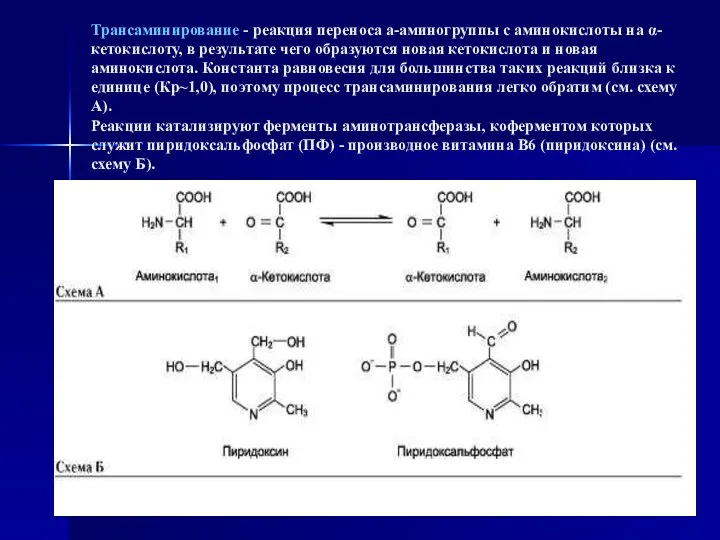
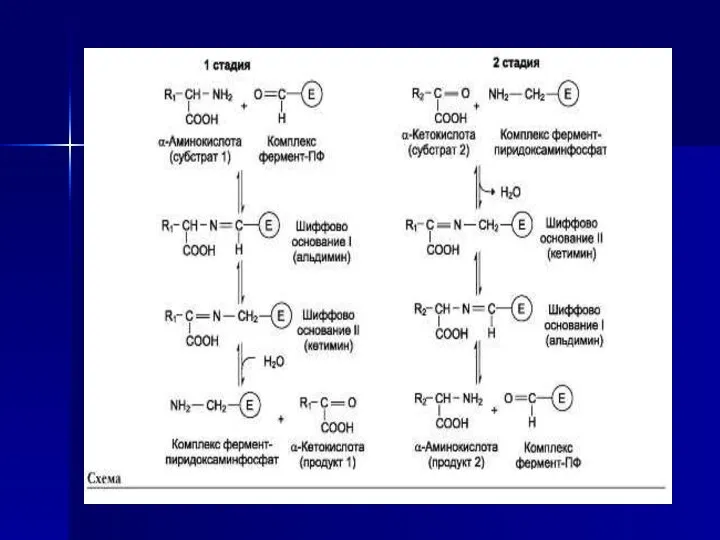
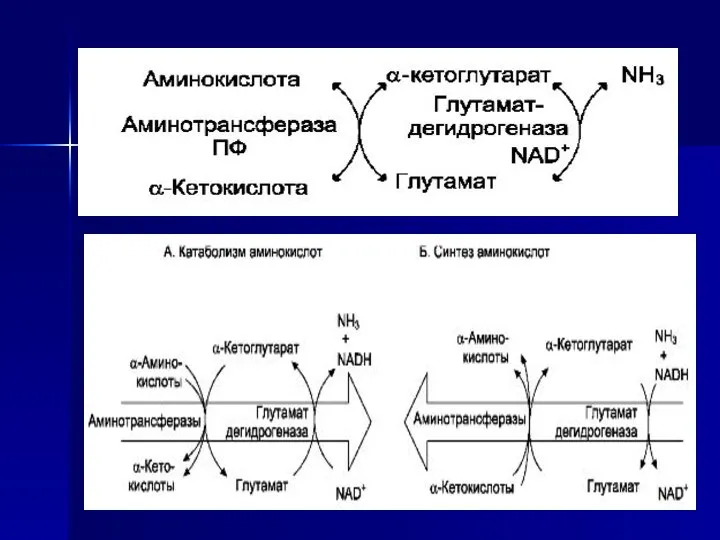
- 22. Трансаминирование - реакция переноса а-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и
- 23. Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариотов. Причём митохондриальные и цитоплазматические формы
- 24. Органоспецифичные аминотрансферазы АЛТ и АСТ Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях
- 26. Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее
- 27. АЛТ катализирует реакцию трансами-нирования между аланином и α-кетоглутаратом.Локализован этот фермент в цитозоле клеток многих органов, но
- 28. . Биологическое значение трансаминирования Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим,
- 29. Биологическое значение реакций трансаминирования 1. Синтез 10 заменимых АК 2. Первая стадия в реакции непрямого окислительного
- 30. Диагностическое значение определения аминотрансфераз в клинической практике В клинической практике широко используют определение активности АСТ и
- 31. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота
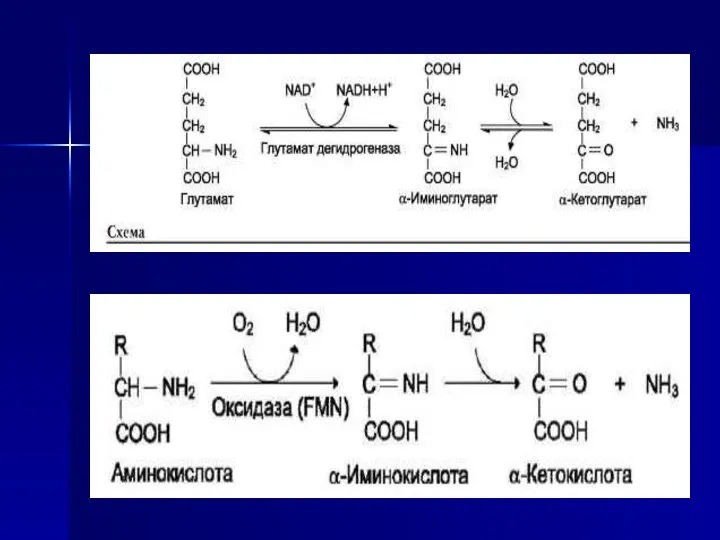
- 32. Окислительное дезаминирование Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы
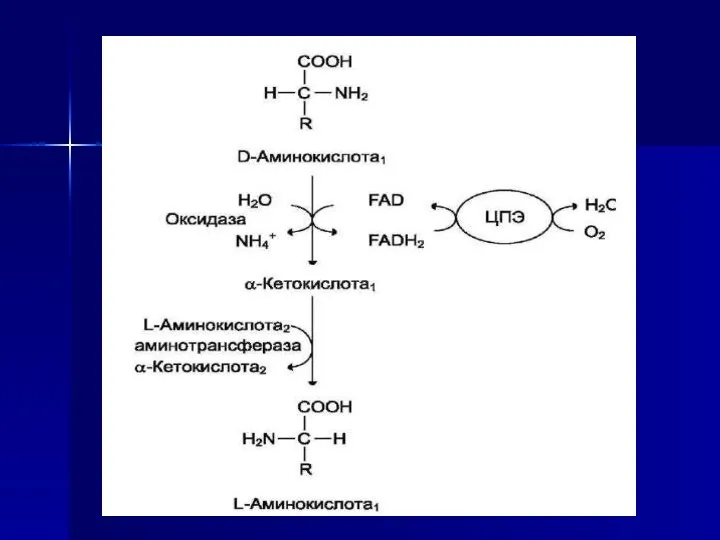
- 34. Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот
- 36. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на
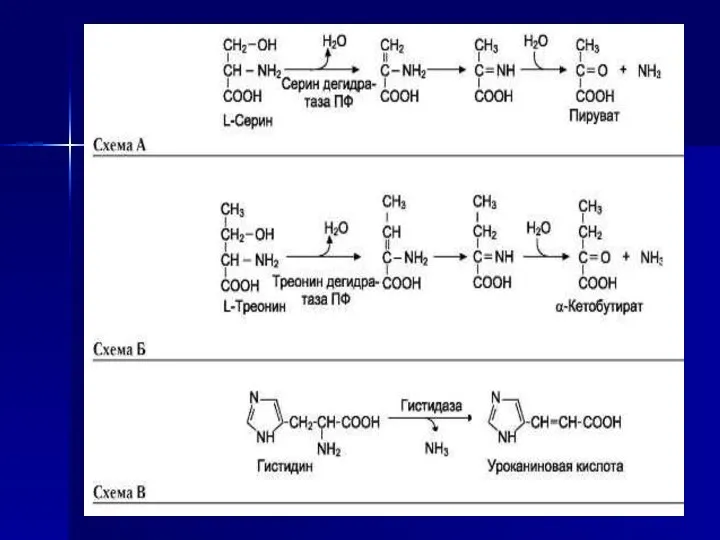
- 38. Неокислительное дезаминирование В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина
- 40. Пути обмена безазотистого остатка аминокислот В ходе катаболизма аминокислот происходит отщепление аминогруппы и выделение аммиака. Другим
- 41. При недостатке глюкозы в организме фос-фоенолпируват включается в глюконеогенез (см. раздел 7). Это происходит при голодании,
- 42. ГЛИКОГЕННЫЕ И КЕТОГЕННЫЕ АМИНОКИСЛОТЫ Катаболизм всех аминокислот сводится к образованию шести веществ, вступающих в общий путь
- 43. Некоторые аминокислоты в процессе катаболизма превращаются в ацетоацетат или ацетил-КоА и могут использоваться в синтезе кетоновых
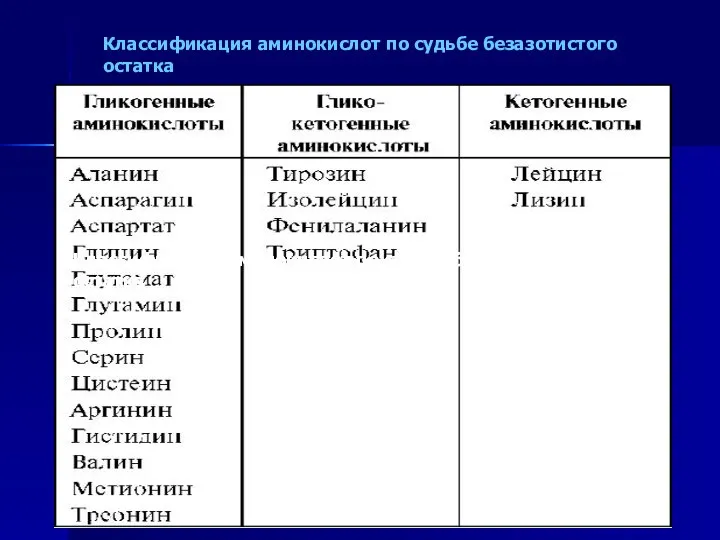
- 44. Классификация аминокислот по судьбе безазотистого остатка Классификация аминокислот по судьбе безазотистого остатка Классификация аминокислот по судьбе
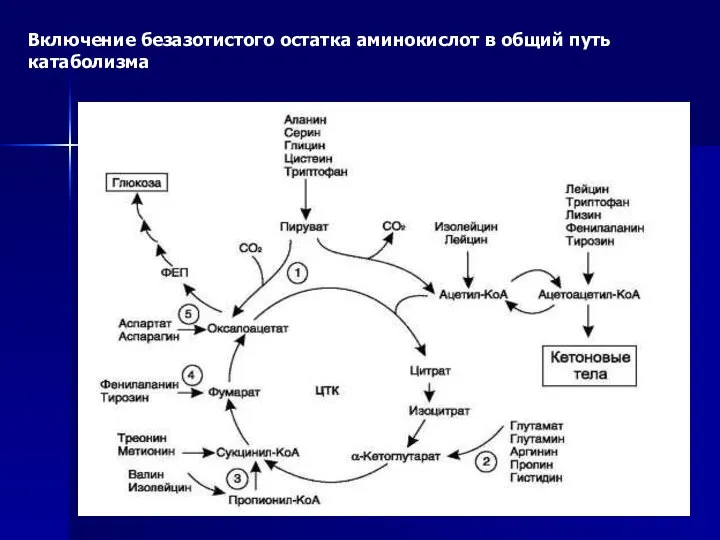
- 45. Включение безазотистого остатка аминокислот в общий путь катаболизма
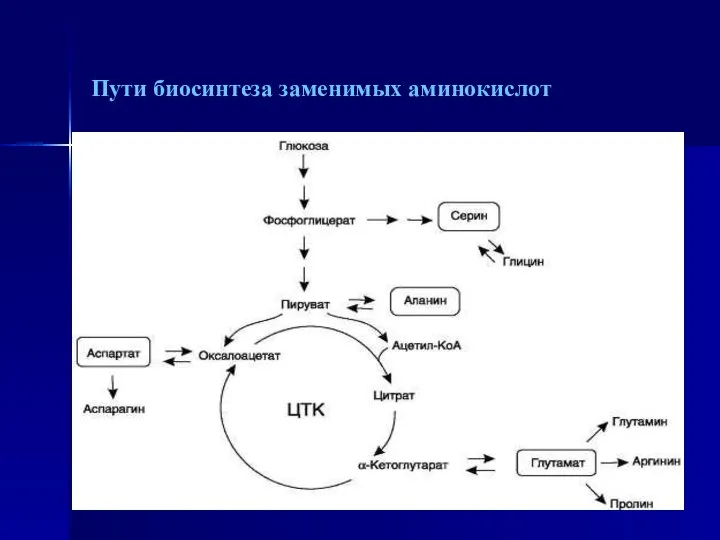
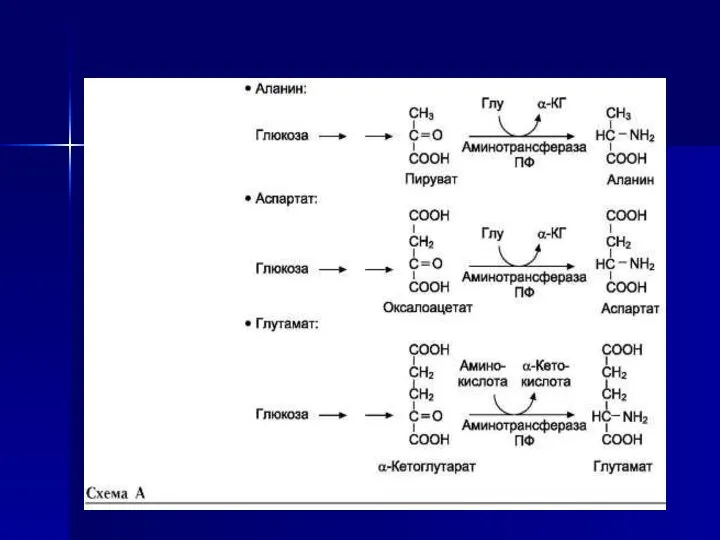
- 46. Пути биосинтеза заменимых аминокислот
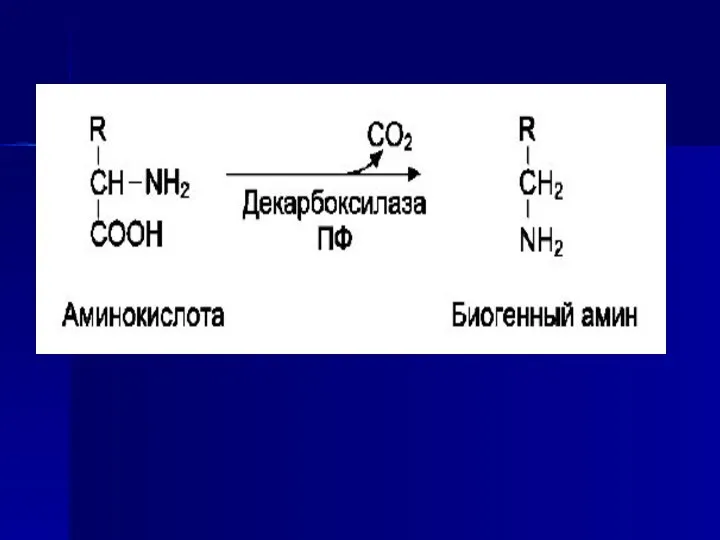
- 48. Декарбоксилирование Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию - отщеплению α-карбоксильной группы. В тканях млекопитающих
- 49. Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Некоторые
- 51. Синтез и биологическая роль серотонина Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из
- 52. Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект,
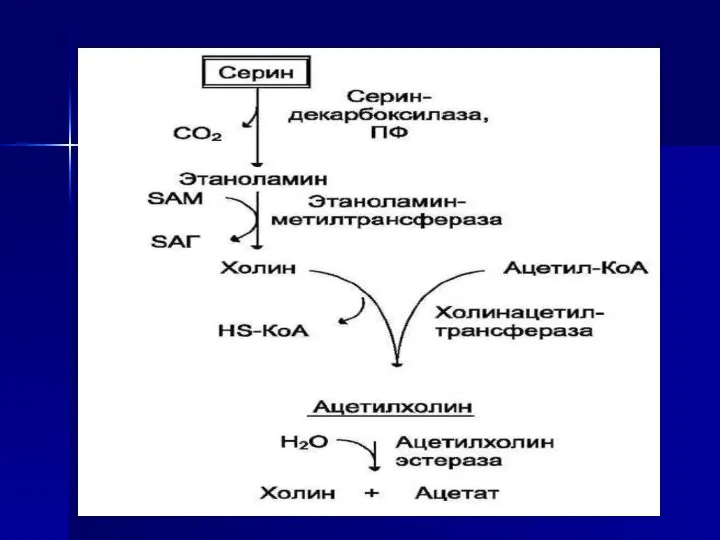
- 53. Синтез и биологическая роль ацетилхолина Ацетилхолин синтезируется в нервной ткани и служит одним из важнейших возбуждающих
- 55. В нервных клетках декарбоксилирование глутамата (отщепление α-карбоксильной группы) приводит к образованию γ-аминомасляной кислоты (ГАМК), которая служит
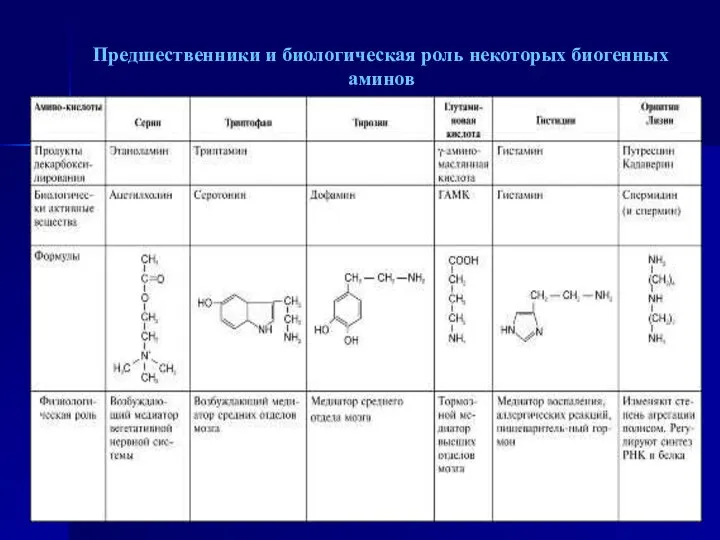
- 56. Предшественники и биологическая роль некоторых биогенных аминов
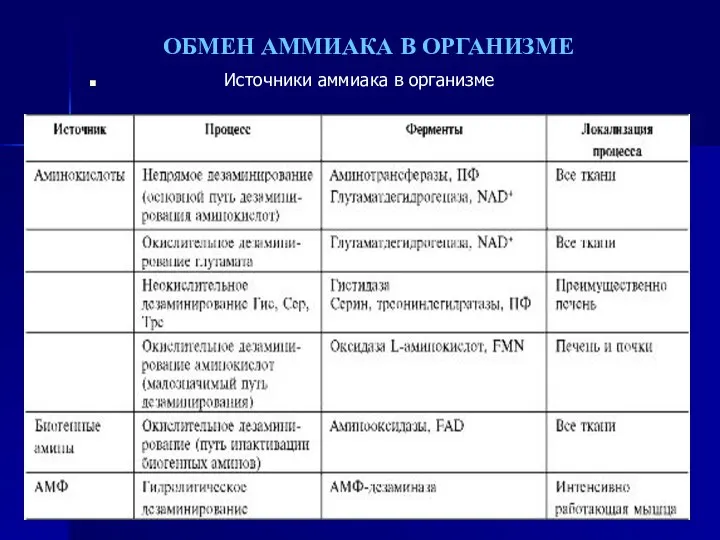
- 57. ОБМЕН АММИАКА В ОРГАНИЗМЕ Источники аммиака в организме
- 58. Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о
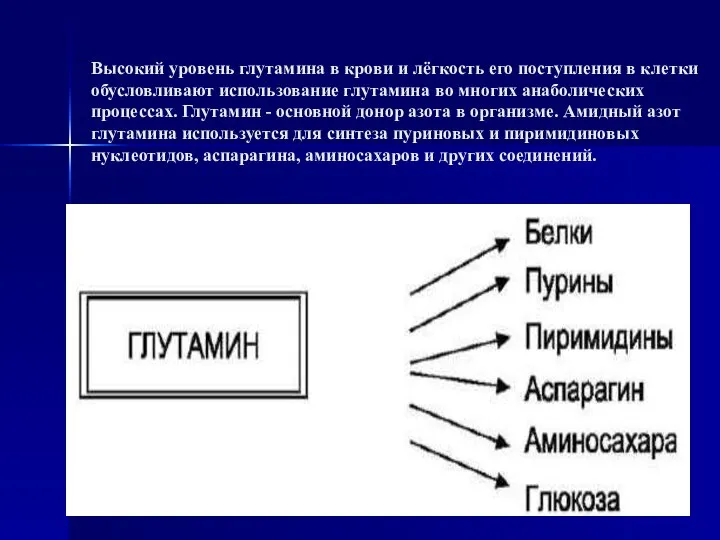
- 60. Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих
- 61. Пять путей обезвреживания аммиака Биосинтез мочевины в печени Восстановительное аминирование в тканях Образование амидов кислот в
- 62. Основной путь обезвреживания аммиака в организме – биосинтез мочевины в печени. В печень аммиак поступает в
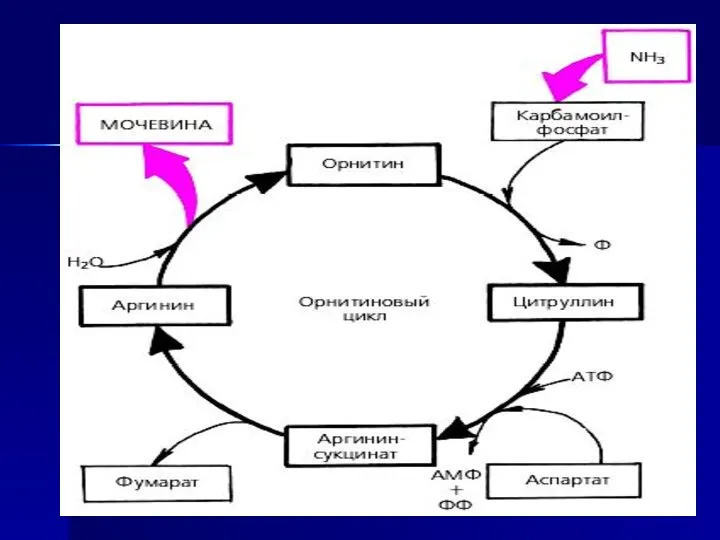
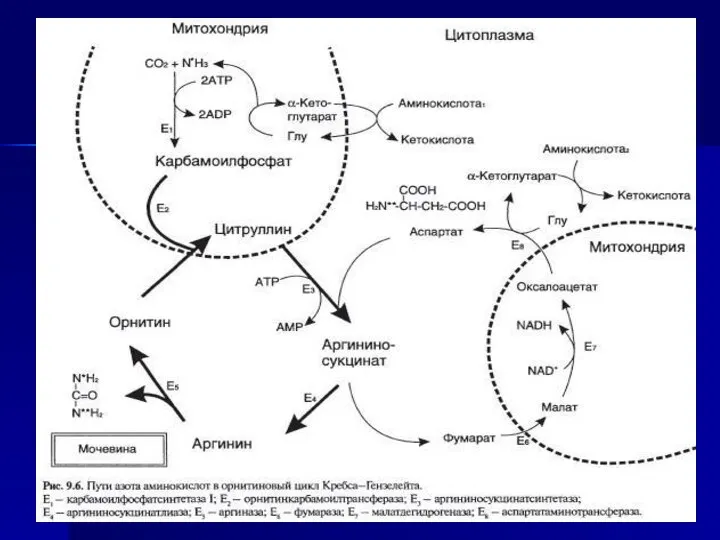
- 63. Орнитиновый цикл Суммарное уравнение синтезе мочевины печени: СО2+NH3+аспартат+3 АТФ+2 Н20= Мочевина+фумарат+2АДФ+2H3P04+АМФ +Н4Р2О7 1 реакция:
- 64. 2-я реакция и 3 реакции
- 65. 4-й этап
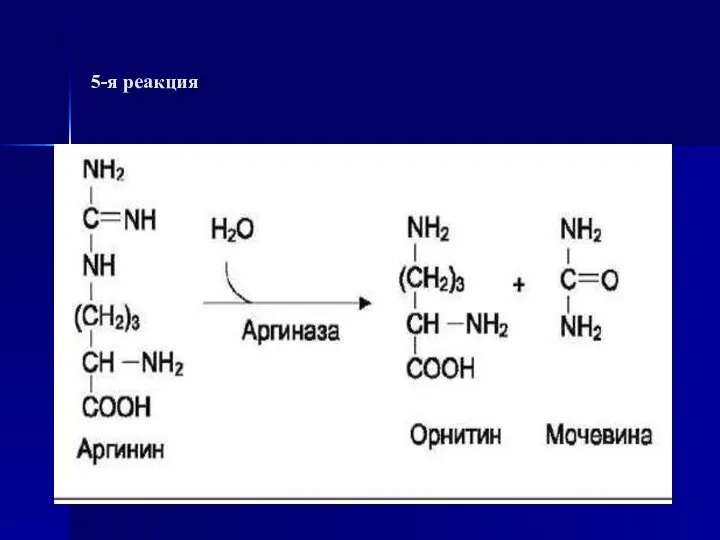
- 66. 5-я реакция
- 70. Энергетический баланс процесса В реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый
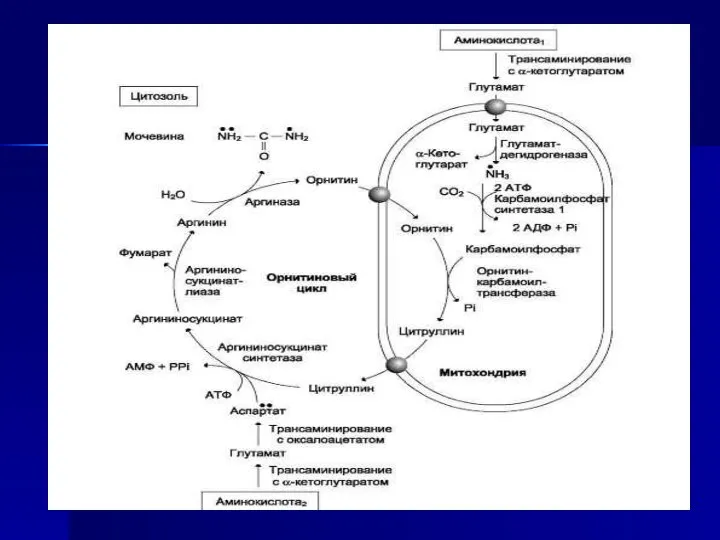
- 71. Ферменты орнитинового цикла распределены между митохондриями и цитозолем. Поэтому необходим трансмембранный перенос глутамата, цитруллина и орнитина
- 72. Биологическое значение орнитинового цикла 1. Обезвреживание аммиака в организме 2.Регуляция азотистого баланса в организме- при поступлении
- 73. Источники азота , углерода и кислорода в цикле мочевины 1-я амминогруппа - из свободного аммиака, образовавшегося
- 74. Гипераммониемия – повышение концентрации аммиака в крови. Причины: 1.Врожденная недостаточность хотя бы одного из ферментов биосинтеза
- 76. Скачать презентацию




















































 Жындар мен адамдарды өзіме құлшылық қылулары үшін ғана жараттым
Жындар мен адамдарды өзіме құлшылық қылулары үшін ғана жараттым План участка контрольного пункта автосцепки (КПА) с расстановкой оборудования
План участка контрольного пункта автосцепки (КПА) с расстановкой оборудования Операторы ЯП- присваивание,условный, комментарий
Операторы ЯП- присваивание,условный, комментарий  QHE8qHQu
QHE8qHQu Тема урока:
Тема урока:  Картина мира, созданная языком и культурой
Картина мира, созданная языком и культурой Поход на лесную поляну - презентация для начальной школы
Поход на лесную поляну - презентация для начальной школы Спектральный анализ полигармонического сигнала
Спектральный анализ полигармонического сигнала Парные звонкие и глухие согласные. Учитель: Лёшина Н.В.
Парные звонкие и глухие согласные. Учитель: Лёшина Н.В. Muscle vibrating drive - STANLEY
Muscle vibrating drive - STANLEY Презентация Юридическая клиника РАНХиГС
Презентация Юридическая клиника РАНХиГС Как уберечь ребенка от суицида…..
Как уберечь ребенка от суицида…..  Національно-патріотичне виховання
Національно-патріотичне виховання Составление циклических алгоритмов
Составление циклических алгоритмов Методическая разработка урока производственного обучения по профессии «Мастер по обработке цифровой информации»
Методическая разработка урока производственного обучения по профессии «Мастер по обработке цифровой информации» urok_po_teme_plany_mestnosti
urok_po_teme_plany_mestnosti Навигатор дополнительного образования. Инструкция для родителей по регистрации на сайте
Навигатор дополнительного образования. Инструкция для родителей по регистрации на сайте Военно-спортивная игра «Зарница»
Военно-спортивная игра «Зарница» Тема 3. Общие представления о социализации
Тема 3. Общие представления о социализации  Презентация на тему "Школа и педагогика в России в 19 веке" - скачать презентации по Педагогике
Презентация на тему "Школа и педагогика в России в 19 веке" - скачать презентации по Педагогике Расчёт интервала радиорелейной линии номограмным способом
Расчёт интервала радиорелейной линии номограмным способом Интегрированный урок математики, окружающего мира и музейной педагогики Тема: «Умножение и деление на 2. Решение задач и выражени
Интегрированный урок математики, окружающего мира и музейной педагогики Тема: «Умножение и деление на 2. Решение задач и выражени Разработка программы управления шаговым двигателем при помощи Arduino через драйвер А4988
Разработка программы управления шаговым двигателем при помощи Arduino через драйвер А4988 Полупроводниковые элементы. Диод. Транзистор
Полупроводниковые элементы. Диод. Транзистор Фундаментальный анализ РЦБ Лекция №4
Фундаментальный анализ РЦБ Лекция №4 Лепті сөйлем
Лепті сөйлем Высотные сооружения
Высотные сооружения Преподаватель кафедры финансового рынка и валютных отношений Тулупникова Юлия Вениаминовна
Преподаватель кафедры финансового рынка и валютных отношений Тулупникова Юлия Вениаминовна