Содержание
- 2. П Л А Н 12.1 Химическая связь и ее типы. 12.2 Ковалентная связь. 12.3 Водородная связь.
- 3. 12.1 Химическая связь – результат взаимодействия двух или более атомов, приводящий к образованию устойчивой многоатомной системы.
- 4. Природа сил, действующих в многоатомных системах, электрическая: притяжение разноименно заряженных частиц. Носителями зарядов в веществе являются
- 5. По характеру распределения заряженных частиц в веществе различают несколько типов химической связи.
- 7. Силы межмолекулярного взаимодействия
- 8. Энергия связи (Е, кДж/моль) – это энергия, необходимая для разрыва химической связи в одном моль вещества,
- 9. Чем больше энергия связи, тем прочнее химическая связь.
- 10. Энергетический подход к описанию химической связи Образование химической связи энергетически выгодно, так как энергия связанной системы
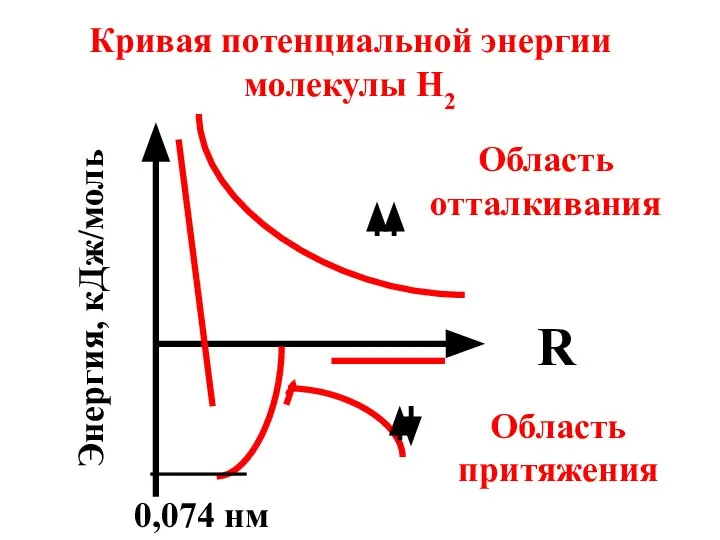
- 11. Кривая потенциальной энергии молекулы Н2 R Энергия, кДж/моль Область отталкивания Область притяжения 0,074 нм
- 12. 0,074 нм – это длина связи в молекуле H2. Длина связи – это расстояние между атомами
- 13. 12.2 Ковалентная связь (КС) – самый распространенный тип химической связи. В органических соединениях практически все связи
- 14. Существует два квантово-механических подхода к описанию КС: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
- 15. 12.2.1 Основные положения метода ВС. 1. В образовании КС участвуют только валентные электроны. Валентными называются электроны,
- 16. Валентность атома можно предсказать по числу неспаренных электронов в его стационарном и возбужденных состояниях.
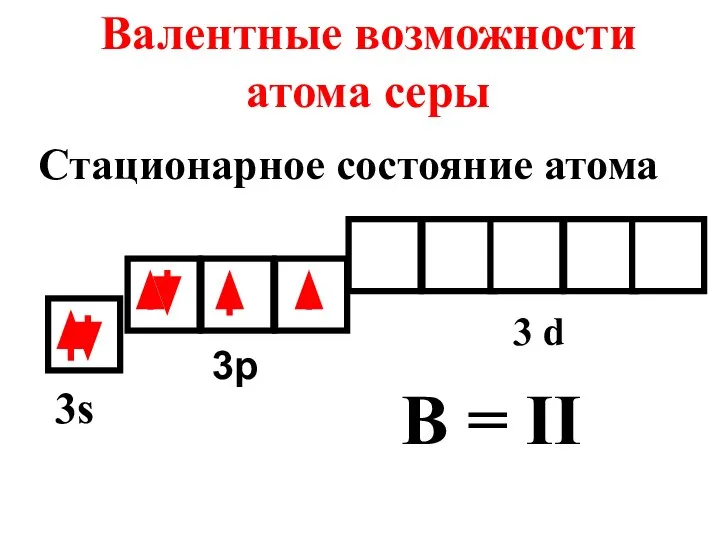
- 17. Валентные возможности атома серы 3s 3p 3 d B = II Стационарное состояние атома
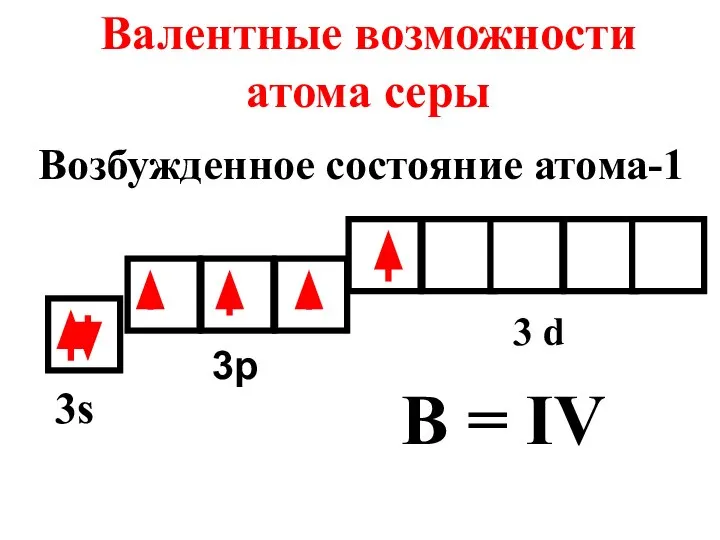
- 18. Валентные возможности атома серы 3s 3p 3 d B = IV Возбужденное состояние атома-1
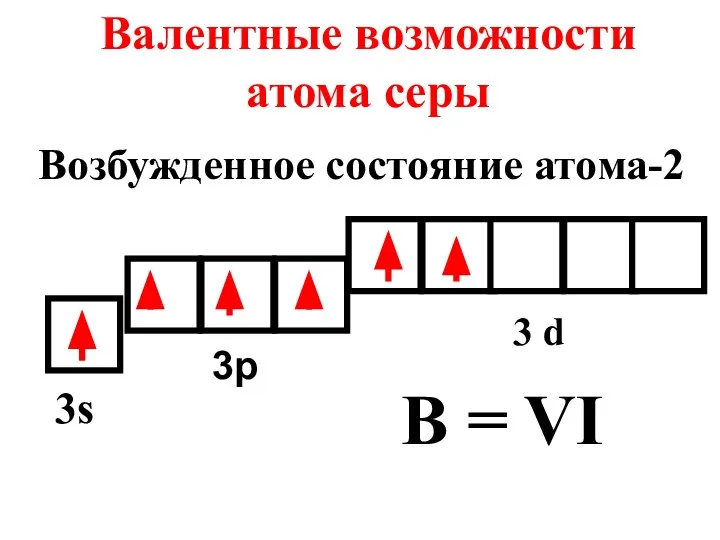
- 19. Валентные возможности атома серы 3s 3p 3 d B = VI Возбужденное состояние атома-2
- 20. 2. Единичную КС образуют 2 электрона с антипараллельными спинами, принадлежащими двум атомам (общая электронная пара).
- 21. Ковалентная связь – это химическая связь, образованная при помощи общих электронных пар, принадлежащих двум или более
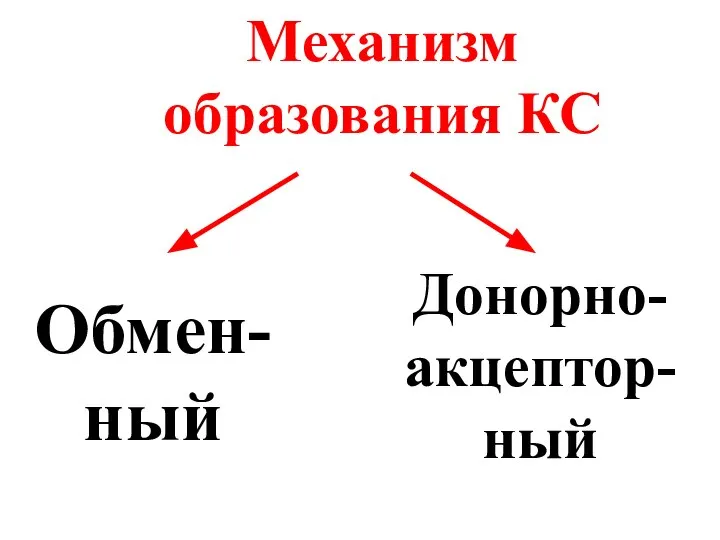
- 22. Механизм образования КС Обмен-ный Донорно-акцептор-ный
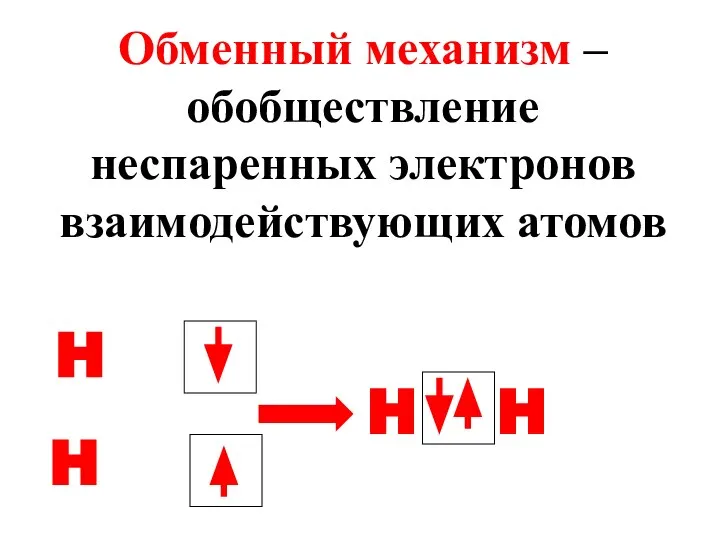
- 23. Обменный механизм – обобществление неспаренных электронов взаимодействующих атомов H H H H
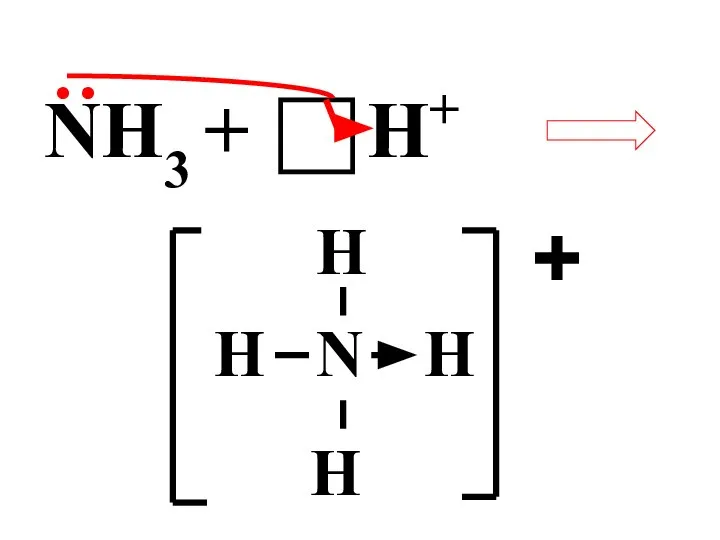
- 24. Донорно-акцепторный механизм – атом-донор отдает неподеленную электронную пару на вакантную орбиталь атома-акцептора
- 25. NH3 + ● ● H+ N H H H H +
- 26. Кратность связи (n) равна числу общих электронных пар: Н – Н n = 1 O =
- 27. 3. С точки зрения волновых представлений, образованию общей электронной пары соответствует перекрывание АО взаимодействующих атомов.
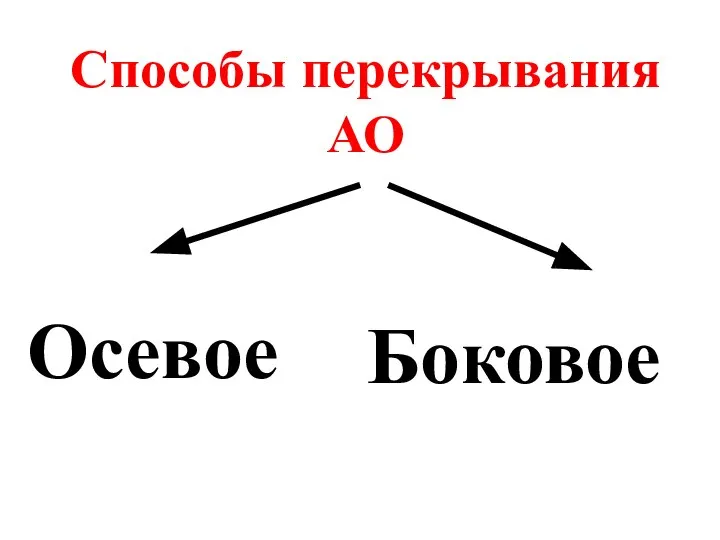
- 28. Способы перекрывания АО Осевое Боковое
- 29. Ось молекулы – это условная линия, соединяющая ядра атомов в молекуле
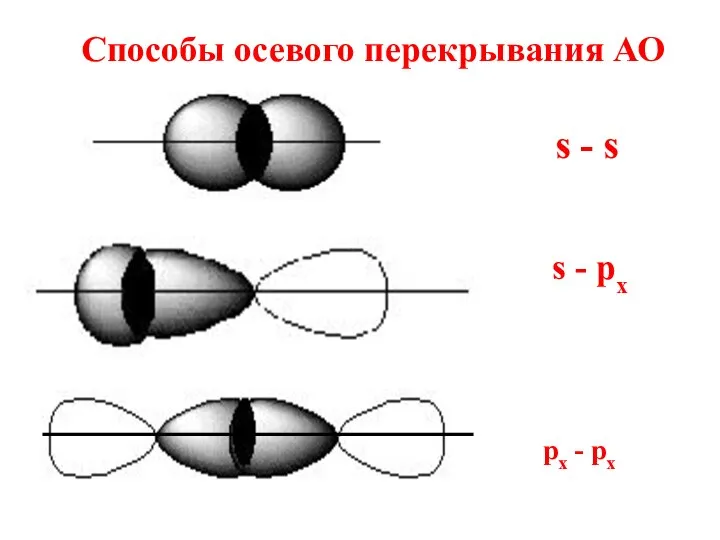
- 30. Способы осевого перекрывания АО s - s s - рх px - px
- 31. При осевом перекрывании орбиталей образуется разновидность ковалентной связи, называемая σ- связью.
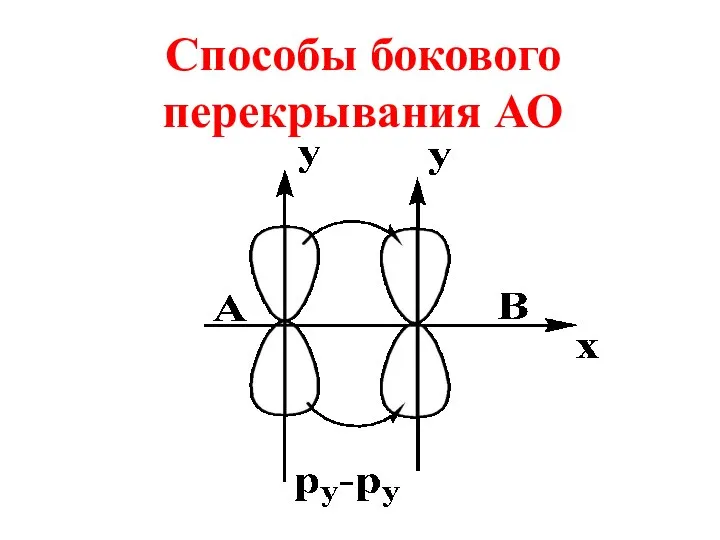
- 32. Способы бокового перекрывания АО
- 33. При боковом перекрывании орбиталей образуется разновидность ковалентной связи, называемая π- связью
- 34. Чем сильнее перекрываются орбитали, тем прочнее КС. Вот почему σ-связи прочнее π-связей.
- 35. 4. Если в молекуле три и более атомов, то орбитали ее центрального атома, как правило, гибридизованы.
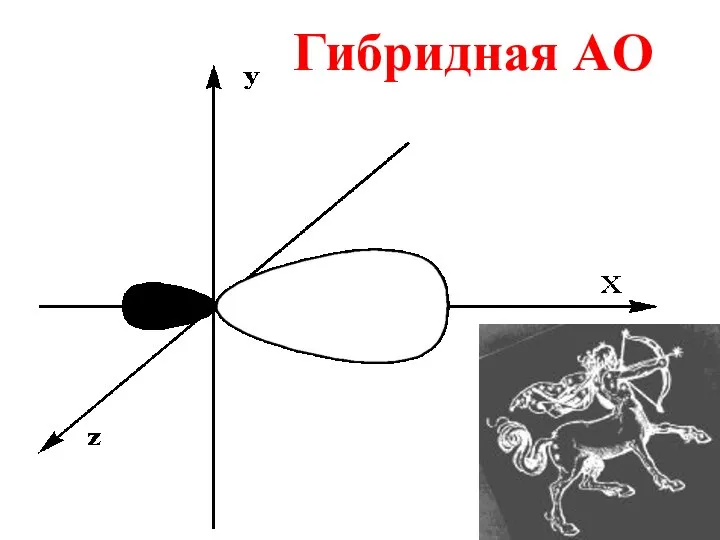
- 36. Гибридизация – выравнивание орбиталей атома по форме и энергии в процессе образования КС.
- 37. Гибридная AO
- 38. Гибридизация- энергетически выгодный процесс, обеспечивающий максимальное перекрывание АО.
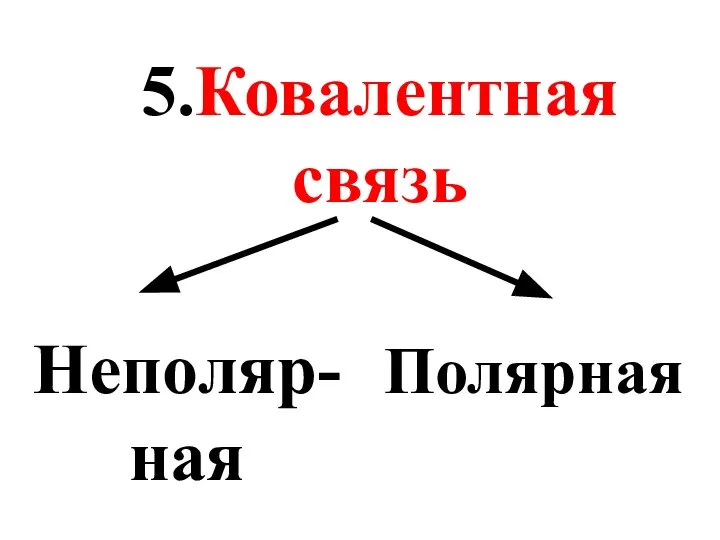
- 41. 5.Ковалентная связь Неполяр-ная Полярная
- 42. Неполярные КС связывают атомы одного химического элемента: Н-Н, О=О, N ≡ N.
- 43. Полярные КС связывают атомы разных химических элементов: H-Cl, H-O-H, C≡O.
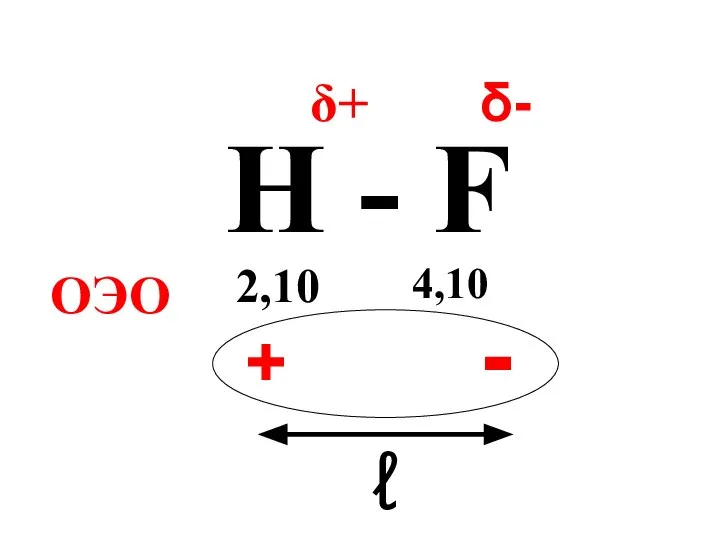
- 44. Полярность связи обусловлена смещением общей электронной пары в сторону более электроотрицательного атома.
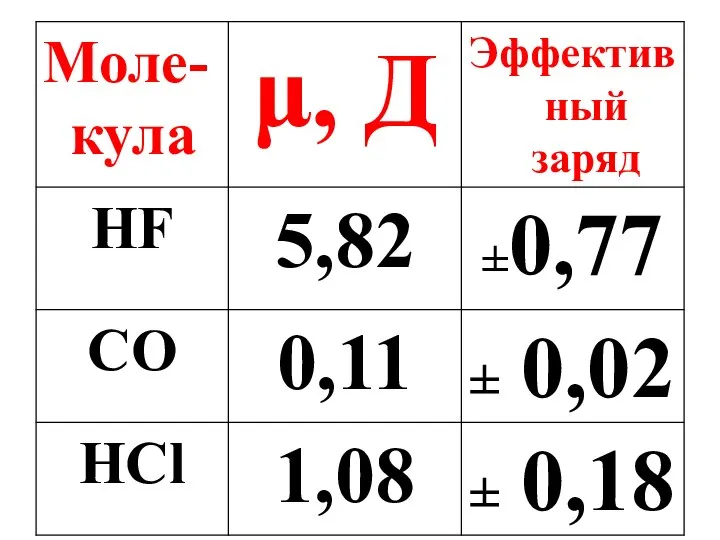
- 45. Полярная молекула – это диполь, характеризующийся величиной дипольного момента(μ).
- 46. μ = ℓq, ℓ – расстояние между центрами тяжести положительного и отрицательного зарядов в молекуле, q
- 47. H - F 2,10 4,10 ОЭО δ+ δ- + - ℓ
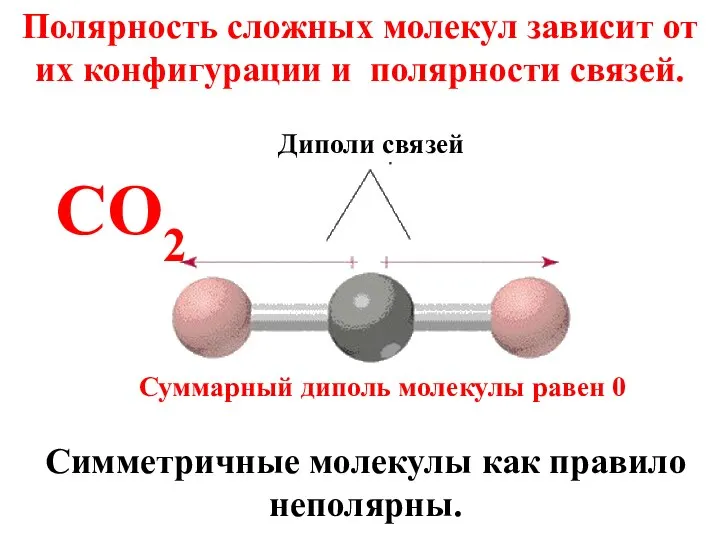
- 49. Полярность сложных молекул зависит от их конфигурации и полярности связей. Симметричные молекулы как правило неполярны. CO2
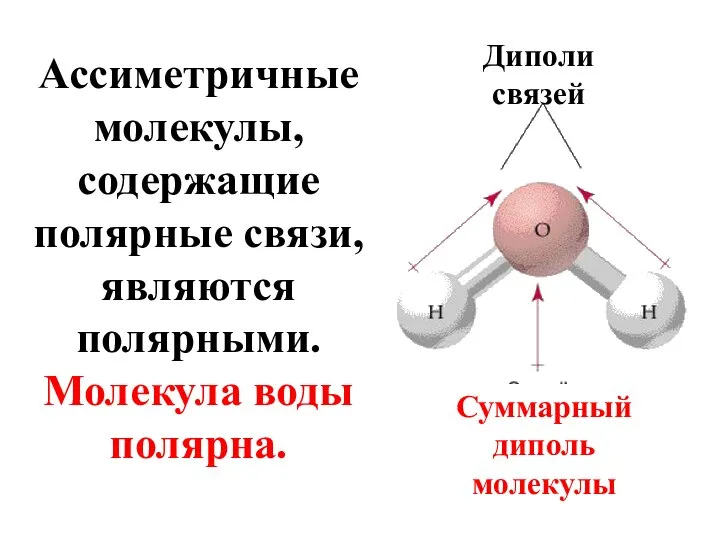
- 50. Ассиметричные молекулы, содержащие полярные связи, являются полярными. Молекула воды полярна. Диполи связей Суммарный диполь молекулы
- 51. 12.2.2 Основные положения метода MO. 1.В образовании КС участвуют все электроны в атоме.
- 52. 2. Электроны в молекулах занимают молекулярные орбитали (MO), подобно тому, как в атомах они занимают атомные
- 53. 3. МО заполняются электронами в соответствии с принципом минимальной энергии, принципом Паули и правилом Гунда.
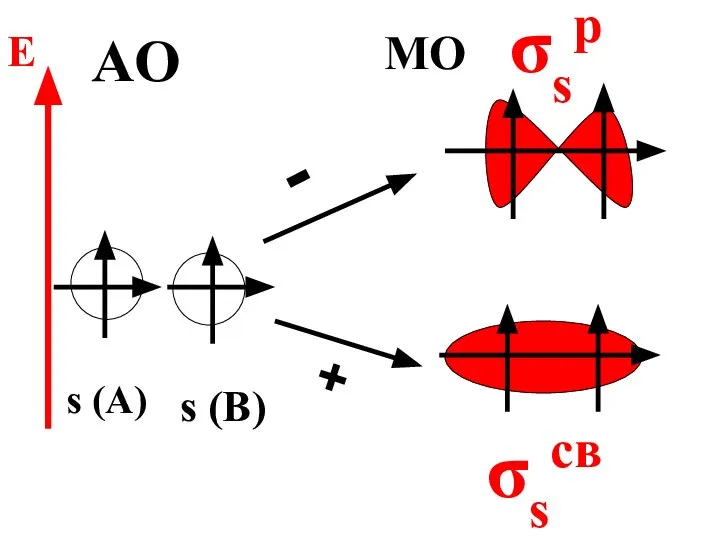
- 54. МО есть результат сложения или вычитания волновых функций АО взаимодействующих атомов.
- 55. При сложении АО образуется связывающая МО, энергия которой меньше энергии исходных атомных орбиталей.
- 56. При вычитании АО образуется разрыхляющая МО, энергия которой больше энергии исходных атомных орбиталей.
- 57. s (A) s (B) - + σsp σsсв AO MO E
- 58. Кратность связи n = N – N' 2
- 59. N – число электронов на связывающих орбиталях, N' – число электронов на разрыхляющих орбиталях.
- 60. Молекула не образуется, если n = 0
- 61. Метод МО позволяет определить магнитные свойства молекул.
- 62. Парамагнитные молекулы, генерирующие электромагнитное поле, содержат неспаренные электроны на МО.
- 63. Диамагнитные молекулы, не генерирующие собственное электромагнитное поле, не содержат неспаренных электронов на МО.
- 64. Для описания молекул используются энергетические диаграммы.
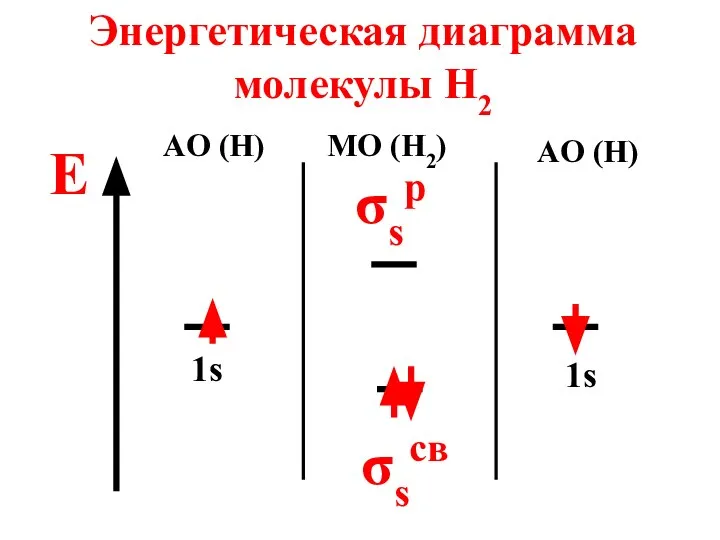
- 65. Энергетическая диаграмма молекулы H2 E AO (H) MO (H2) AO (H) 1s 1s σsp σscв
- 66. Молекула диамагнитна, так как не содержит неспаренных электронов на МО n = 2 - 0 2
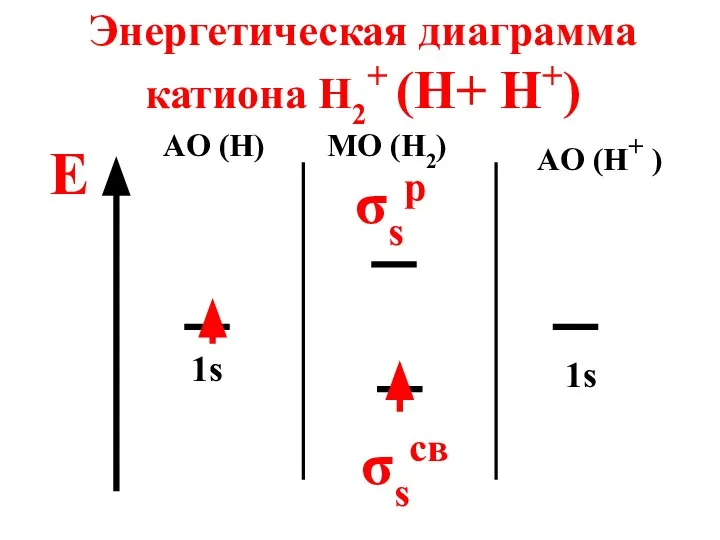
- 67. Энергетическая диаграмма катиона H2+ (H+ H+) E AO (H) MO (H2) AO (H+ ) 1s 1s
- 68. Катион парамагнитен, так как содержит неспаренный электрон на МО n = 1 - 0 2 =
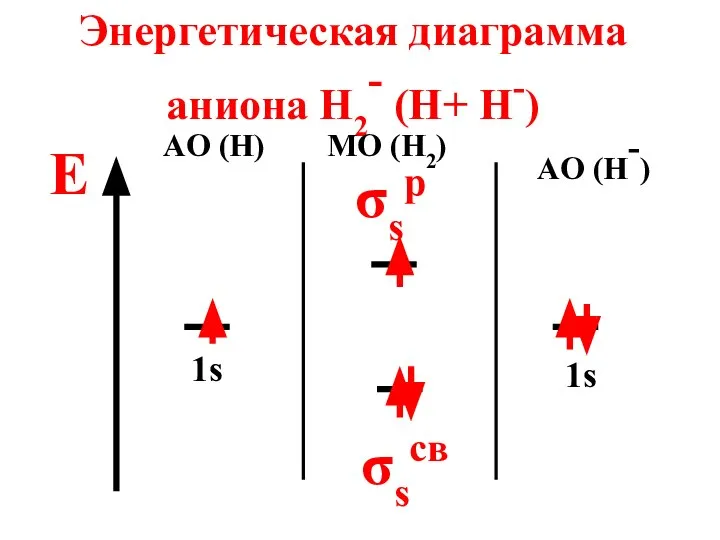
- 69. Энергетическая диаграмма аниона H2- (H+ H-) E AO (H) MO (H2) AO (H-) 1s 1s σsp
- 70. Анион парамагнитен, так как содержит неспаренный электрон на МО n = 2 - 1 2 =
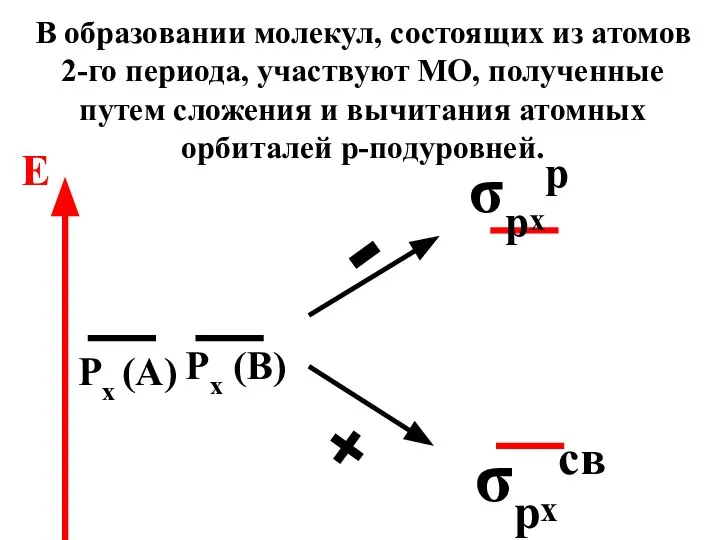
- 71. σрxр σрxсв Px (A) Px (B) - + E В образовании молекул, состоящих из атомов 2-го
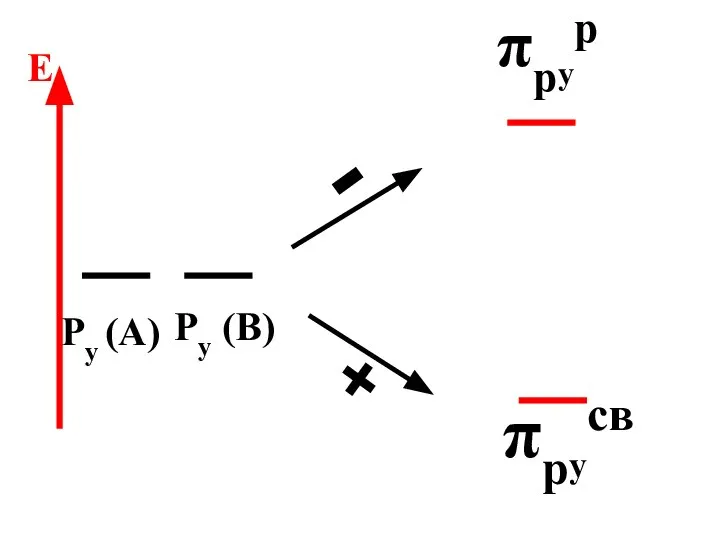
- 72. πрyр πрyсв Py (A) Py (B) - + E
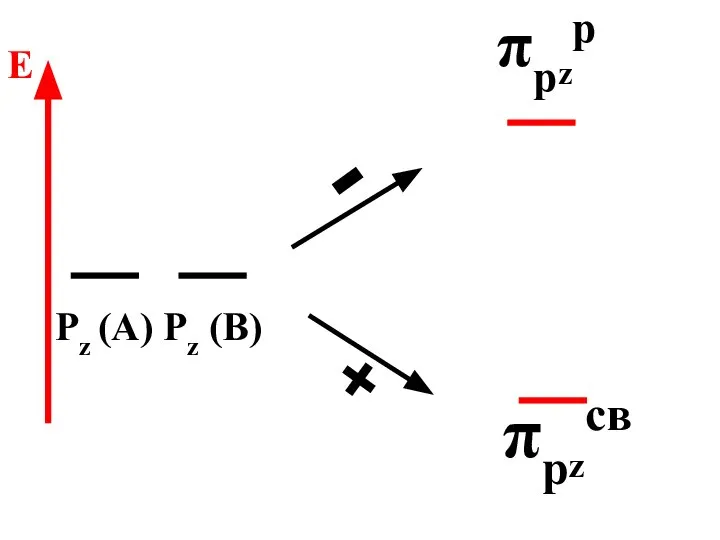
- 73. πрzр πрzсв Pz (A) Pz (B) - + E
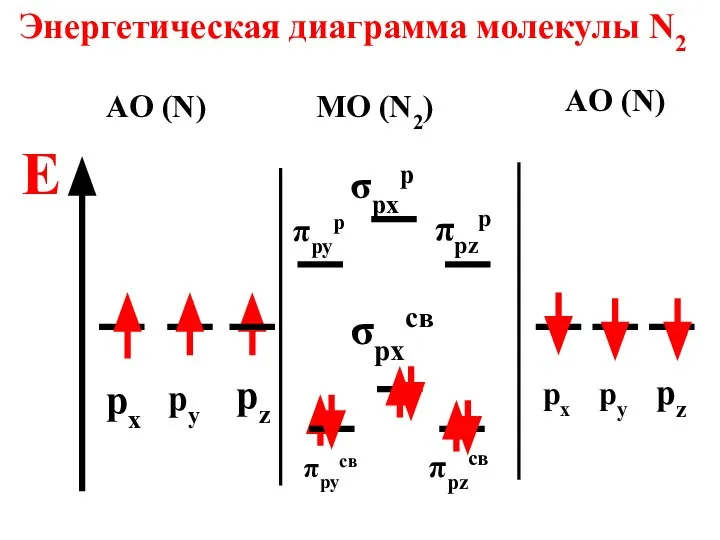
- 74. Энергетическая диаграмма молекулы N2 E AO (N) MO (N2) AO (N) px σpxp σpxcв px py
- 75. Молекула диамагнитна, так как не содержит неспаренных электронов на МО n = 6 - 0 2
- 76. 12.3 Водородная связь - это особый вид меж- и внутримолекулярного взаимодействия, который описывается схемой: R1A -
- 77. Механизм образования водородной связи состоит в том, что поляризованный атом водорода внедряется в электронную оболочку соседнего,
- 78. Ввиду низкой прочности водородной связи, ее обозначают пунктиром или многоточием.
- 79. Межмолекулярная водородная связь приводит к ассоциации молекул и существенно влияет на физические свойства веществ: tкип, tпл,
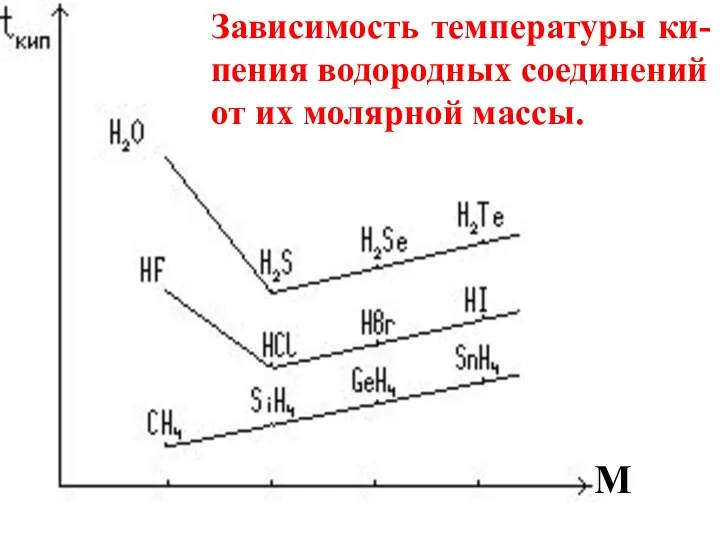
- 80. Например, температура кипения родственных соединений растет с увеличением их молярной массы. Однако эта зависимость может нарушаться.
- 81. M Зависимость температуры ки-пения водородных соединений от их молярной массы.
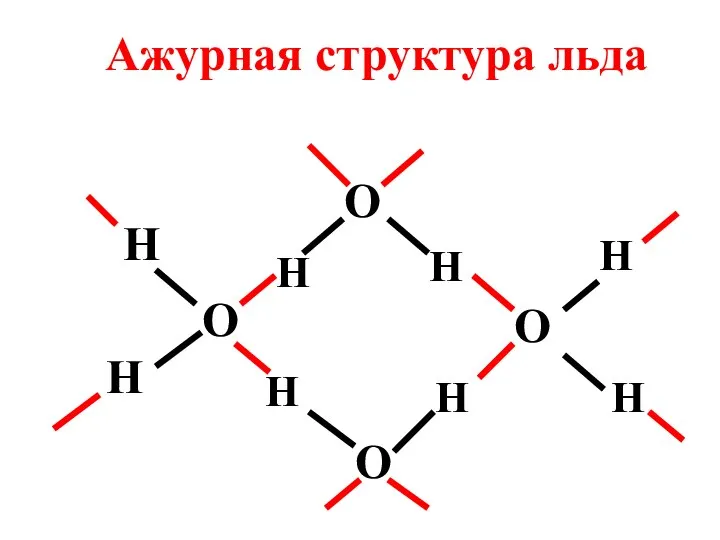
- 82. ПРИМЕРЫ СОЕДИНЕНИЙ С МЕЖМОЛЕКУЛЯРНОЙ ВОДОРОДНОЙ СВЯЗЬЮ 1) Вода Во льду молекула Н2О образует четыре водородные связи,
- 83. O H H H H O H O O H H H Ажурная структура льда
- 84. При плавлении льда часть водородных связей разрывается (при 20оС их сохраняется 46%) и молекулы воды заполняют
- 85. Плотность льда меньше плотности жидкой воды(0,92 и 1,0 г/мл). Вследствие этого в зимнее время лед закрывает
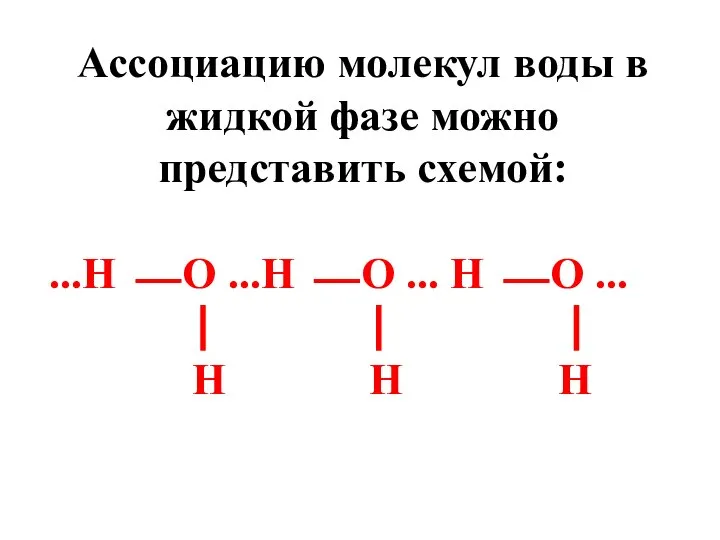
- 86. Ассоциацию молекул воды в жидкой фазе можно представить схемой: ...Н ⎯ О ...Н ⎯ О ...
- 87. Жидкая вода содержит как ассоциаты (кластеры), так и молекулы, не связанные водородными связями. Кластеры называют мерцающими,
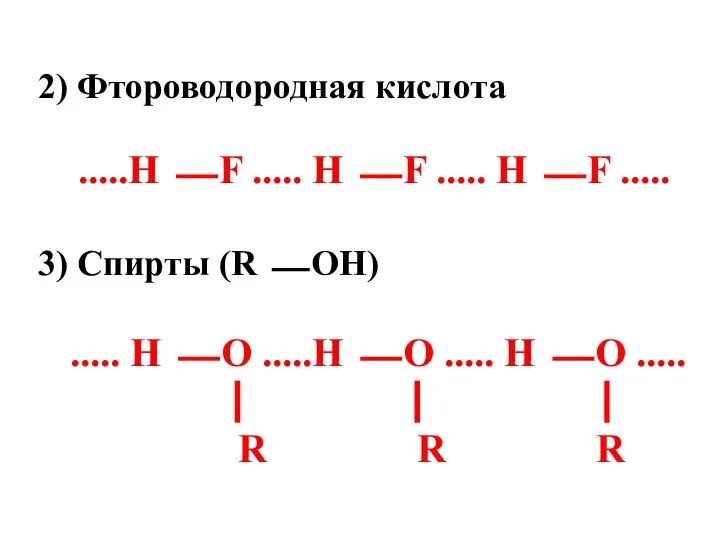
- 89. 2) Фтороводородная кислота .....Н ⎯ F ..... Н ⎯ F ..... Н ⎯ F ..... 3)
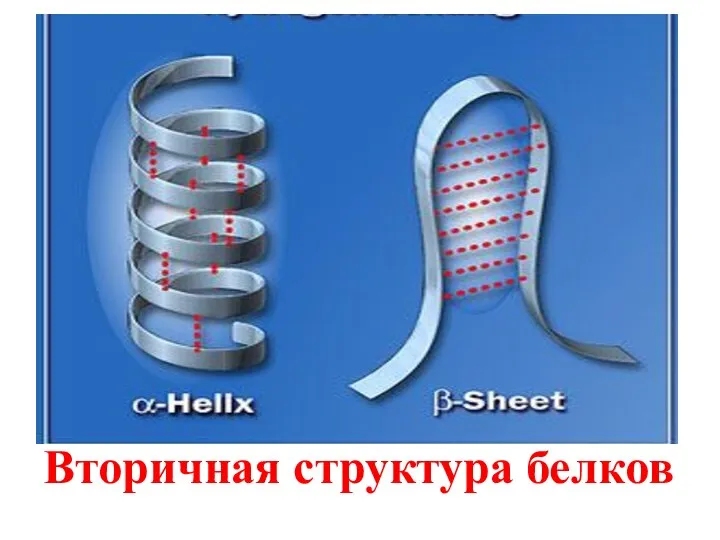
- 90. Значение внутримолекулярных водородных связей заключается в том, что они участвуют в формировании пространственных структур биополимеров (белков,
- 92. Вторичная структура белков
- 94. Скачать презентацию


























































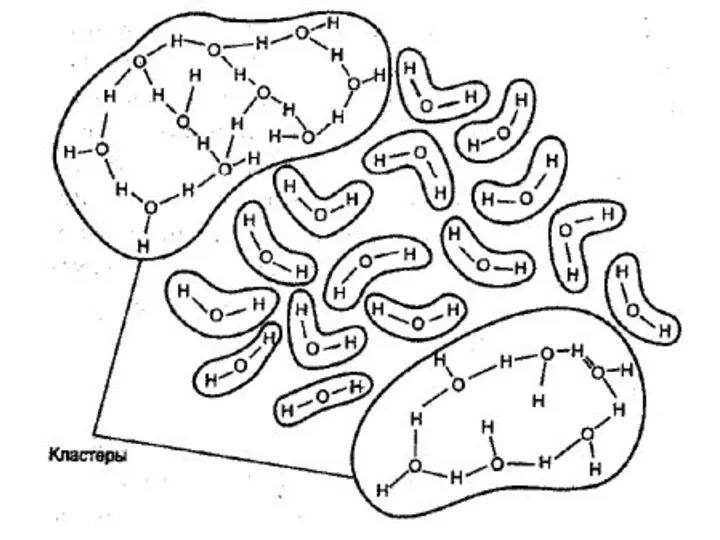

 Экосистемы
Экосистемы Управление деловой карьерой в организации
Управление деловой карьерой в организации Политология, как наука о политике и ее взаимоотношениях с обществом
Политология, как наука о политике и ее взаимоотношениях с обществом Как жить в мире с родителями? Классный час
Как жить в мире с родителями? Классный час Исаак Ильич Левитан (1860-1900) Работу выполнил Тихачев Вячеслав ученик 5 «Б» класса МОУ лицея №10 Г. Советска
Исаак Ильич Левитан (1860-1900) Работу выполнил Тихачев Вячеслав ученик 5 «Б» класса МОУ лицея №10 Г. Советска Учебный план 1 класса на 2010-2011учебный год ГОУ СОШ с УИОП г.Белой Холуницы Кировской области
Учебный план 1 класса на 2010-2011учебный год ГОУ СОШ с УИОП г.Белой Холуницы Кировской области Аттестационная работа. Методическая разработка по выполнению исследовательской работы «Секреты колыбельной песни»
Аттестационная работа. Методическая разработка по выполнению исследовательской работы «Секреты колыбельной песни» Туризм. Грузия
Туризм. Грузия Личность Психопатии Олигофрения
Личность Психопатии Олигофрения Pancakes week, Maslenitsa
Pancakes week, Maslenitsa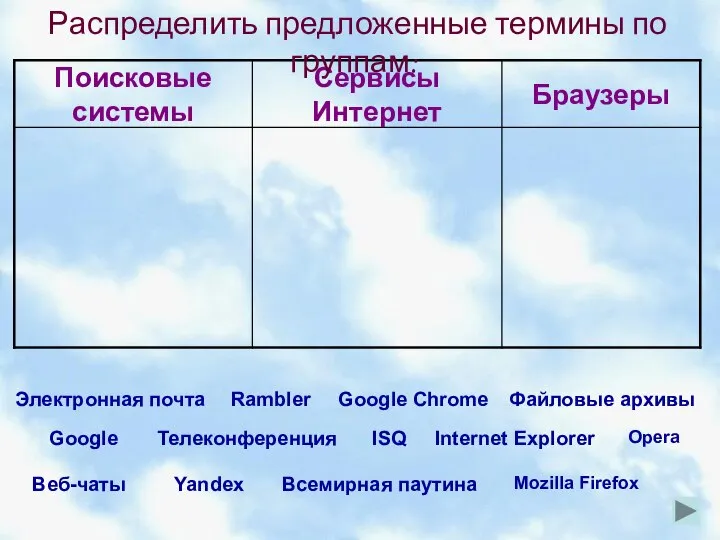 Облачные технологии как информационные сервисы Интернет
Облачные технологии как информационные сервисы Интернет Объектно-ориентированное программирование. Языки C++ и C#
Объектно-ориентированное программирование. Языки C++ и C# Кенигсберг – это крепость? Шумилина В.А.
Кенигсберг – это крепость? Шумилина В.А. Методы изучения наследственности человека
Методы изучения наследственности человека  Дипломатия и демократия. Дипломатия и переговоры
Дипломатия и демократия. Дипломатия и переговоры Фокина Л. П. Тренажёр-раскраска СЛОВАРНЫЕ СЛОВА. Часть 2 - презентация для начальной школы
Фокина Л. П. Тренажёр-раскраска СЛОВАРНЫЕ СЛОВА. Часть 2 - презентация для начальной школы Александр Карелин
Александр Карелин Презентация "Деревянне зодчество Руси" - скачать презентации по МХК
Презентация "Деревянне зодчество Руси" - скачать презентации по МХК Український національний костюм
Український національний костюм Классификация деловых культур по Р. Гестеланду
Классификация деловых культур по Р. Гестеланду Развитие натуралистических умений учащихся средствами изобразительного искусства
Развитие натуралистических умений учащихся средствами изобразительного искусства Презентация "Костюм xviii века" - скачать презентации по МХК
Презентация "Костюм xviii века" - скачать презентации по МХК “ҚАЗФОСФАТ” ЖШС
“ҚАЗФОСФАТ” ЖШС Современные перспективные технологии
Современные перспективные технологии Рекурсивные функции языка CLIPS
Рекурсивные функции языка CLIPS IT – Скорая. Организация по ремонту компьютеров
IT – Скорая. Организация по ремонту компьютеров Тренинг "Сплочение коллектива". Познание стран мира
Тренинг "Сплочение коллектива". Познание стран мира ЦИКЛИЧЕСКИЕ НУКЛЕОТИДЫ В РОЛИ ВТОРИЧНЫХ ПОСРЕДНИКОВ
ЦИКЛИЧЕСКИЕ НУКЛЕОТИДЫ В РОЛИ ВТОРИЧНЫХ ПОСРЕДНИКОВ