Содержание
- 2. Электроотрицательность 1. Важнейшие химические реакции в зоне гипергенеза имеют окислительно-восстановительный характер (сопровождаются потерей или приобретением электронов).
- 3. Восстановители 1. Металлы – сильные восстановители. 2. Важными восстановителями при геологических процессах являются: а) двухвалентное железо;
- 4. Окислители 1. Неметаллы – сильные окислители. 2. Важнейший окислитель – свободный кислород атмосферы и гидросферы. 3.
- 5. В зависимости от степени ионизации один и тот же элемент может быть и окислителем и восстановителем.
- 6. Окислительно-восстановительные реакции идут с выделением или поглощением энергии. При окислении двухвалентного железа и марганца выделяется значительное
- 7. Изобарный потенциал Окислительно-восстановительные реакции могут быть охарактеризованы величиной изобарного потенциала ΔZ. Производимая реакцией работа равна ее
- 8. Нулевой потенциал Потенциал перехода одной грамм-молекулы газообразного водорода в ионную форму при Т=25 ºС и давлении
- 10. Скачать презентацию







 на тему: «Сделки: историко-правовые аспекты и современное гражданско-правовое регулирование» Выполнила: Макарычева С.И. Научный р
на тему: «Сделки: историко-правовые аспекты и современное гражданско-правовое регулирование» Выполнила: Макарычева С.И. Научный р Спорт во мне
Спорт во мне химия
химия Презентация на тему: День Святого Валентина 9 класс
Презентация на тему: День Святого Валентина 9 класс Презентация "Русский национальный костюм" - скачать презентации по МХК
Презентация "Русский национальный костюм" - скачать презентации по МХК поделка коти - презентация для начальной школы
поделка коти - презентация для начальной школы Патогенное действие факторов внешней среды
Патогенное действие факторов внешней среды БИБЛИОТЕЧНЫЙ УРОК: «Периодика для детей»
БИБЛИОТЕЧНЫЙ УРОК: «Периодика для детей» Что мешает писать продающие тексты? Дмитрий КОТ
Что мешает писать продающие тексты? Дмитрий КОТ Памятка для родителей ПФДО
Памятка для родителей ПФДО Языковые нормы официально-делового стиля
Языковые нормы официально-делового стиля Как Никита играл в доктора - презентация для начальной школы_
Как Никита играл в доктора - презентация для начальной школы_ Основы системного анализа 8
Основы системного анализа 8 Медицинский регион Гессен проф. д.м.н. Райнер Г.Х. Моосдорф, председатель Правления Medical Network Hessen, представитель федеральной зем
Медицинский регион Гессен проф. д.м.н. Райнер Г.Х. Моосдорф, председатель Правления Medical Network Hessen, представитель федеральной зем Енергетична установка контейнеровозу дедвейтом 60640 т
Енергетична установка контейнеровозу дедвейтом 60640 т Законодательство в области авторского права и интеллектуальной собственности
Законодательство в области авторского права и интеллектуальной собственности WWW технология
WWW технология Организация стока поверхностных вод (Тема 3)
Организация стока поверхностных вод (Тема 3) Weihnachten in Deutschland
Weihnachten in Deutschland Масленица
Масленица Следящее рекуперативно-реостатное торможение
Следящее рекуперативно-реостатное торможение Рабочая профессия слесарь-электрик по ремонту электрооборудования
Рабочая профессия слесарь-электрик по ремонту электрооборудования Лапшина Ольга Ивановна Учитель английского языка. МОУ Первомайская СОШ
Лапшина Ольга Ивановна Учитель английского языка. МОУ Первомайская СОШ Гр. заняття Т-1.2.ppt
Гр. заняття Т-1.2.ppt Дэниэл Трейсман, книга «Возвращение: Путь России от Горбачёва до Медведева»
Дэниэл Трейсман, книга «Возвращение: Путь России от Горбачёва до Медведева» продукция ТМ Помещик Крупнов
продукция ТМ Помещик Крупнов Актуальные направления идеологической работы в Республике Беларусь
Актуальные направления идеологической работы в Республике Беларусь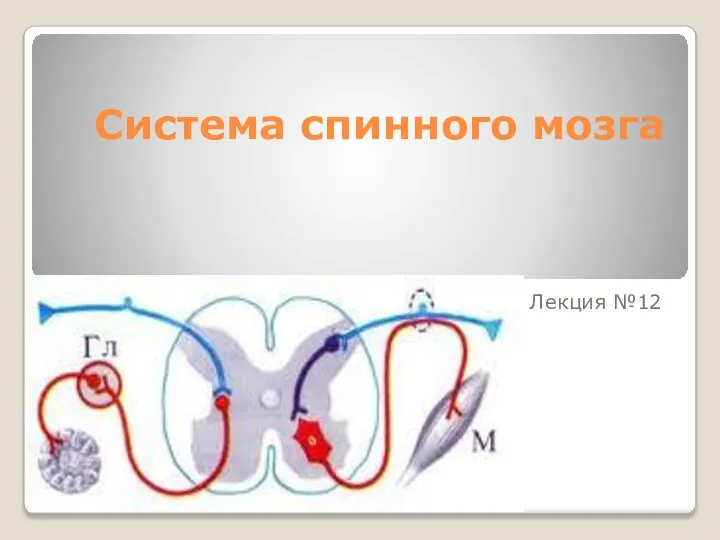 Система спинного мозга
Система спинного мозга