Определение биохимии История развития биохимии Понятие «жизнь» Живой организм Строение и функции белков
Содержание
- 2. 1) статическая биохимия - это анализ химического состава живых организмов; 2) динамическая биохимия - изучает совокупность
- 3. Современная биохимия решает следующие задачи: 1. Создание фармацевтических препаратов (гормонов, ферментов), регуляторов роста растений, средств борьбы
- 4. История развития биохимии В 1903 г. немецкий химик Карл Нойберг впервые использовал термин «биохимия» Однако корни
- 5. История развития биохимии 16-17 вв – немецкий врач- ятрохимик Парацельс выдвинул прогрессивное по тем временам предположение
- 6. История развития биохимии В 1814 г. – русский ученый Кирхгофф описал осахаривание крахмала под действием фермента
- 7. История развития биохимии 20 в. - Фишер обосновал пептидная теория строения белков Кнооп, Ленинджер – обосновали
- 8. Биохимия – теоретическая основа биологии и медицины. Цель биохимии – применять знания, полученные при изучении биохимии,
- 9. Главным для медицинской биохимии является выяснение функционального, то есть биологического назначения всех химических веществ и физико-химических
- 10. Медицинская биохимия Клиническая биохимия Патологическая биохимия Нормальная биохимия
- 11. Нормальная биохимия – наука, которая с помощью биохимических методов на уровне молекул , клеточных органелл ,
- 12. «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их
- 13. Основная структурная единица всех форм жизни – клетка. При большом разнообразии клеток их объединяет наличие обязательных
- 14. Определение Физико-химические свойства Стереохимия Современная рациональная классификация Образование пептидных связей Аминокислоты
- 15. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
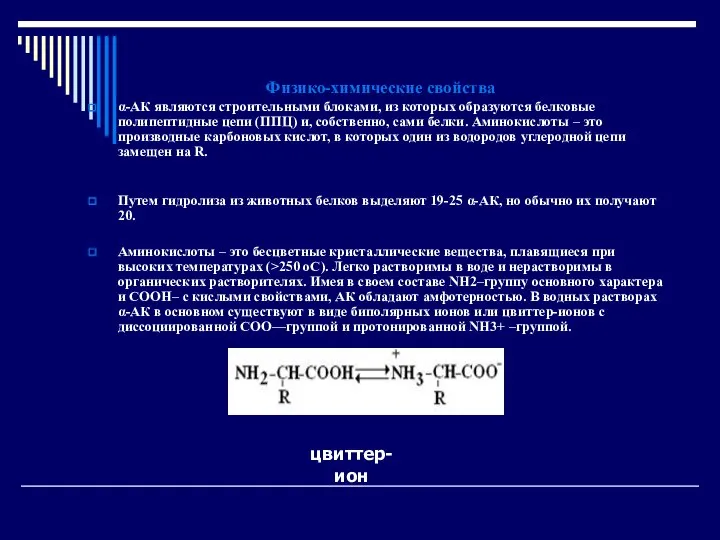
- 16. Физико-химические свойства α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами
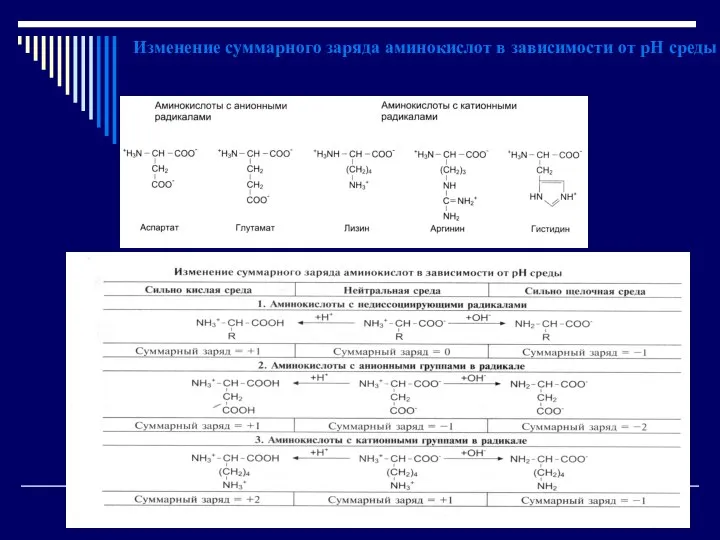
- 17. В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в
- 18. Что такое изоэлектрическая точка белка? Величина рН, при которой в водном растворе преобладает цвиттер-ион, т.е. равновесная
- 19. Стереохимия аминокислот Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено
- 20. Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
- 21. Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
- 22. Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
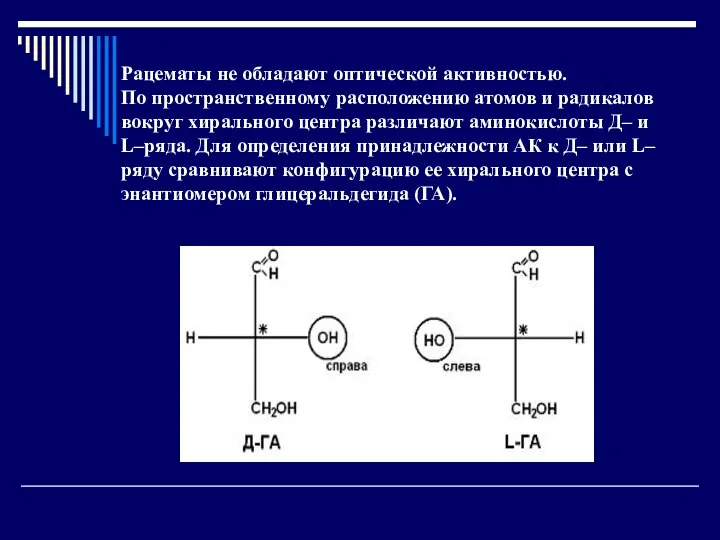
- 23. Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты
- 24. По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если
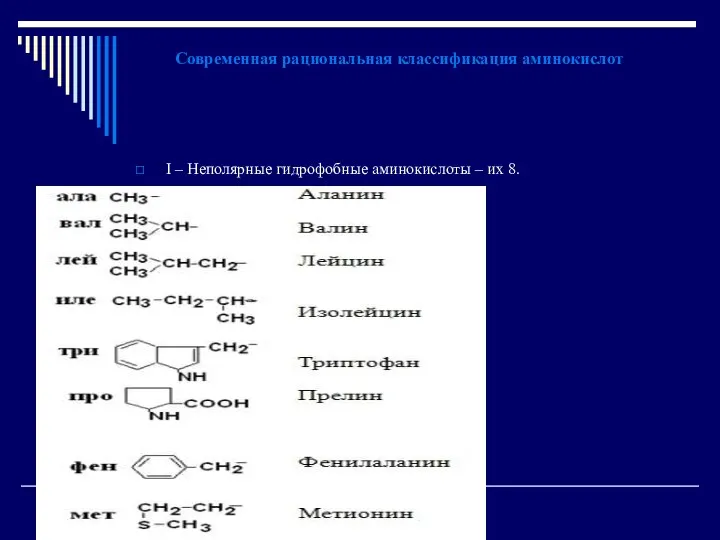
- 25. Современная рациональная классификация аминокислот I – Неполярные гидрофобные аминокислоты – их 8.
- 26. II –Полярные гидрофильные незаряженные аминокислоты – их 7.
- 27. III – Отрицательно заряженные кислые аминокислоты
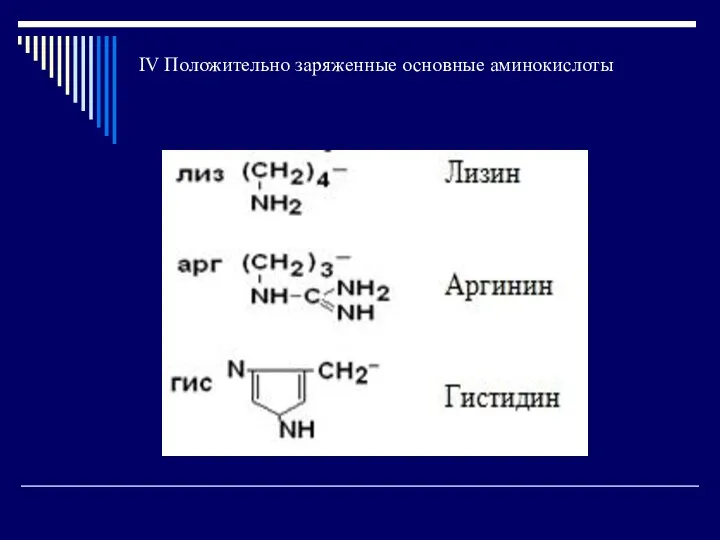
- 28. IV Положительно заряженные основные аминокислоты
- 29. II. Биологическая классификация. 1) Незаменимые аминокислоты не могут синтезироваться в организме человека и должны обязательно поступать
- 30. III. Химическая классификация. По строению бокового радикала различают алифатические, ароматические, серусодержащие, оксиаминокислоты, диаминомонокарбоновые, дикарбоновые аминокислоты и
- 31. Образование пептидных связей. α–СООН группа одной аминокислоты может реагировать с α–NH2 группой другой аминокислоты с образованием
- 32. Пептиды пишутся и читаются с N–конца. Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей:
- 33. Белки , как уникальный класс биополимеров Белки – это высокомолекулярные азотсодержащие органические соединения, построенные из остатков
- 34. Отличия живой природы от неживой 1) способность живых организмов к воспроизводству себе подобных; 2) сократимость, движение;
- 35. Белки являются важнейшим субстратом жизни, т.к. обладают рядом особенностей : молекулы белков отличаются неисчерпаемым разнообразием структуры
- 36. обладая разнообразными химическими радикалами аминокислотных остатков в составе полипептидных цепей, белковые молекулы способны вступать в разнообразные
- 37. Физико-химические свойства белков 1. Высокая вязкость белковых растворов. 2. Водные растворы белков имеют ясно выраженный коллоидный
- 38. Заряд белковой молекулы Белковые растворы - коллоидные растворы с разными свойствами. Белки бывают кислыми и основными:
- 39. 1. Высаливание белков: (NH4)SO4 - снимается только гидратная оболочка, белок сохраняет все виды своей структуры, все
- 40. Элементный состав белков В белках содержится С – до 55%; О– 20-25%; N – 16%, а
- 41. Синтез белков очень сложен и трудоемок, поэтому реально лучше выделить белки из природных источников. Белки обладают
- 42. Последовательность операций по выделению белков обычно состоит в следующем: Гомогенизация - измельчение биологического материала 2. Экстракция
- 43. МЕТОДЫ ВЫДЕЛЕНИЯ БЕЛКОВ Высаливание - процесс осаждения белка из раствора под действием соли - снимается только
- 44. Мономеры или структурные звенья белков. Их можно определить путем кислотного гидролиза белков. Мономерами белков являются α-аминокислоты
- 45. ОБРАЗОВАНИЕ ДИПЕПТИДА СТРОЕНИЕ ПЕПТИДА
- 46. Сложная структурная организация. Белки обладают сложной пространственной организацией для реализации биологической активности Белкам присуща денатурация, что
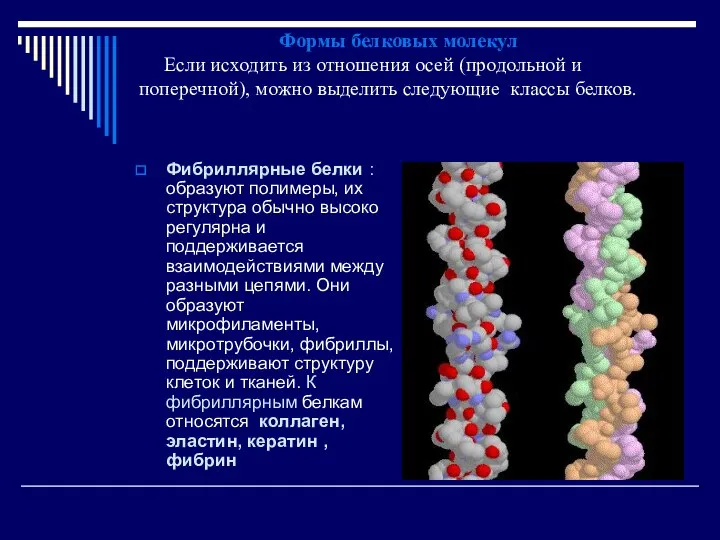
- 47. Классификация белков по форме молекул (глобулярные или фибриллярные); по молекулярной массе (низкомолекулярные, высокомолекулярные и др.); по
- 48. Классификация белков по локализации в организме (белки крови, печени, сердца и др.); по возможности адаптивно регулировать
- 49. Формы белковых молекул Если исходить из отношения осей (продольной и поперечной), можно выделить следующие классы белков.
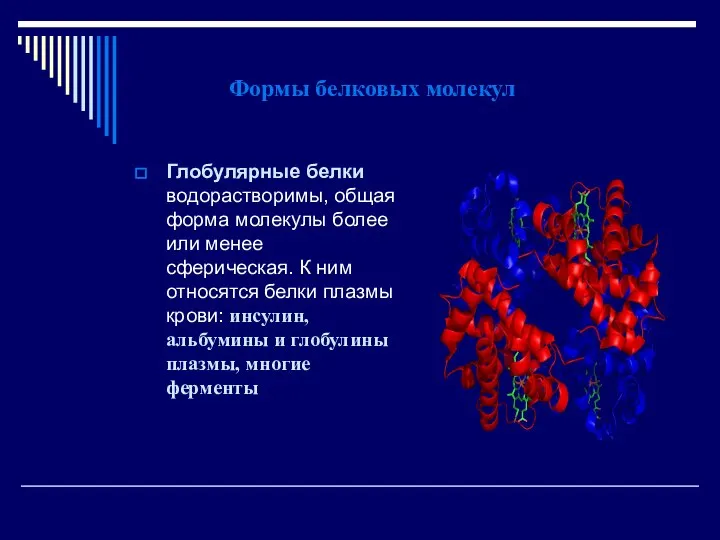
- 50. Формы белковых молекул Глобулярные белки водорастворимы, общая форма молекулы более или менее сферическая. К ним относятся
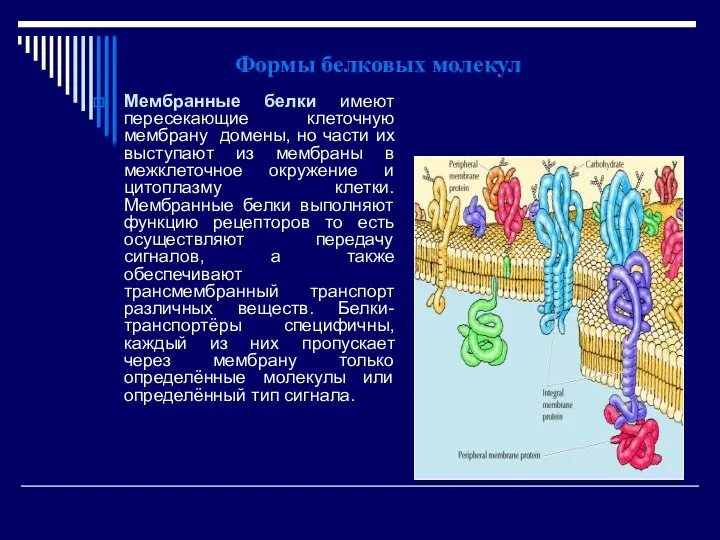
- 51. Формы белковых молекул Мембранные белки имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны
- 52. Функции белков Каталитическая Ферменты Сократительная Актин, миозин Регуляция работы генов Гистоны, негистоновые ядерные белки Гормональная Обмен
- 53. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА Первичная структура Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом,
- 54. Вторичная структура Пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав белка. Вторичная
- 55. Основные характеристики α-спирали 1. α-Спираль стабилизируется водородными связями между атомом водорода, присоединенным к атому азота пептидной
- 56. Основные характеристики α-спирали 4. α-Спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму
- 57. α -Спираль С=О и N-Н – ковалентные связи -О….Н- - водородные связи
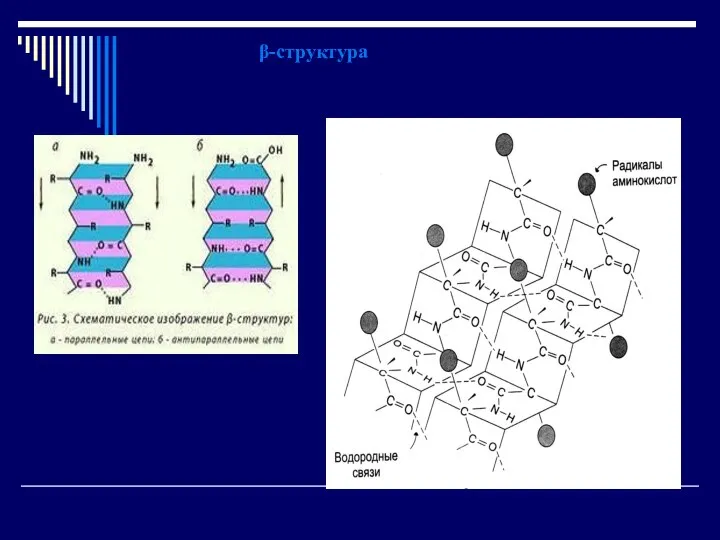
- 58. β-структура Это слоистые структуры, образуемые при сочетании участков полипептидной цепи, находящихся в β-конформации, т.е. в виде
- 59. β-структура
- 60. Третичная структура Это трехмерная пространственная структура, образующаяся за счет взаимодействий между радикалами аминокислот, которые могут располагаться
- 61. Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому располагаются на поверхности белков. Они
- 62. ТИПЫ СВЯЗЕЙ, ВОЗНИКАЮЩИХ ПРИ ФОРМИРОВАНИИ ТРЕТИЧНОЙ СТРУКТУРЫ БЕЛКА 1.ИОННЫЕ СВЯЗИ 2.ВОДОРОДНЫЕ СВЯЗИ 3.ГИДРОФОБНЫЕ СВЯЗИ 4.ДИСУЛЬФИДНЫЕ СВЯЗИ
- 63. Четвертичная структура Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не
- 64. Многие олигомерные белки содержат два или четыре протомера и называются димерами или тетрамерами соответственно. Олигомерные белки
- 65. Формирование трехмерной структуры белков – важный биологический процесс, т.к. от него зависит их биологическая функция. Процесс
- 66. Шапероны, защищающие белки от денатурирующих воздействий, относят к белкам теплового шока (БТШ). При действии стрессовых факторов
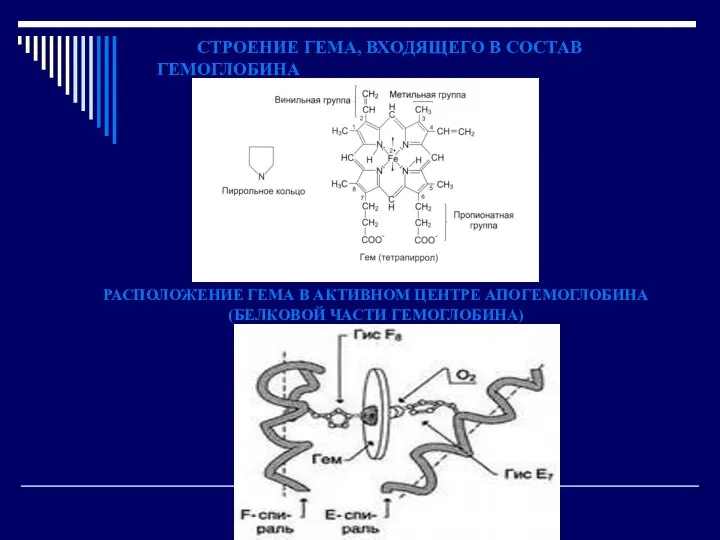
- 69. Наиболее изученный пример белка, имеющего четвертичную структуру - гемоглобин. Молекула гемоглобина построена из 4-субъединиц с молекулярной
- 70. Большой интерес представляет интерес взаимосвязи структуры гемоглобина с его функцией – способностью связывать, переносить и отдавать
- 71. СТРОЕНИЕ ГЕМА, ВХОДЯЩЕГО В СОСТАВ ГЕМОГЛОБИНА РАСПОЛОЖЕНИЕ ГЕМА В АКТИВНОМ ЦЕНТРЕ АПОГЕМОГЛОБИНА (БЕЛКОВОЙ ЧАСТИ ГЕМОГЛОБИНА)
- 72. ДЕНАТУРАЦИЯ Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной структуры белка, легко разрушаются, что
- 73. Денатурация При воздействии на белки определенными агентами может нарушаться пространственная структура белка. Первичная структура не изменяется,
- 74. Большинство белков теряют биологическую активность в присутствии кислот или оснований, мочевины, тяжелых металлов (Ag, Pb, Hg),
- 75. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов глутаминовой и аспарагиной кислот и катионных
- 76. Изменение суммарного заряда аминокислот в зависимости от рН среды
- 77. Если полипептидная цепь белка содержит более 200 аминокислот, то ее пространственная структура сформирована в виде двух
- 79. Соединение, с которым взаимодействует белок, называется лигандом (субстраты ферментов, кофакторы (ионы металлов), ингибиторы (ацетилхолин – нейромедиатор,
- 81. Скачать презентацию




































































 Социодинамика общества и культуры: развитие, прогресс, кризис
Социодинамика общества и культуры: развитие, прогресс, кризис Организация методической работы с педагогами в целях повышения качества обучения. К выступлению за заседании педагогического со
Организация методической работы с педагогами в целях повышения качества обучения. К выступлению за заседании педагогического со Выявление туберкулеза у детей и подростков Сделано: Пиджакова М.Г., учитель ГООУ «Санаторно – лесная школа»
Выявление туберкулеза у детей и подростков Сделано: Пиджакова М.Г., учитель ГООУ «Санаторно – лесная школа» Студия компьютерного мастерства
Студия компьютерного мастерства Французский материализм Поля Гольбаха Презентация выполнена студенткой 1 курса экономического факультета Кузнецовой А.И
Французский материализм Поля Гольбаха Презентация выполнена студенткой 1 курса экономического факультета Кузнецовой А.И Архитектура России в XVII веке
Архитектура России в XVII веке СТРУКТ-ФУНКЦ ОРГАНИЗАЦИЯ ИС
СТРУКТ-ФУНКЦ ОРГАНИЗАЦИЯ ИС Прикладные программы
Прикладные программы  Помогите Винни дойти до школы
Помогите Винни дойти до школы Чёрное море Презентацию подготовила ученица 4 Б класса ГОУ СОШ № 2031 Домненко Екатерина
Чёрное море Презентацию подготовила ученица 4 Б класса ГОУ СОШ № 2031 Домненко Екатерина Общие сведения о деталях машин
Общие сведения о деталях машин Числівник. Тест
Числівник. Тест Направление подготовки 080100 Экономика Направление подготовки 080100 Экономика Профиль подготовки магистерская программа «Эконо
Направление подготовки 080100 Экономика Направление подготовки 080100 Экономика Профиль подготовки магистерская программа «Эконо Презентация____
Презентация____ Talk 2-Plant Cells
Talk 2-Plant Cells Сделки в гражданском праве
Сделки в гражданском праве  Мой отец на войне. Королев Игорь Владимирович
Мой отец на войне. Королев Игорь Владимирович Развитие баскетбола
Развитие баскетбола Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны
Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны WEB – бағдарламалау негіздері
WEB – бағдарламалау негіздері Методики управления. (занятие 6)
Методики управления. (занятие 6) Конструкторские документы 3D сборки «Редуктор Червячный»
Конструкторские документы 3D сборки «Редуктор Червячный» Склифосовский Николай Васильевич (1836 - 1904)
Склифосовский Николай Васильевич (1836 - 1904)  Алгебра 9 класс
Алгебра 9 класс  Экспертная технология
Экспертная технология SEO Коучинг. Семантическое ядро. часть 2
SEO Коучинг. Семантическое ядро. часть 2 Мотивация обучения – основное условие успешности обучения
Мотивация обучения – основное условие успешности обучения Обычаи французского брака
Обычаи французского брака