Содержание
- 2. Когда атомы сближаются друг с другом, образуя твердое тело, взаимодействие между ними оказывает возмущающее действие на
- 3. Некоторые свойства полос энергетических уровней совершенно очевидны. Во-первых, энергия связи твердого тела должна обусловливаться сдвигом энергетических
- 4. Чтобы уяснить физическое происхождение энергетической структуры кристалла, следует детально рассмотреть по крайней мере три задачи: 1)
- 5. Атомы отталкиваются при сближении друг с другом в основном потому, что каждому данному электронному состоянию соответствует
- 6. Таким образом, когда атомы оказываются слишком близко друг к другу, их полная энергия возрастает. Это эквивалентно
- 7. Для электрона, находящегося в какой-то момент времени на орбите одного из атомов, существует конечная вероятность того,
- 8. Волновые функции электронов, расположенных ниже валентной оболочки, сильнее локализованы вблизи ядра, чем волновые функции валентных электронов,
- 9. Кристаллическое и аморфное состояние вещества. Вещество в окружающем нас трехмерном мире может находиться в четырех агрегатных
- 10. С точки зрения микроэлектроники и наноэлектроники наиболее интересным и перспективным является твердое агрегатное состояние вещества, поскольку
- 11. До недавнего времени принято было считать, что только кристаллическая структура может претендовать на гордое название твердого
- 12. Особенностью строения кристаллических веществ является наличие корреляции во взаимном расположении атомов (молекул) на расстояниях больших, чем
- 13. Кристаллическое состояние рассматривается большинством исследователей как частный, и далеко не самый интересный случай твердого тела. Подавляющее
- 14. Аморфные твердые тела, подобно кристаллическим, могут быть диэлектриками, полупроводниками и металлами. Одни из аморфных тел весьма
- 15. Полученные экспериментальные данные свидетельствуют о существовании в аморфных твердых телах, так же как и в кристаллах,
- 16. Аморфные диэлектрики, стекла и керамика имеют исключительно перспективное будущее. Достаточно сказать, что в списке двадцати наивысших
- 17. Если интерес к аморфным диэлектрикам носит ошеломляющий характер, то интерес к новому классу материалов - аморфным
- 18. При нагревании в аморфных металлах происходят структурные изменения. В отличие от обычных оксидных стекол, которые при
- 19. Энергия связи в кристаллической решетке. Проблема связи атомов в твердых телах вследствие одинаковой природы сил взаимодействия
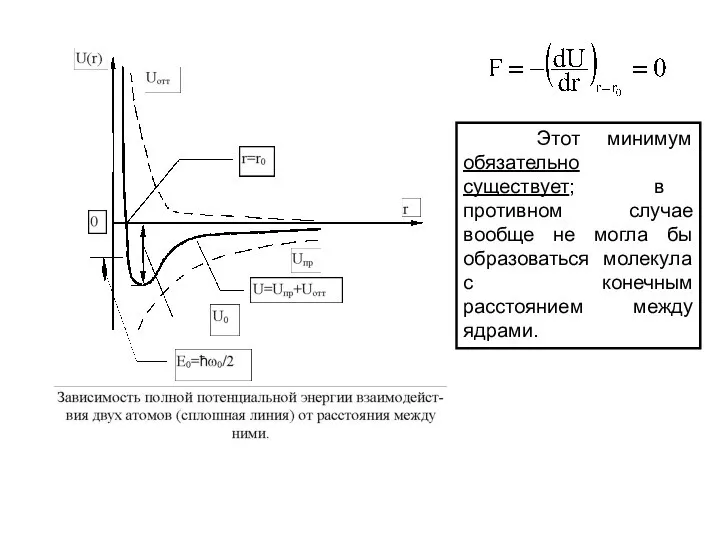
- 20. Атомы не взаимодействуют друг с другом до тех пор, пока расстояние r между ними велико по
- 21. Этот минимум обязательно существует; в противном случае вообще не могла бы образоваться молекула с конечным расстоянием
- 22. При дальнейшем сближении атомов между ними начинают действовать силы отталкивания, которые быстро возрастают с уменьшением r
- 23. При расстоянии r = r0, соответствующем минимуму энергии системы, силы притяжения уравновешиваются силами отталкивания. При этом
- 24. Из данного выражения следует, что при не слишком больших отклонениях атома от положения равновесия (когда третьим
- 25. За начальное состояние системы обычно принимают такое состояние, когда частицы (атомы, молекулы, ионы) находятся друг от
- 26. Конечное состояние отвечает равновесному расположению частиц системы при Т = 0 К. Для оценки энергии связи,
- 27. При m = 1 потенциал сил притяжения соответствует обычному кулоновскому взаимодействию между противоположно заряженными ионами, а
- 28. При выводе формулы для потенциала сил отталкивания Борном и Ланде была выбрана статическая модель атома, в
- 29. Квантово − механический расчет, выполненный Борном и Майером, привел для потенциала сил отталкивания к полуэмпирическому выражению,
- 30. Зависимость энергии связи в кристаллах от межатомного расстояния r, так же как и в молекулах, определяется
- 31. Энергия связи (или энергия сцепления) кристалла представляет собой энергию, которая необходима для разделения тела на составные
- 32. Молекулярная связь и молекулярные решетки. К молекулярным кристаллам относят твердые тела, в узлах кристаллической решетки которых
- 33. В молекулярных кристаллах частицы удерживаются вместе слабыми силами Ван-Дер-Ваальса (В-Д-В). Энергия сцепления весьма мала, порядка 0,02
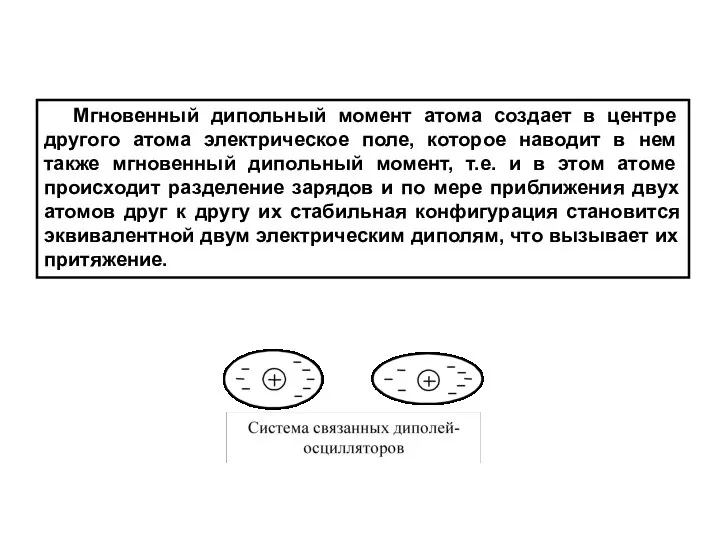
- 34. В среднем распределение заряда в изолированном атоме имеет сферическую симметрию, атом электронейтрален и центры зарядов лежат
- 35. Мгновенный дипольный момент атома создает в центре другого атома электрическое поле, которое наводит в нем также
- 36. Такую систему можно рассматривать как систему из двух гармонических осцилляторов. Квантово-механический расчет сил притяжения для системы
- 37. Уменьшение энергии системы соответствует возникновению силы притяжения между осцилляторами, которая изменяется обратно пропорционально седьмой степени расстояния
- 38. При перекрывании электронных оболочек электроны первого атома стремятся частично занять состояния второго, и при перекрытии оболочек
- 39. Чем выше атомный номер, тем больше энергия сцепления и температура плавления молекулярных кристаллов. С ростом Z
- 40. Физические свойства кристаллов с чисто В-Д-В связями: 1. По электрическим свойствам − изоляторы, прозрачные для электромагнитного
- 41. Молекулярную решетку имеют и впервые полученные в 1985 г. новые углеродные соединения − фуллериты, имеющие кристаллическую
- 42. Ионная связь и ионные решетки. Ионные кристаллы - это соединения с преобладающим ионным характером химической связи,
- 43. Атом натрия, имея один валентный электрон, стремится его отдать, а атом хлора, у которого не хватает
- 44. Понижение номинальных зарядов атомов свидетельствует о том, что даже при взаимодействии наиболее электроотрицательных и электроположительных элементов
- 45. При расчете энергии сцепления ионных кристаллов обычно исходят из простых классических представлений, считая, что ионы находятся
- 46. Выражение для энергии взаимодействия между двумя ионами i и j, находящимися на расстоянии rij друг от
- 47. Здесь − структурные суммы. Структурная сумма А получила название постоянной Маделунга, она зависит от координационного числа
- 48. Электропроводность ионных кристаллов значительно ниже, чем у металлов и при комнатных температурах различие составляет по крайней
- 49. Ионные кристаллы прозрачны для электромагнитного излучения почти всех частот вплоть до некоторой граничной частоты, называемой основной
- 51. Скачать презентацию














































 Выстрел в сердце… сердце…2008 год. -Мне показалось, что я вообще никому здесь не нужна. Так тяжело было, словами не передать... И в какой-то момент я назло. - презентация_
Выстрел в сердце… сердце…2008 год. -Мне показалось, что я вообще никому здесь не нужна. Так тяжело было, словами не передать... И в какой-то момент я назло. - презентация_ Русская изба
Русская изба Культ огня у карел
Культ огня у карел Prezentatsia1_urok_rf_pdd
Prezentatsia1_urok_rf_pdd Свободно-радикаль. №2 лекция
Свободно-радикаль. №2 лекция Метод конечных элементов
Метод конечных элементов Организация и планирование образовательного процесса в соответствии с ФГТ Для конструирования оптимальной модели образовате
Организация и планирование образовательного процесса в соответствии с ФГТ Для конструирования оптимальной модели образовате Коррекционно-развивающее занятие по развитию связной речи «Составление рассказа-описания» Николаева Жаннета Юрьевна, учитель
Коррекционно-развивающее занятие по развитию связной речи «Составление рассказа-описания» Николаева Жаннета Юрьевна, учитель  Презентация Экономическая безопасность и реальный сектор экономики
Презентация Экономическая безопасность и реальный сектор экономики Язык разметки XML. Объектно - ориентированное программирование
Язык разметки XML. Объектно - ориентированное программирование Три стадии напряженно-деформированного состояния железобетонных конструкций
Три стадии напряженно-деформированного состояния железобетонных конструкций Теплотехнические расчеты изотермических вагонов и контейнеров
Теплотехнические расчеты изотермических вагонов и контейнеров  Экваториальные леса Африки
Экваториальные леса Африки Тело как метафора
Тело как метафора Проект Внедрение Федеральных государственных образовательных стандартов начального общего образования в Вадском районе
Проект Внедрение Федеральных государственных образовательных стандартов начального общего образования в Вадском районе Системно — деятельностный подход в обучении — основа ФГОС - презентация для начальной школы
Системно — деятельностный подход в обучении — основа ФГОС - презентация для начальной школы Часы. Общие сведения
Часы. Общие сведения Полупроводники. Диоды на основе p-n переходов
Полупроводники. Диоды на основе p-n переходов Великий Лікар. William Hunter (p. 1859), J. H. Stockton
Великий Лікар. William Hunter (p. 1859), J. H. Stockton Jim Carrey is a comedian and actor best
Jim Carrey is a comedian and actor best Презентация Мировая экономика. Строение и структура
Презентация Мировая экономика. Строение и структура  Мода и стиль в жизни современной женщины
Мода и стиль в жизни современной женщины Урок В программе Photoshop по заполнению шрифта изображением
Урок В программе Photoshop по заполнению шрифта изображением Платежный баланс
Платежный баланс  Дадаизм и Сюрреализм в Западной Европе
Дадаизм и Сюрреализм в Западной Европе Презентация "Русский модерн в живописи" - скачать презентации по МХК
Презентация "Русский модерн в живописи" - скачать презентации по МХК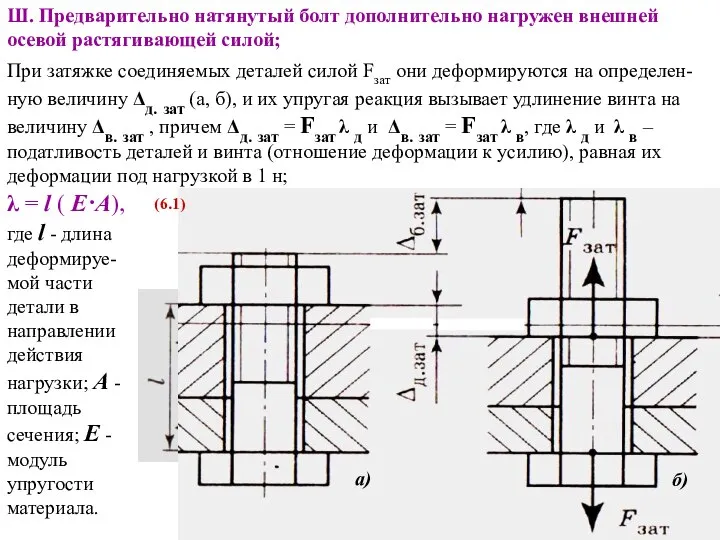 Расчет стержня детали на прочность при действии нагрузки от затяжки соединения, приложенной параллельно оси эксцентрично
Расчет стержня детали на прочность при действии нагрузки от затяжки соединения, приложенной параллельно оси эксцентрично Технология успеха. Успех и целеполагание. Стратегии достижения успеха. Гибкость и устойчивость в достижении успеха
Технология успеха. Успех и целеполагание. Стратегии достижения успеха. Гибкость и устойчивость в достижении успеха