Содержание
- 2. Свойство материи - развитие – изменение, характеризующееся необратимостью, направленностью и закономерностью. Материя состоит из различного типа
- 3. Виды материи частицы которых не имеют массы покоя – поля. Электрон имеет заряд –1,602·10-19 Кл. Заряд
- 4. Между элементарными частицами совершаются взаимодействия, которые на сильные, электромагнитные и слабые. Сильные: обуславливают связь частиц в
- 5. Энергия – мера движения и взаимодействия всех видов материи. Каждое тело, изменяющее энергию (ΔЕ), одновременно изменяет
- 6. ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА. Этапы изучения строения атома: 1) Изучение электрических разрядов в газах доказало, что атом
- 7. 4) В 1909 г. Р. Малликен определил заряд электрона: 1,6·10-19 Кл. 5) В 1910 г. в
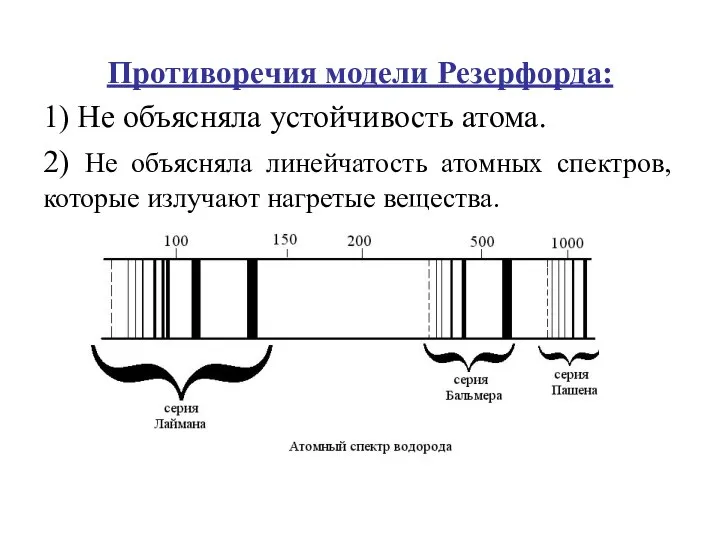
- 8. Противоречия модели Резерфорда: 1) Не объясняла устойчивость атома. 2) Не объясняла линейчатость атомных спектров, которые излучают
- 9. Связь между частотой ν и энергией Е=hν, h–постоянная Планка 6,62·10-34 Дж·с. Зависимости между линиями спектра: n
- 10. Наибольшая энергия заключена в УФ- области в спектре линий Лаймана (n=1) m=2,3,4,5… Далее идет видимая область
- 11. Квантово-механическая модель атома 1) Энергия распространяется и передается, поглощается и испускается не непрерывно, а дискретно-отдельными порциями.
- 12. Постулат Планка Энергия (Е) излучается и поглощается отдельными порциями – квантами, пропорциональными частоте колебаний излучения (υ).
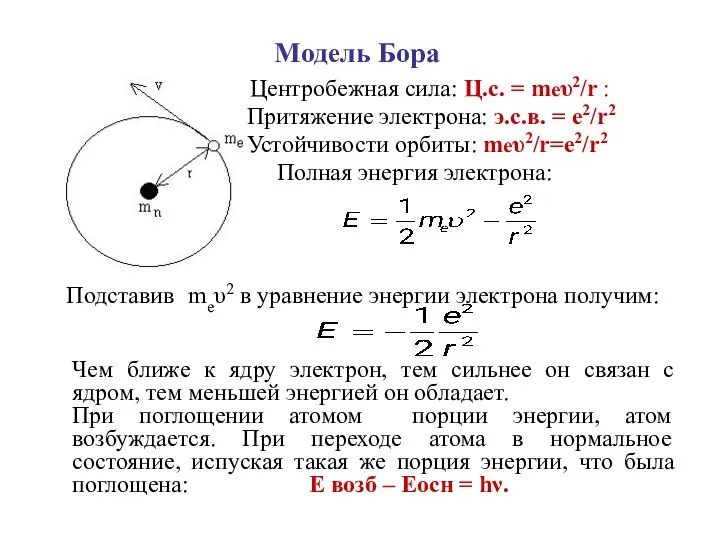
- 13. Модель Бора Центробежная сила: Ц.с. = mеυ2/r : Притяжение электрона: э.с.в. = е2/r2 Устойчивости орбиты: mеυ2/r=е2/r2
- 14. Постулаты Бора: Первый постулат: Атомы могут существовать не изменяя своей энергии, т.е. не излучая и не
- 15. Предположение де Бройля: электроны (как и все частицы) при движении проявляют свойства волны. Масса фотона: Е
- 16. Согласно уравнению де Бройля: любой частице с массой m, движущейся со скоростью υ, соответствует волна длины
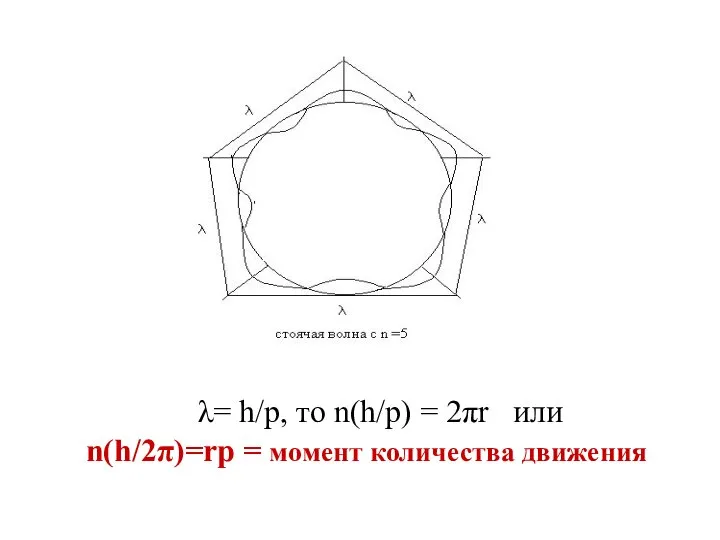
- 17. λ= h/р, то n(h/р) = 2πr или n(h/2π)=rр = момент количества движения
- 18. Принцип дополнительности: Электрон не может одновременно обладать и волновыми, и корпускулярными свойствами; однако для описания реального
- 19. Материя (вещество и поле) обладает одновременно и корпускулярными и волновыми свойствами. С уменьшением массы частицы её
- 20. Неопределенность положения и скорости Условие устойчивости орбиты: mеυ2/r = е2/r2 Отсюда: υ2 = е2/mr (1) Момент
- 21. Приравняв (1) и (2) и вычислим радиус: r =n2h2/4π2mе2 Радиус принимает дозволенные, дискретные значения, зависящие от
- 22. Принцип неопределенности: В любой момент времени невозможно определить и положение в пространстве, и скорость (импульс) электрона.
- 23. Волновое уравнение Шредингира первые три члена – это сумма вторых производных волновой функции по координатам х,
- 24. Решение уравнения Шредингира для атома водорода ψnlml = [N][Rnl(r)][Фlml (х/r, у/r, z/r)] N – постоянная нормировки.
- 25. ψ зависит от трех пространственных координат. Электрон может находиться в любом месте пространства. В области, где
- 26. ψ-функция для 1s, 2s, 3s подуровней принимает разные значения. Для 2s и 3s орбиталей ψ может
- 27. Квантовые числа Главное квантовое число n определяет энергию и размеры электронных орбиталей. Оно принимает значения: 1,2,3,4,5...Чем
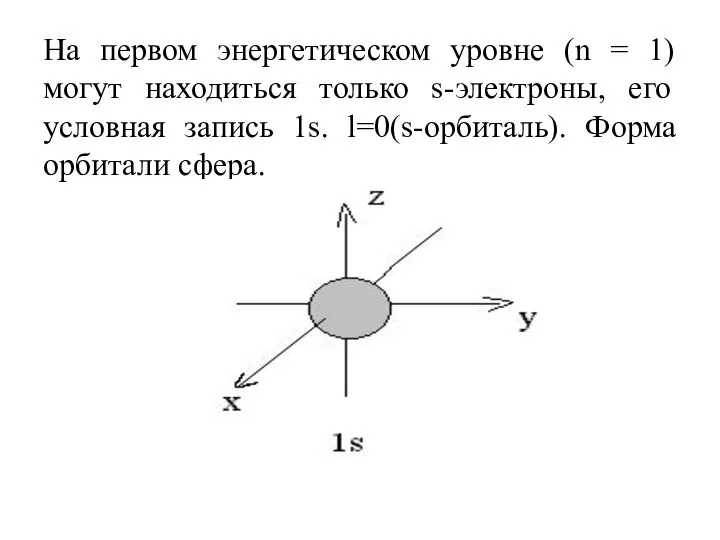
- 28. На первом энергетическом уровне (n = 1) могут находиться только s-электроны, его условная запись 1s. l=0(s-орбиталь).
- 29. При n = 2 орбитальное квантовое число имеет два значения: l = 0 (s- электроны) и
- 30. При n = 3 орбитальное квантовое число имеет три значения: 1=0, l=1 и 1=2. 1=2 (d-электроны).
- 31. Электроны с 1=3 называют f–электронами, у них форма орбитали ещё более сложная, чем у d–электронов. На
- 32. m - магнитное квантовое число – характеризует ориентацию орбитали в пространстве. Принимает целые значения от -l
- 33. s-подуровни в несильном постоянном магнитном поле не расщепляются. р-подуровни расщепляются в магнитном поле на три близкие
- 34. Четвертое квантовое число - спиновое, обозначается ms, характеризует не орбиталь: а сам электрон. Оно моделируется моментом
- 35. Строение многоэлектронных атомов Принцип Паули: в атоме не может быть двух электронов, у которых были бы
- 36. Электроны, находящиеся на одной орбитали имеющие одинаковые значения квантовых чисел , кроме спинового квантового числа, называются
- 37. Вещества с неспаренными электронами парамагнитны. Они проводят магнитные силовые линии лучше, чем вакуум, и магнитное поле
- 38. Вещества, у которых все электроны спаренные- диамагнитны. Они проводят магнитные силовые линии хуже, чем вакуум и
- 39. Максимальное число электронов (энергетическая емкость): на энергетическом уровне N = 2n2 и на подуровне: N =
- 40. Принцип наименьшего запаса энергии (минимума энергии): Наиболее устойчивому состоянию электрона в атоме отвечает минимальная из возможных
- 41. На какой подуровень электрон должен сперва вступать на 4s или на 3d для 4s: для 3d:
- 42. В каком порядке будут заполняться 3d, 5s, 4р орбитали? для 3d: для 4р: для 5s: n=3
- 43. Порядок заполнения подуровней: 1s 3d
- 44. Правило Хунда (Гунда): на данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин
- 45. Электроны верхнего заполняемого слоя - валентными электронами. Например, электронная конфигурация валентного уровня кремния в основном состоянии:
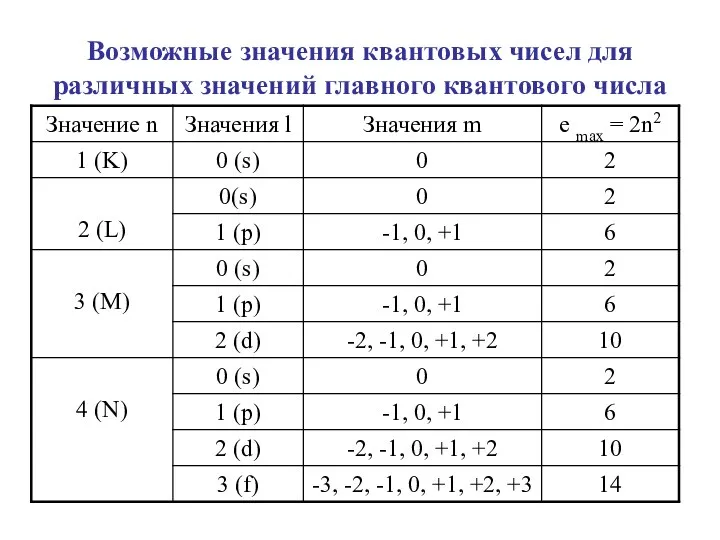
- 46. Возможные значения квантовых чисел для различных значений главного квантового числа
- 47. Подуровни р, d, f обладают повышенной устойчивостью, когда они не заполнены, заполнены наполовину (неспаренными электронами) и
- 48. Энергетические характеристики атомов Энергия ионизации (I) - энергия, необходимая для удаления одного моля электронов от одного
- 49. Характеризует восстановительную способность вещества. Энергия ионизации возрастает с увеличением их номеров I1 Резкое увеличение I наблюдается
- 51. Скачать презентацию



















![Решение уравнения Шредингира для атома водорода ψnlml = [N][Rnl(r)][Фlml (х/r, у/r,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294712/slide-23.jpg)























 Методика анализа конкурентов 1.Основные компоненты анализа конкурентов 2. Карта стратегических групп 3. Ключевые факторы успеха
Методика анализа конкурентов 1.Основные компоненты анализа конкурентов 2. Карта стратегических групп 3. Ключевые факторы успеха Этнология как наука
Этнология как наука ОСОБЕННОСТИ ОЦЕНКИ ФИНАНСОВЫХ ВЛОЖЕНИЙ
ОСОБЕННОСТИ ОЦЕНКИ ФИНАНСОВЫХ ВЛОЖЕНИЙ Источники получения данных о единице совокупности.
Источники получения данных о единице совокупности. Презентация Отмена крепостного права
Презентация Отмена крепостного права Статистические таблицы
Статистические таблицы Старший воспитатель ГБДОУ детского сада № 30 Невского района Санкт-Петербурга – Петухова Наталья Владимировна
Старший воспитатель ГБДОУ детского сада № 30 Невского района Санкт-Петербурга – Петухова Наталья Владимировна Основы логики
Основы логики Отчет за октябрь. Отряд Знайки. 3 класс
Отчет за октябрь. Отряд Знайки. 3 класс HTC VIVE – Реальные Сны!
HTC VIVE – Реальные Сны! Классный час Тема «Тренируем память. Виды памяти. Приемы запоминания» Память — кладовая ума Пословица
Классный час Тема «Тренируем память. Виды памяти. Приемы запоминания» Память — кладовая ума Пословица  Жоба осіне қатысты полигонометрлік нүктелердің орналасуын анықтау әдістері түзусызықты және қисықсызықты құрылымдар
Жоба осіне қатысты полигонометрлік нүктелердің орналасуын анықтау әдістері түзусызықты және қисықсызықты құрылымдар Технология возведения зданий и сооружений из монолитного железобетона. (Тема 5.2)
Технология возведения зданий и сооружений из монолитного железобетона. (Тема 5.2) Презентация на тему: Орнамент
Презентация на тему: Орнамент Авиатехникум. Технология метало-обрабатывающего производства
Авиатехникум. Технология метало-обрабатывающего производства Выполнила студентка 3 курса группы «В» Кузнецова Н. Москва 2008
Выполнила студентка 3 курса группы «В» Кузнецова Н. Москва 2008 Хлор в организме человека
Хлор в организме человека Латынь - числительные (Cardinalia)
Латынь - числительные (Cardinalia) Использование информационных технологий как средства развития ключевых компетентностей учащихся в обучении биологии
Использование информационных технологий как средства развития ключевых компетентностей учащихся в обучении биологии Аттестационная работа. Методическая разработка по выполнению проекта «Что в имени моём?». 3 класс
Аттестационная работа. Методическая разработка по выполнению проекта «Что в имени моём?». 3 класс Разработка проекта информатизации в организации по обслуживанию оргтехники
Разработка проекта информатизации в организации по обслуживанию оргтехники Святитель Николай Мирликийский, Чудотворец. День памяти - 19 декабря
Святитель Николай Мирликийский, Чудотворец. День памяти - 19 декабря Операционные системы. Межпроцессное взаимодействие. Передача информации между процессами через Win32 API
Операционные системы. Межпроцессное взаимодействие. Передача информации между процессами через Win32 API Разработка и проектирование лабораторного стенда таймера. Судовая РЛС применяемая в рыбопромысловом флоте
Разработка и проектирование лабораторного стенда таймера. Судовая РЛС применяемая в рыбопромысловом флоте Изложение (2 класс)
Изложение (2 класс) Устройство нашего храма
Устройство нашего храма Достопримечательности Москвы
Достопримечательности Москвы Спортивная форма футбольных команд Англии, Уэльса и Шотландии
Спортивная форма футбольных команд Англии, Уэльса и Шотландии