Содержание
- 2. Виды систем: изолированная - не обменивается ни веществом, ни энергией (в природе такие системы не существуют);
- 3. Компоненты - химические вещества, входящие в состав системы. Число независимых компонентов в системе: n компонентов =
- 4. Гомогенная система одинакова по составу, структуре и свойствам во всех своих микроучастках. Гетерогенная система состоит из
- 5. Состояние системы характеризуется экстенсивными и интенсивными параметрами. Экстенсивные параметры зависят от количества вещества, находящегося в системе.
- 6. Термодинамическое состояние системы равновесно, если его термодинамические параметры одинаковы во всех точках системы, и не изменяются
- 7. Некоторые параметры могут остаться без изменения. Р = const - процесс изобарный V = const -
- 8. Характеристические функции. Не зависят от способа (пути) достижения данного состояния системы, а определяются состоянием системы. К
- 9. Внутренняя энергия (U) системы - её полная энергия, которая складывается из кинетической и потенциальной энергий молекул,
- 10. ΔU>0 -происходит поглощение энергии из внешней среды (эндотермические реакции). ΔU Внутренняя энергия - способность системы к
- 11. Теплота Q, подведённая к системе, расходуется на увеличение её внутренней энергии ΔU и на совершение системой
- 12. А= р·ΔV Q = ΔU + pΔV Q = (U2+pV2) - (U1+pV1) U+р·V = Н ∆Н=∆U+р·∆V
- 13. Энтальпия. Тепловой эффект или энтальпия реакции- это изменение энергии системы при протекании в ней химических реакций
- 14. Тепловой эффект химической реакции - это количество энергии (тепла), которое должно быть получено продуктами реакции (или
- 15. Теплоемкость Теплоёмкость - количество теплоты, которое необходимо подвести к телу, чтобы повысить его температуру на 1
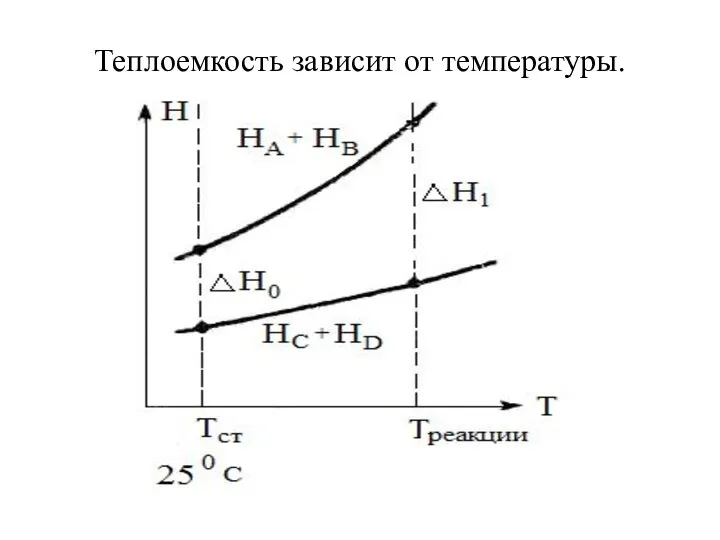
- 16. Теплоемкость зависит от температуры.
- 17. Закон Кирхгоффа Увеличение теплового эффекта при повышении температуры на 10С равняется разности между теплоемкостью исходных веществ
- 18. Расчет теплоемкости При постоянном объеме: СV = dQV/dT СV -теплоемкость при постоянном объеме, кДж/моль·град; dQV -
- 19. Энтальпия образования Тепловой эффект реакции образования одного моля сложного вещества из простых веществ называется энтальпией образования
- 20. Энтальпия образования соединений из элементов одного и того же периода периодической системы уменьшается по мере увеличения
- 21. 3) Энтальпия образования соединений одного и того же металла с металлоидами одной и той же группы
- 22. Правило термохимической логарифмики: Энтальпия образования неорганических соединений элементов одного ряда или одной подгруппы периодической системы, отнесенная
- 23. 4) Энтальпия присоединения каждого следующего атома к металлу меньше, чем предыдущего: ΔН0(FeC12)= -341,45 кДж/моль ΔН0(FeC13) =
- 24. Стандартное состояние - реальное, состояние вещества при данной температуре и давлении 101,3 кПа (1атм) в термодинамически
- 25. Стандартные энтальпии образования простых веществ принимают равными нулю, если их агрегатные состояния и модификации устойчивы при
- 26. Термохимическое уравнение - уравнение химической реакций, в котором указан его тепловой эффект. Признаки термохимического уравнения: 1)
- 27. Первый закон термохимии закон Лавуазье - Лапласа Количество тепла, поглощающегося (выделяющегося) при разложении какого-либо сложного вещества
- 28. Второй закон термохимии (закон Гесса) Тепловой эффект ряда последовательных реакций равен тепловому эффекту любого другого ряда
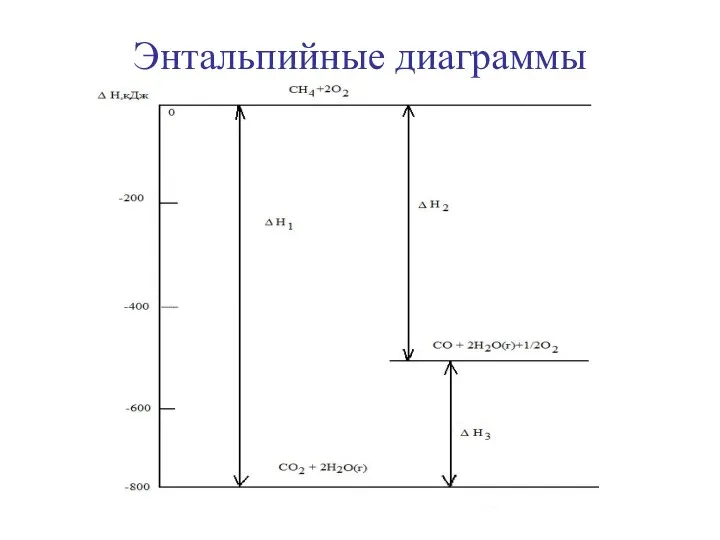
- 29. Энтальпийные диаграммы
- 30. Следствия из закона Гесса 1) тепловой эффект химической реакции (ΔН0х.р.) равен сумме теплот (энтальпий) образования продуктов
- 31. 2)Значение энтальпии прямой и обратной реакций численно равны, но противоположны по знаку. ΔН0(прямого процесса)=-ΔН0(обратного процесса) 3)Если
- 32. Теплота сгорания Теплота сгорания органического соединения - это количество теплоты, которое выделяется при полном сгорании 1
- 33. Удельная теплота сгорания Qт равна количеству теплоты, выделяющейся при сгорании 1 кг жидкого или твердого вещества
- 34. Связь внутренней энергии и энтальпии. ΔU0=ΔH0-Δn·R·T ΔU0 - изменение внутренней энергии системы, кДж/моль; ΔH0 - изменение
- 35. Энтальпия нейтрализации - количество теплоты, выделяющееся при взаимодействии одного моля-эквивалента кислоты с одним молем - эквивалента
- 36. Энергия атомизации - энергия, необходимая для разрыва связей в 1 моле простого вещества и превращения его
- 37. Энергия возгонки (энергия сублимации) - энергия, требующаяся для возгонки (перехода из твердого состояния в газообразное) одного
- 38. Энергия кристаллической решетки - энергия, необходимая для разрушения 1 моля кристаллического вещества и удаления образовавшихся атомов
- 39. Энергия ионной кристаллической решетки - работа, которую необходимо затратить для разрушения одного моля кристаллического вещества на
- 40. Уравнение Борна U=-(Z1·Z2·e2)/r+(b·e2/r·n) где Z1 и Z2 - величины зарядов катиона и аниона (т.е. формальные валентности);
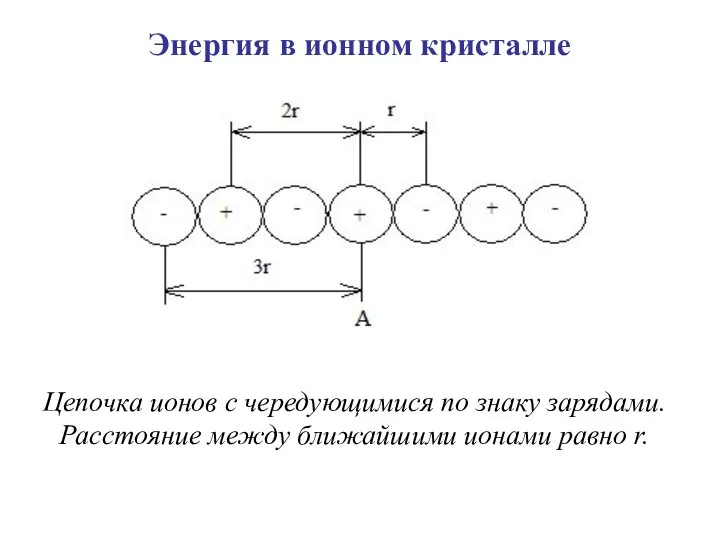
- 41. Энергия в ионном кристалле Цепочка ионов с чередующимися по знаку зарядами. Расстояние между ближайшими ионами равно
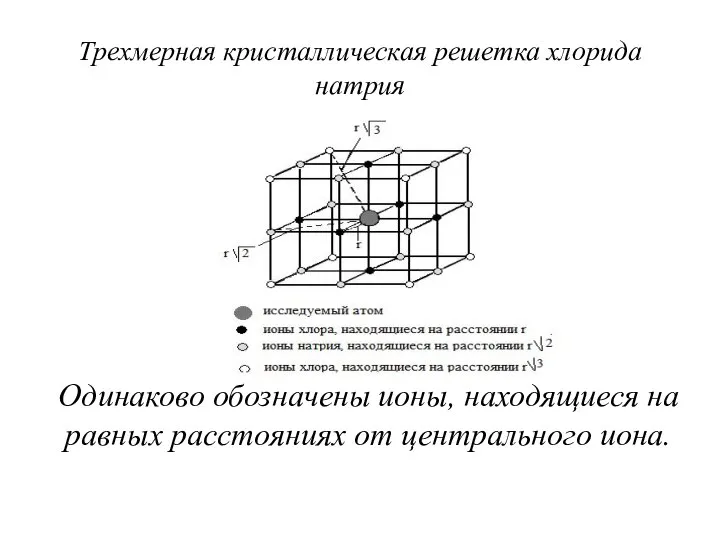
- 42. Трехмерная кристаллическая решетка хлорида натрия Одинаково обозначены ионы, находящиеся на равных расстояниях от центрального иона.
- 43. Энергия притяжения иона с другими ионами в кристалле Епр=-2·ln2·e2/r Притяжение одного моля ионов в кристалле: Eпр=N·(e2/r)·(6/√1-12/√2+8/√3-6/√4+24/√5-…)
- 44. Уравнение Борна для кристалла U = (-αм ·N·e2·Z1·Z2/r) + (β·e2/r·n) β=N·b - структурная постоянная, учитывающая степень
- 45. Термодинамические свойства плеяд Ряд соединений, образуемых одной парой элементов, один из которых имеет переменную валентность, называется
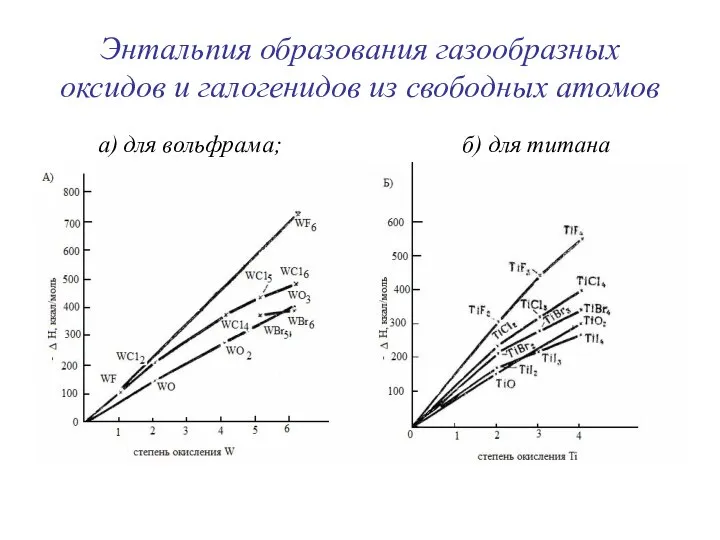
- 46. Энтальпия образования газообразных оксидов и галогенидов из свободных атомов а) для вольфрама; б) для титана
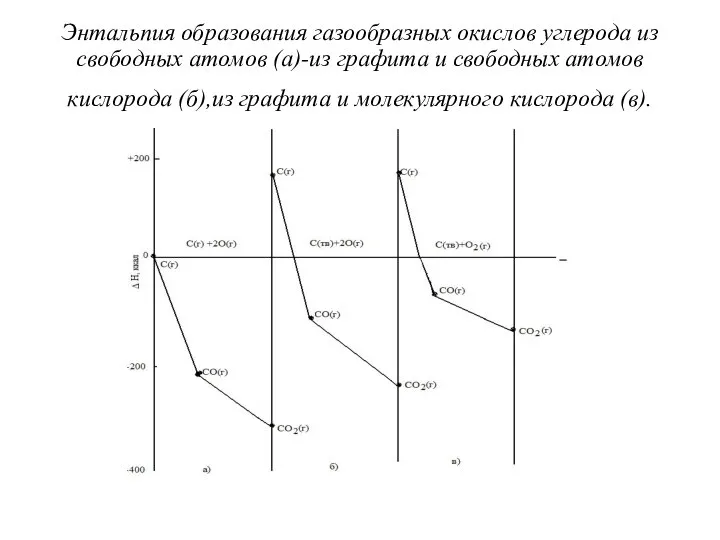
- 47. Энтальпия образования газообразных окислов углерода из свободных атомов (а)-из графита и свободных атомов кислорода (б),из графита
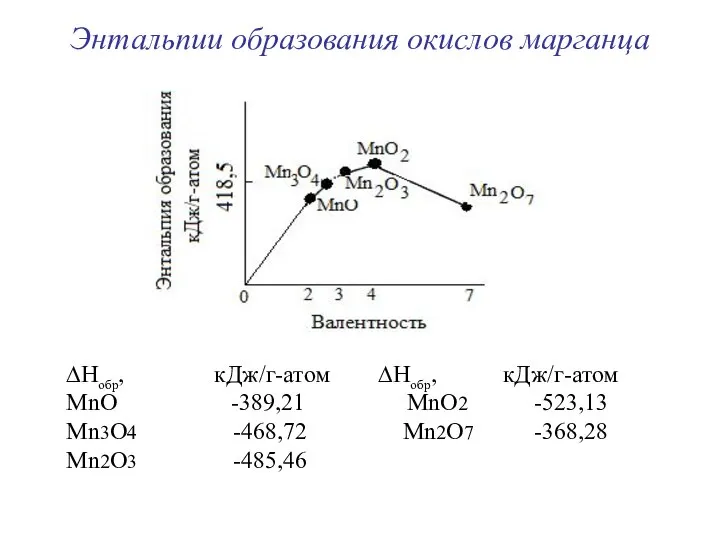
- 48. Энтальпии образования окислов марганца ∆Нобр, кДж/г-атом ∆Нобр, кДж/г-атом МnО -389,21 МnО2 -523,13 Мn3О4 -468,72 Мn2О7 -368,28
- 49. Если элемент А соединяется с элементом В, а энергия атомизации простого вещества А много больше, чем
- 50. Термодинамический цикл Борна - Габера Если, осуществляя процесс, поучается то же самое вещество, с которого начали,
- 51. Энтальпией растворения называют количество теплоты, поглощающейся или выделяющейся при растворении одного моля вещества в очень большом
- 52. Принцип Бертоло-Томсена Химические процессы осуществляются в том случае, если они сопровождаются выделением энергии, т. е. являются
- 53. Закон Клаузиуса Теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей
- 54. Энтропия Термодинамическая вероятность системы W - число микросостояний. Энтропия (S) - количественная мера беспорядка.(Дж/моль·К). Уравнение Больцмана:
- 55. Энтропия обратной реакции численно равна и противоположна по знаку энтропии прямой реакции. Изменение энтропии системы (ΔS0х.р.)
- 56. ΔS>0 - переход системы из более упорядоченного в менее упорядоченное состояние. ΔS Третий закон термодинамики При
- 57. Второй закон термодинамики в изолированной системе самопроизвольно протекают только те процессы, которые сопровождаются увеличением энтропии системы.
- 58. Уравнение Клаузиуса ΔS=ΔH·1000/T Связь энтропии и теплоемкости ΔS=С·2,303lgТ2/Т1 При фазовых переходах Qp=∆Нф.п. Sф.п.= ∆Нф.п./Т
- 59. Энергия Гиббса Энергия Гиббса (изобарно-изотермический потенциал) ΔG - максимальная работа, которую нужно совершить, чтобы остановить данную
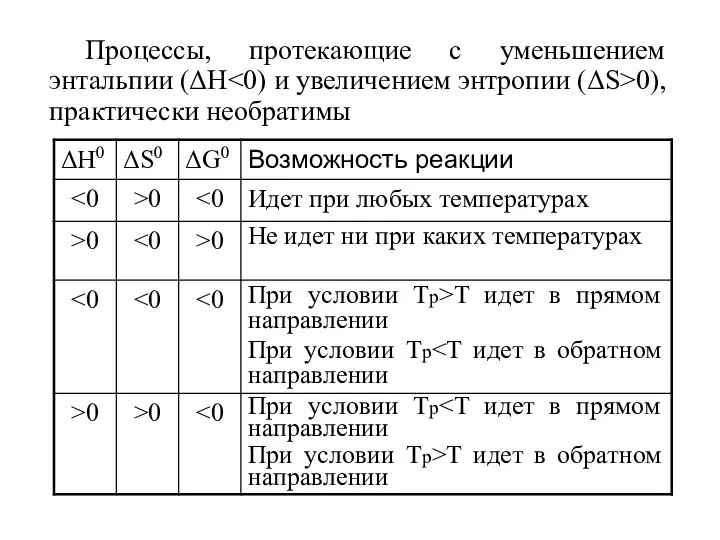
- 60. Процессы, протекающие с уменьшением энтальпии (ΔН 0), практически необратимы
- 61. Травновесн. = ΔН0 /ΔS0 Изменение энергии Гиббса системы при образовании 1 моля вещества из простых веществ,
- 62. Изотерма Вант-Гоффа имеет вид: Для реакции: dD+bB=lL+mM ΔG= ΔG0 + R·T·ln(ClL·CmM/ CdD·CbB) где С - концентрация
- 64. Скачать презентацию










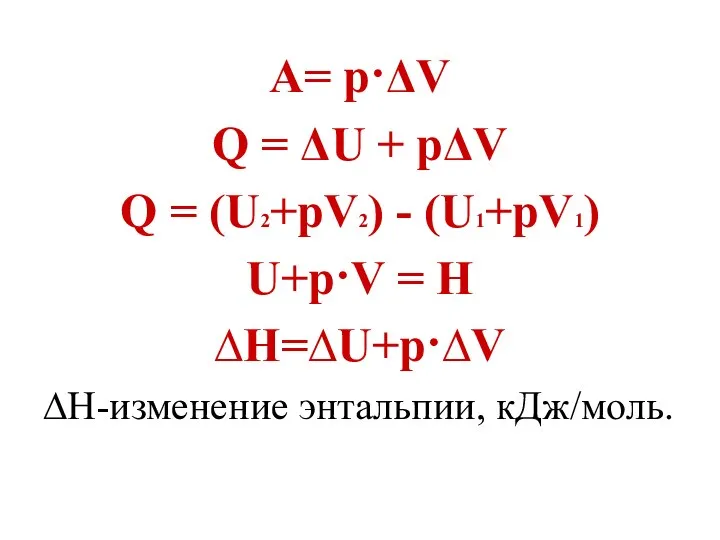










































 Нервная ткань
Нервная ткань  Оценочные шкалы в образовании
Оценочные шкалы в образовании Почему страдают праведники (христиане)
Почему страдают праведники (христиане) Презентация "Прожиточный минимум" - скачать презентации по Экономике
Презентация "Прожиточный минимум" - скачать презентации по Экономике ТЕМА 6 Издержки производства Издержки не существуют сами по себе. Они всегда появляются, когда есть стремление достичь резуль
ТЕМА 6 Издержки производства Издержки не существуют сами по себе. Они всегда появляются, когда есть стремление достичь резуль Сечения. Виды, изображение и обозначение сечений
Сечения. Виды, изображение и обозначение сечений «Эффективность урока – стимул к успеху учителя и ученика» Цель: определить взаимозависимость эффективности урока и качества обр
«Эффективность урока – стимул к успеху учителя и ученика» Цель: определить взаимозависимость эффективности урока и качества обр Погляди фахівців НАТО
Погляди фахівців НАТО  Эндокринная система человека Эндокринную систему составляют так называемые железы внутренней секреции, выделяющие в организм фи
Эндокринная система человека Эндокринную систему составляют так называемые железы внутренней секреции, выделяющие в организм фи Конструирование элементов ременных и цепных передач
Конструирование элементов ременных и цепных передач Compact NSX 100 - 630 А. Автоматические выключатели и выключатели-разъединители низкого напряжения
Compact NSX 100 - 630 А. Автоматические выключатели и выключатели-разъединители низкого напряжения 4.2-Служба-трансфузиологии-многопрофильной-больницы
4.2-Служба-трансфузиологии-многопрофильной-больницы Визуализация 4 комплектов – сантехника разной цены и позиционирования (от комфорта до бизнеса)
Визуализация 4 комплектов – сантехника разной цены и позиционирования (от комфорта до бизнеса) Жилой комплекс Алатау
Жилой комплекс Алатау Ready for labour and defense
Ready for labour and defense Национальная безопасность Польши
Национальная безопасность Польши Презентация на тему "Программа “Школа России” (под ред. А. Плешакова)" - скачать презентации по Педагогике
Презентация на тему "Программа “Школа России” (под ред. А. Плешакова)" - скачать презентации по Педагогике Методы оценки эффективности управленческих решений на примере учебных групп института пограничного профиля
Методы оценки эффективности управленческих решений на примере учебных групп института пограничного профиля Гражданско-правовая ответственность за земельные правонарушения
Гражданско-правовая ответственность за земельные правонарушения  Исследовательская деятельность младших школьников Инновации в начальной школе
Исследовательская деятельность младших школьников Инновации в начальной школе Термодинаміка біологічних систем
Термодинаміка біологічних систем  Скрытая угроза нашему счастью
Скрытая угроза нашему счастью мир музыкальных образов
мир музыкальных образов Путешествие в Японию
Путешествие в Японию Высшее образование в России 2
Высшее образование в России 2  Сущность и формы познания
Сущность и формы познания Искусство в музыке
Искусство в музыке Византийская цивилизация
Византийская цивилизация