Содержание
- 2. Периодический закон Свойства простых тел (или веществ), также формы и свойства соединений элементов находятся в периодической
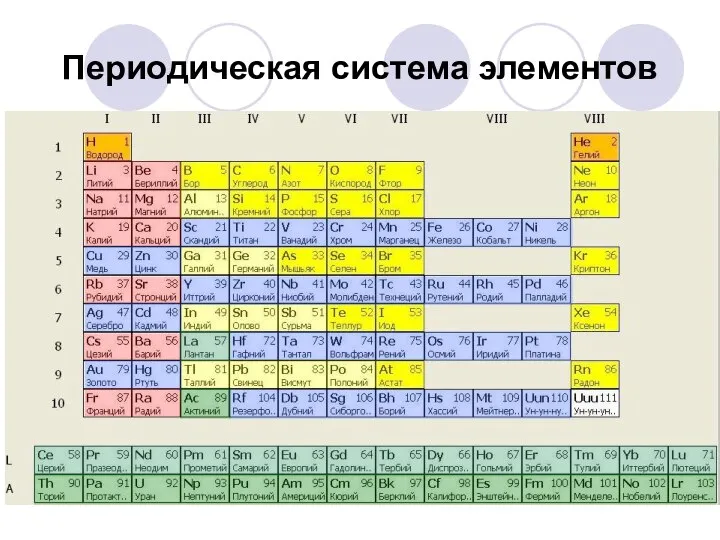
- 3. Периодическая система элементов
- 4. Современная формулировка ПЗ Свойства элементов находятся в периодической зависимости от заряда атомных ядер элементов. Периодический закон
- 6. Периоды 1. ns – подуровень ns2np6 Число элементов в периоде равно максимальному числу электронов на заполненных
- 7. Периодическая система s – блок Объединяет элементы 2 групп – IA и IIА, а также элементы
- 8. Периодическая система ПС Менделеева связана с периодическим изменением электронной конфигурации атомов элементов, а место элемента в
- 9. Электронные конфигурации атомов элементов I период 1Н 1) порядковый номер 1 1s1 заряд ядра +1 общее
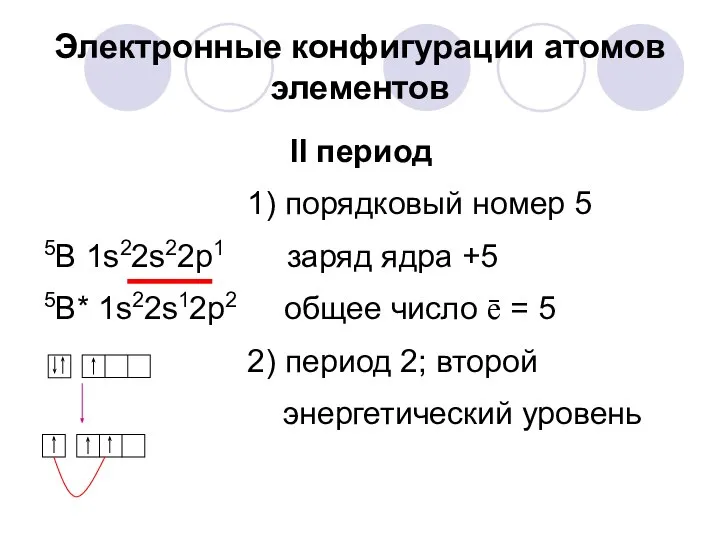
- 10. Электронные конфигурации атомов элементов II период 1) порядковый номер 5 5В 1s22s22p1 заряд ядра +5 5В*
- 11. III период 1) порядковый номер 13 13Al 1s22s22p63s23p1 заряд ядра +13 13Al* 1s22s22p63s13p2 общее число ē
- 12. Электронные конфигурации атомов элементов IV период 1) порядковый номер 24 24Cr 3s23p6 4s23d4 заряд ядра +24
- 13. Сравнительная характеристика химических свойств s, p, d элементов Химия s - элементов Щелочные и щелочноземельные металлы
- 14. Химические свойства s, p, d элементов Ca + 2HCl → CaCl2 + H2 Ca0 – 2ē
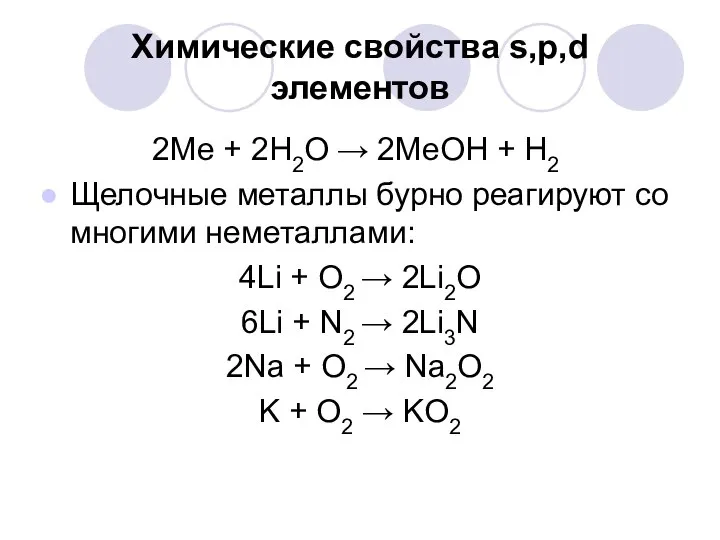
- 15. Химические свойства s,p,d элементов 2Ме + 2Н2О → 2МеОН + Н2 Щелочные металлы бурно реагируют со
- 16. Химические свойства s,p,d элементов Химия р - элементов Проявляют как окислительные, так и восстановительные свойства. Cl2
- 17. Химические свойства s,p,d элементов Химия d - элементов min c.o. +2 (исключение Au) max c.o. =
- 18. Химия d элементов
- 20. Скачать презентацию














 Масленица Кустодиев Борис Михайлович (1878-1927) (автопортрет) 5 класс Учитель: Перевозникова Е.В.
Масленица Кустодиев Борис Михайлович (1878-1927) (автопортрет) 5 класс Учитель: Перевозникова Е.В. ҚР оңтүстік аймақтарын табиғи газбен жабдықтау мәселелері
ҚР оңтүстік аймақтарын табиғи газбен жабдықтау мәселелері Инфекции
Инфекции Виды, разрезы, сечения
Виды, разрезы, сечения Индукционная плита
Индукционная плита Тематический урок русского языка с элементами ПДД.
Тематический урок русского языка с элементами ПДД. В поисках Истины
В поисках Истины Презентация Совет безопасности РФ
Презентация Совет безопасности РФ Презентация ООО «Допинг» для Freedom концерт-холл
Презентация ООО «Допинг» для Freedom концерт-холл Сохранение и популяризация историко-культурного и природного наследия Арктики: возможности компьютерной игры
Сохранение и популяризация историко-культурного и природного наследия Арктики: возможности компьютерной игры Меланоцитарные и нейрогенные опухоли
Меланоцитарные и нейрогенные опухоли правила личной гигиены Выполнила: Замараева Яна Ученица 4 «В» класса МОУ СОШ № 32 Г.Уссурийск 2011 г.
правила личной гигиены Выполнила: Замараева Яна Ученица 4 «В» класса МОУ СОШ № 32 Г.Уссурийск 2011 г. Liczby w Biblii
Liczby w Biblii Презентация на тему "Авторская технология взаимодействия участников образовательного процесса при организации системы монито
Презентация на тему "Авторская технология взаимодействия участников образовательного процесса при организации системы монито Дэвид Геслак. Упражнения для тренировок с особенными людьми
Дэвид Геслак. Упражнения для тренировок с особенными людьми Работы победителей муниципального этапа областного конкурса детского и юношеского изобразительного искусства «Я рисую
Работы победителей муниципального этапа областного конкурса детского и юношеского изобразительного искусства «Я рисую Школьная или обычная форма
Школьная или обычная форма Влияние занятий роллер спортом на состояние здоровья детей 10-12 лет
Влияние занятий роллер спортом на состояние здоровья детей 10-12 лет Презентация Таможенный платежи кроссворд
Презентация Таможенный платежи кроссворд Модели сущность-связь
Модели сущность-связь Презентация Классическое Средневековье (XI -XV вв.)
Презентация Классическое Средневековье (XI -XV вв.) ß-адреноблокаторы – величайший прорыв в лечении сердечно-сосудистых заболеваний
ß-адреноблокаторы – величайший прорыв в лечении сердечно-сосудистых заболеваний Социально-исторические предпосылки государства и права. Возникновение государства и права
Социально-исторические предпосылки государства и права. Возникновение государства и права Страхование ответственности за загрязнение окружающей среды (экологическое страхование) в России и за рубежом
Страхование ответственности за загрязнение окружающей среды (экологическое страхование) в России и за рубежом Kung fu and chinese martial arts
Kung fu and chinese martial arts Наш друг - спорт
Наш друг - спорт Распространенные заболевания человека
Распространенные заболевания человека Презентация на тему "Интерактивные методы обучения как фактор мотивации качества учебного материала" - скачать презентации п
Презентация на тему "Интерактивные методы обучения как фактор мотивации качества учебного материала" - скачать презентации п