Содержание
- 2. Адсорбция из растворов сильных электролитов. Ионообменники природные и синтетические, их использование в медицине Лекция №20 курса
- 3. Особенности адсорбции сильных электролитов Адсорбтивом в этом случае выступают ионы, а не молекулы. Ионы адсорбируются лишь
- 4. Ионы одного заряда по способности к адсорбции объединяются в лиотропные ряды. Причина лиотропных рядов ‒ радиус
- 5. Особенности адсорбции сильных электролитов Адсорбция сильных электролитов является избирательной. Избирательность обусловлена: знаком заряда поверхности адсорбента. На
- 6. Особенности адсорбции сильных электролитов Адсорбция сильных электролитов часто носит обменный характер. Ионообменной адсорбцией называют процесс, в
- 7. Типы ионообменников Природные: цеолиты (десмин, клиноптилолит, эрионит), глинистые минералы (монтмориллонит, палыгорскит, пермутит, вермикулит и др.). Синтетические:
- 8. Особенности ионообменной адсорбции Обратима Протекает во времени, т.е. требуется оптимальная скорость пропускания раствора через ионообменник. Часто
- 9. … основная количественная характеристика ионообменника. Выражается количеством вещества эквивалентов ионов (в ммоль), поглощённых 1 г сухого
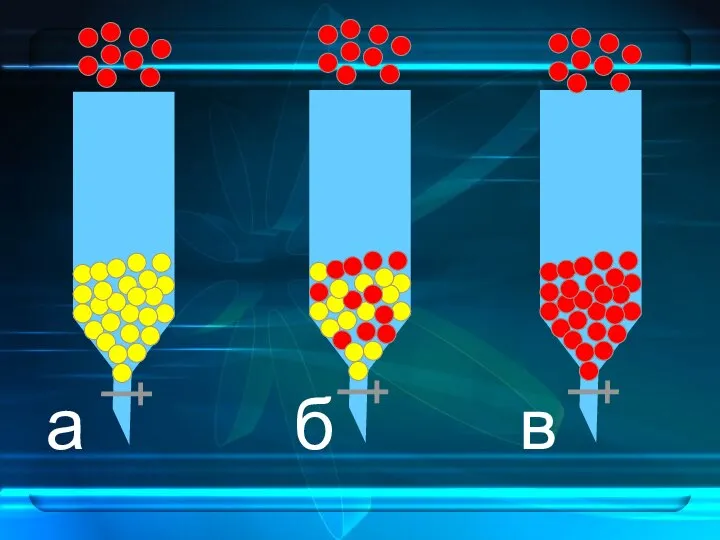
- 10. а б в
- 11. 1 способ: по количеству исходного вещества 2 способ: по количеству продукта ионного обмена а) начало работы
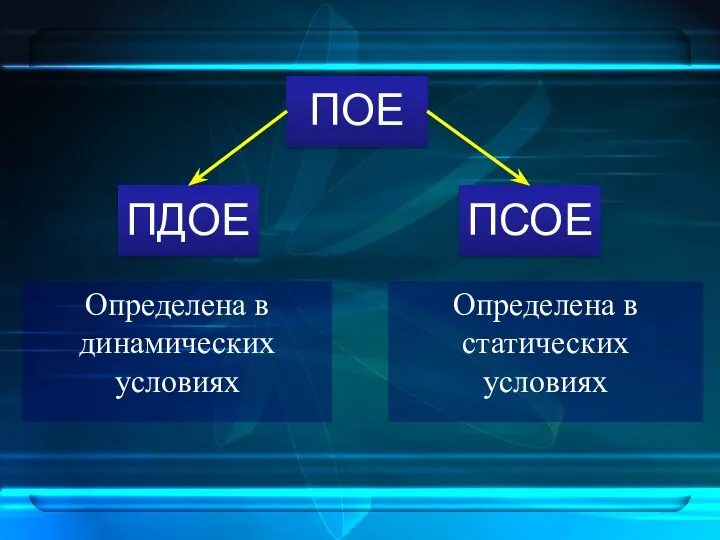
- 12. ПОЕ ПДОЕ ПСОЕ Определена в динамических условиях Определена в статических условиях
- 13. Определение массы сухого ионита По насыпной массе (Δ) ‒ масса 1 см3 ионита [г/см3]. mсух =
- 15. Скачать презентацию










 Тренинг Пробуждения
Тренинг Пробуждения Сохранение традиций. НХК.
Сохранение традиций. НХК. Простые программы
Простые программы Конструкция свайных ростверков
Конструкция свайных ростверков Презентация Молочная промышленность
Презентация Молочная промышленность  Автомат Уилкса. Микропрограммное устройство
Автомат Уилкса. Микропрограммное устройство  Видеостраничка. Для досудебного урегулирования налоговых споров
Видеостраничка. Для досудебного урегулирования налоговых споров Орг цех
Орг цех Презентация на тему "Формы воспитания ребенка как результат взаимоотношений в семье" - скачать презентации по Педагогике
Презентация на тему "Формы воспитания ребенка как результат взаимоотношений в семье" - скачать презентации по Педагогике ТС сигналдарын қабылдау және кодадан шығару кезіндегі орталық пост аппаратураларының жұмысы
ТС сигналдарын қабылдау және кодадан шығару кезіндегі орталық пост аппаратураларының жұмысы Презентация Подведение итогов за май 2016
Презентация Подведение итогов за май 2016 Договоры в Римском частном праве
Договоры в Римском частном праве Выразительные возможности графических материалов - презентация для начальной школы_
Выразительные возможности графических материалов - презентация для начальной школы_ Планирование и прогнозирование в системе менеджмента
Планирование и прогнозирование в системе менеджмента  Эскизный альбом для проведения экспертизы на земельный участок,
Эскизный альбом для проведения экспертизы на земельный участок, ТЕМА № 3. Природные предпосылки социально-экономического развития России
ТЕМА № 3. Природные предпосылки социально-экономического развития России Физическое воспитание детей раннего и дошкольного возраста. (Лекция 3)
Физическое воспитание детей раннего и дошкольного возраста. (Лекция 3) Водные виды спорта
Водные виды спорта Маргарин
Маргарин Популяризация аэробики среди молодежи г. Самара и Самарской области
Популяризация аэробики среди молодежи г. Самара и Самарской области Іконографічна виразність українського іконостасу XVII ст
Іконографічна виразність українського іконостасу XVII ст Как устроен организм человека
Как устроен организм человека Основы организации бухгалтерского учета в банках
Основы организации бухгалтерского учета в банках Тау жыныстармен кендердің тығыздығы
Тау жыныстармен кендердің тығыздығы Остов, кривошипно-шатунний та газорозподільний механізми ДВЗ. (Лекція 3.1)
Остов, кривошипно-шатунний та газорозподільний механізми ДВЗ. (Лекція 3.1) Презентация Особые экономические зоны в Нидерландах
Презентация Особые экономические зоны в Нидерландах Современная скульптура. Новые материалы
Современная скульптура. Новые материалы Форум во заедницата Техничка опрема за одржување на канализациската мрежа
Форум во заедницата Техничка опрема за одржување на канализациската мрежа