Содержание
- 2. Повторение темы «Элементы I и II группы А» Практикум (15 минут) 1 вариант: 1.Напишите строение электронной
- 3. Сколько грамм магния надо взять, чтобы получить 0,5 моль оксида магния?
- 4. Положение алюминия в системе и строение его атома Напишите схему строения атома алюминия и определите по
- 5. Физические свойства алюминия
- 6. Получение алюминия Составьте уравнение реакции электролиза оксида алюминия.
- 7. Химические свойства алюминия 1. реагирует с неметаллами Al + O2 = Al + I2 = Al
- 8. Химические свойства алюминия 3. реагирует с р-рами солей Al + CuCl2 = 4. реагирует с водой
- 9. На каких физических и химических свойствах алюминия и его сплавов основано их применение ? Металлический блеск
- 10. в электротехнике Высокая электропроводность; Высокая теплопроводность; Стойкость к коррозии
- 11. в быту Пластичность; Нетоксичность
- 12. в самолето-, мосто-, судостроении Малая плотность (легкость); Прочность в сплавах
- 13. алюминотермический способ получения металлов Сильный восстановитель
- 14. в пиротехнике Горение ослепительным пламенем
- 15. Домашнее задание § 13 выучить хим. свойства алюминия
- 16. Соединения алюминия Урок 2
- 17. В каком виде встречается алюминий в природе? Какое место по распространенности в земной коре занимает алюминий
- 18. Природные соединения алюминия: 1.Алюмосиликаты Полевой шпат – K2O ∙ Al2O3 ∙ 6SiO2 Каолинит – составная часть
- 19. 2. Боксит - Al2O3 алюминиевая руда
- 20. 3. Корунд - Al2O3 сапфир рубин
- 21. Наждак – мелкозернистая разновидность корунда. применяется как абразивный (шлифовочный) материал.
- 22. Оксид алюминия - … оксид. Белое вещество с очень высокой температурой плавления ( свыше 20000С). Задание.
- 23. Гидроксид алюминия Белое студенистое вещество. Задание. Какие вы знаете способы его получения? Запишите уравнения реакций.
- 24. Доказательство амфотерности Взаимодействие с кислотой как основание Al(OH)3 ↓ + HNO3 = Взаимодействие с основанием как
- 25. Вставьте пропущенное слово Оксид алюминия Al2O3 по характеру … оксид. Гидроксид алюминия Al(OH)3 по характеру …
- 27. Скачать презентацию























 Редкие растения Тамбовской области
Редкие растения Тамбовской области Жиделев Артем
Жиделев Артем Внутренняя среда организмов
Внутренняя среда организмов Съедобные грибы
Съедобные грибы Подготовка к контрольному тестированию по теме «Дыхательная система»
Подготовка к контрольному тестированию по теме «Дыхательная система»  Физическое развитие детей от рождения до года
Физическое развитие детей от рождения до года Чем подкармливать птиц зимой
Чем подкармливать птиц зимой Птица антарктики - альбатрос
Птица антарктики - альбатрос Микроорганизмы в природных экосистемах и их использование при решении экологических проблем. Геохимическая деятельность бактерий
Микроорганизмы в природных экосистемах и их использование при решении экологических проблем. Геохимическая деятельность бактерий Генномодифицированные организмы и продукты
Генномодифицированные организмы и продукты Хвороби людини, що викликаються одноклітинними тваринами
Хвороби людини, що викликаються одноклітинними тваринами Тип Хордовые
Тип Хордовые Актинидия. Биологические особенности
Актинидия. Биологические особенности Общая биология. Вода. Химические элементы
Общая биология. Вода. Химические элементы Фотосинтез. Световая фаза
Фотосинтез. Световая фаза ДОМАШНИЕ ПИТОМЦЫ Виктория Кузнецова
ДОМАШНИЕ ПИТОМЦЫ Виктория Кузнецова Онтофилогенетические нарушения развития дыхательной системы человека
Онтофилогенетические нарушения развития дыхательной системы человека Регуляция метаболизма. Гормоны
Регуляция метаболизма. Гормоны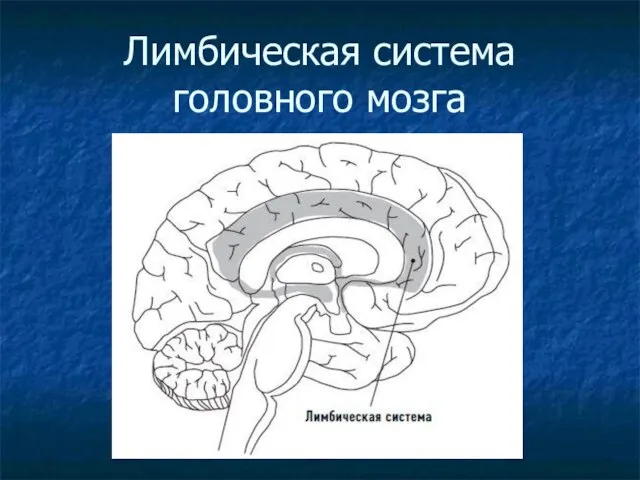 Лимбическая система головного мозга
Лимбическая система головного мозга Особенности организации сцифоидных медуз и гребневиков
Особенности организации сцифоидных медуз и гребневиков Презентация на тему "Дмитрий Иванович Мендилеев" - скачать презентации по Биологии
Презентация на тему "Дмитрий Иванович Мендилеев" - скачать презентации по Биологии Генетический консультант
Генетический консультант Полосатый рейс онлайн - квиз
Полосатый рейс онлайн - квиз Изучение запросов учащихся младших классов на содержание меню школьной столовой Над проектом работали: Сигурко Елена Панченко М
Изучение запросов учащихся младших классов на содержание меню школьной столовой Над проектом работали: Сигурко Елена Панченко М Майстерність маскування тварин
Майстерність маскування тварин Закономерности наследования признаков
Закономерности наследования признаков Насекомые Хвалынского парка
Насекомые Хвалынского парка Розовые озера
Розовые озера